

БИОХИМИЯ, 1 СЕМИНАР (31.08.2020)
ИЗОЭЛЕКТРИЧЕСКАЯ ТОЧКА АМИНОКИСЛОТ И ПЕПТИДОВ. ОТ ЧЕГО ОНА ЗАВИСИТ? ВЛИЯНИЕ
ИЗМЕНЕНИЯ РН НА ЗАРЯД И РАСТВОРИМОСТЬ ПЕПТИДОВ И БЕЛКОВ:
Изоэлектрическая точка (pI, «ПэИ») — значение рН, при котором белок находится в изоэлектрическом состоянии. То есть число «+» групп равно числу «-», и общий заряд равен нулю.
Изоэлектрическая точка зависит от состава белка. pI < 5,5 КИСЛОТНЫЕ группы преобладают
5,5 < pI < 7,0 КИСЛОТНЫЕ И ОСНОВНЫЕ группы поровну 7 < pI ОСНОВНЫЕ группы преобладают
Если pH<pI – белок в катионной форме и перемещается к катоду
Если pH>pI – белок в анионной форме и перемещается к аноду
Растворимость, вязкость и осмотическое давление зависят от рН точно так же, как и степень набухания. Если рН ближе к изоэлектрической точке, все эти свойства минимальны. Если рН дальше от pI — свойства максимальны.
СВОЙСТВА БЕЛКОВ АМФОТЕРНОСТЬ, ИОНИЗАЦИЯ (ЗАРЯД), ГИДРАТАЦИЯ, РАСТВОРИМОСТЬ:
Амфотерность связана с наличием в молекуле белка катионообразующих групп - аминогрупп и анионообразующих - карбоксильных группу. Знак заряда молекулы зависит от количества свободных групп. Если преобладают карбоксильные группы то заряд молекулы отрицательный (проявляются свойства слабой кислоты), если аминогруппы - то положительный (основные свойства).
Большинство глобулярных белков относятся к гидрофильным веществам, хорошо растворяющимся в воде. Это свойство обусловлено расположенными на поверхности белка группами, способными гидратироваться. Под гидратацией понимается связывание диполей воды с ионными и полярными группами белка, такими как -СОО` , - NН3+, -СОNH2 , -OH, -SH , в результате чего образуется гидратная оболочка белков. Благодаря этому каждая молекула белка покрывается несколькими молекулярными слоями воды, т.е. одна молекула белка отделена от другой слоем воды и находится в состоянии истинного раствора. Растворимость белков в воде возрастает при добавлении небольших количеств нейтральных солей (сульфат аммония, сульфат натрия, сульфат магния). Небольшие концентрации солей увеличивают степень диссоциации ионизированных групп, экранируют заряженные группы белка и тем самым уменьшают белок-белковое взаимодействие. Высокие концентрации нейтральных солей, напротив, осаждают белки из водных растворов, т.к. при больших концентрациях соли оттягивают на себя от молекул белка молекулы воды, т.е. лишают белок его гидратной оболочки. Так как, степень диссоциации ионогенных групп белка определяет возможности гидратации белка они хуже растворяются при рН равной его изоэлектрической точке (ИЭТ).
АМИНОКИСЛОТЫ - СТРУКТУРНЫЕ КОМПОНЕНТЫ БЕЛКА. ПЕПТИДНАЯ СВЯЗЬ, РЕАКЦИЯ ЕЕ
ОБРАЗОВАНИЯ. СВОЙСТВА ПЕПТИДНОЙ СВЯЗИ:
Что же касается самого процесса образования пептидной связи между аминокислотами, то она образуется при оттягивании электронной плотности с атома водорода аминогруппы одной аминокислоты и атомом кислорода карбоксильной группы другой аминокислоты.
Как следствие разрываются соединения между N и H в аминогруппе и между C и OH в карбоксильной группе. Соединение протона и гидроксильной группы в результате образует воду, а два аминокислотных остатка – дипептид.
Важными свойствами пептидной связи являются копланарность и трансположение:

Копланарность означает, что все атомы, входящие в пептидную группу находятся на одной плоскости, а атомы H и О располагаются по разные стороны от пептидной связи. Но стоит заметить, что радикальные группы аминокислот и водорода при α-углеродах лежат за пределами плоскости.
Трансположение означает, что кислород и водород пептидной связи находятся в транс-ориентации. Также в транс-ориентации ориентированы аминокислотные R-группы во всех белковых и пептидных молекулах естественного происхождения.
СТРУКТУРНЫЕ ФОРМУЛЫ ПРОТЕИНОГЕННЫХ АМИНОКИСЛОТ:
КЛАССИФИКАЦИЯ АМИНОКИСЛОТ:
по биологической роли (заменимые и незаменимые)
По необходимости для организма выделяют такие, которые не синтезируются в организме и должны поступать с пищей – незаменимые аминокислоты (лейцин, изолейцин, валин, фенилаланин, триптофан, треонин, лизин,

метионин). К заменимым относят такие аминокислоты, углеродный скелет которых образуется в реакциях метаболизма и способен каким-либо образом получить аминогруппу с образованием сответствующей аминокислоты. Две аминокислоты являются условно незаменимыми (аргинин, гистидин), т.е. их синтез происходит в недостаточном количестве, особенно это касается детей.
по физико-химическим свойствам (нейтральные, кислые, основные, гидрофобные, гидрофильные)
По кислотно-основным свойствам подразделяют нейтральные (большинство), кислые (аспарагиновая и глутаминовая кислоты) и основные (лизин, аргинин, гистидин) аминокислоты, гидрофобные: ала, вал, лей, иле, фен, три, мет, гидрофильные: гли, сер, тре, тир, цис, глн, асн..
по химическому строению (с алифатическими радикалами, с дополнительной функциональной группой, с ароматическим и гетероциклическим радикалом, иминокислоты)
алифатические (аланин, валин, лейцин, изолейцин, пролин, глицин), ароматические (фенилаланин, тирозин, триптофан), серусодержащие (цистеин, метионин), содержащие ОН-группу (серин, треонин, опять тирозин),
содержащие дополнительную СООН-группу (аспарагиновая и глутаминовая кислоты), дополнительную NH2-группу (лизин, аргинин, гистидин, также глутамин, аспарагин).
по растворимости в воде (неполярные, полярные незаряженные, полярные отрицательно и положительно заряженные)
Неполярные: Ала, Вал, Лей, Иле, Мет, Про, Фен, Тир, Три
Полярные незаряженные: Гли, Сер, Тре, Цис, Глн, Асн Полярные заряженные отрицательно: Глу, Асп Полярные заряженные положительно: Лиз, Арг, Гис
УРОВНИ ОРГАНИЗАЦИИ СТРУКТУРЫ БЕЛКОВЫХ МОЛЕКУЛ (ПЕРВИЧНАЯ, ВТОРИЧНАЯ, ТРЕТИЧНАЯ,
ЧЕТВЕРТИЧНАЯ):
Первичная, вторичная, третичная структуры. Связи, участвующие в стабилизации структур. Зависимость биологических свойств белков от вторичной и третичной структуры. Четвертичная структура белков. Зависимость биологической активности белков от четвертичной структуры (изменение конформации протомеров).
Первичная структура белка - последовательность аминокислот в полипептидной цепи (ППЦ). Пептидная связь формируется только за счет альфа-аминогруппы и альфа-карбоксильной группы аминокислот.
Вторичная структура - это пространственная организация стержня полипептидной цепи в виде α-спирали или β- складчатой структуры. В α-спирали на 10 витков приходится 36 аминокислотных остатков. Фиксируется α-спираль с помощью водородных связей между NH-группами одного витка спирали и С=О группами соседнего витка. β- Складчатая структура удерживается также водородными связями между С=О и NH-группами.
Третичная структура - особое взаимное расположение в пространстве спиралеобразных и складчатых участков полипептидной цепи. В формировании третичной структуры участвуют прочные дисульфидные связи и все слабые типы связей (ионные, водородные, гидрофобные, Ван-дер-ваальсовые взаимодействия).
Четвертичная структура – трехмерная организация в пространстве нескольких полипептидных цепей. Каждая цепь называется субъединицей (или протомером). Поэтому белки, обладающие четвертичной структурой, называют олигомерными белками.

СВЯЗИ, УЧАСТВУЮЩИЕ И ФОРМИРОВАНИИ УРОВНЕЙ СТРУКТУРЫ БЕЛКА. ФУНКЦИОНАЛЬНЫЕ ГРУППЫ АМИНОКИСЛОТ, ОТВЕТСТВЕННЫЕ ЗА ОБРАЗОВАНИЕ ЭТИХ СВЯЗЕЙ СТРУКТУРА:
ЧЕТВЕРТИЧНАЯ СТРУКТУРА БЕЛКА. ЧТО ТАКОЕ КОМПЛЕМЕНТАРНОСТЬ ПРОТОМЕРОВ? В ЧЕМ ЗАКЛЮЧАЮТСЯ КООПЕРАТИВНЫЕ ИЗМЕНЕНИЯ КОНФОРМАЦИИ ПРОТОМЕРОВ?:
Четвертичная структура — это количество и способ укладки полипептидных цепей (протомеров) в пространстве. Протомеры связаны друг с другом посредством лишь нековалентных связей (ионных, водородных, гидрофобных). Причем протомеры взаимодействуют друг с другом только определенными участками своей поверхности (контактные участки).
Комплементарность - пространственное и химическое соответствие взаимодействующих поверхностей. Впадины и выступы на поверхности одной молекулы должны совпадать с выступами и впадинами на поверхности другой молекулы, как два куска неровно разорванной бумаги. Кроме того, функциональные группы радикалов аминокислот на одной контактирующей поверхности должны образовывать слабые химические связи с радикалами аминокислот на другой поверхности.
Кооперативные изменения конформации протомеров - Связывание одного протомера с лигандом изменяет конформацию этого протомера, а так же всего олигомера. Функциональная активность олигомерных белков может регулироваться аллостерическими лигандами.

КЛАССИФИКАЦИЯ БЕЛКОВ ПО ФУНКЦИОНАЛЬНЫМ ПРИЗНАКАМ (ЗАЩИТНЫЕ, СТРУКТУРНЫЕ
ТРАНСПОРТНЫЕ, СОКРАТИТЕЛЬНЫЕ ГОРМОНАЛЬНЫЕ, ФЕРМЕНТАТИВНЫЕ). ТРАНСМЕМБРАННЫЕ
БЕЛКИ. ПРИМЕРЫ БЕЛКОВ КАЖДОГО КЛАССА:
Белки или протеины количественно преобладают над всеми другими макромолекулами живой клетки. Белки участвуют во всех биологических процессах, выполняя разнообразные функции.
По характеру выполняемых функций белки можно разделить на следующие группы:
1.Ферменты - специализированные белки (но есть рибозимы небелковой природы), ускоряющие течение химических реакций. Так как ферменты, как и любые белки, имеют активный центр, они специфически связывают определённый лиганд (или группу похожих лигандов) и катализируют определённый тип
химического превращения данной молекулы. Например:
Протеолитический фермент трипсин разрушает в белках пептидные связи, образованные карбоксильной группой основных аминокислот - аргинина или лизина.
Фермент рибонуклеаза расщепляет фосфоэфирную связь между нуклеотидами в полинуклеотидной цепи.
2.Регуляторные белки - большая группу белковых гормонов, участвующих в поддержании постоянства
внутренней среды организма, которые воздействуют на специфические клетки-мишени. Например:
Гормон инсулин выделяется в кровь при повышении концентрации глюкозы в крови после еды и, стимулируя использование глюкозы клетками, снижает концентрацию глюкозы до нормы, т.е. восстанавливает гомеостаз.
Белок кальмодулин в комплексе с четырьмя ионами Са2+ может присоединяться к некоторым ферментам, меняя их активность.
Регуляторные ДНК-связывающие белки, присоединяясь в определённые моменты к специфичным участкам ДНК, могут регулировать скорость считывания генетической информации.
3.Рецепторные белки. Сигнальные молекулы (гормоны, нейромедиаторы) действуют на внутриклеточные процессы через взаимодействие со специфическими белками-рецепторами. Так, гормоны, циркулирующие в крови, находят клетки-мишени и воздействуют на них, специфично связываясь с белками-рецепторами, обычно встроенными в клеточную мембрану. Для гидрофобных регуляторных молекул, проходящих через клеточную мембрану, рецепторы локализуются в цитоплазме клеток.
4.Транспортные белки. Многие белки крови участвуют в переносе специфических лигандов из одного органа к другому. Часто в комплексе с белками переносятся молекулы, плохо растворимые в воде. Так, белок плазмы крови альбумин переносит жирные кислоты и билирубин (продукт распада тема), а гемоглобин эритроцитов участвует в переносе О2 от лёгких к тканям. Стероидные гормоны переносятся в крови специфическими транспортными белками. Транспортные белки участвуют также в переносе гидрофильных веществ через гидрофобные мембраны. Так как транспортные белки обладают свойством специфичности взаимодействия с лигандами, их набор в клеточной мембране определяет, какие гидрофильные молекулы могут пройти в данную клетку. С помощью белков-переносчиков в клетку проникают глюкоза, аминокислоты, ионы и другие молекулы.
5.Структурные белки. Некоторые белки, расположенные определённым образом в тканях, придают им форму, создают опору, определяют механические свойства данной ткани. Например, как уже говорилось выше, главным компонентом хрящей и сухожилий является фибриллярный белок коллаген, имеющий высокую прочность. Другой структурный белок (эластин) благодаря своему уникальному строению обеспечивает определённым тканям свойство растягиваться во всех направлениях (сосуды, лёгкие).
6.Защитные белки. Некоторые белки, в частности иммуноглобулины, обладают способностью узнавать и связывать чужеродные молекулы, вирусные частицы и бактерии, в результате чего происходит их нейтрализация. Кроме того, комплекс чужеродной частицы с иммуноглобулином легко узнаётся и

уничтожается клетками иммунной системы. Защитными свойствами обладают белки свёртывающей системы крови, например фибриноген, тромбин. Они участвуют в формировании тромба, который закупоривает повреждённый сосуд и препятствует потере крови.
7.Сократительные белки. Некоторые белки при выполнении своих функций наделяют клетку способностью либо сокращаться, либо передвигаться. К таким белкам относят актин и миозин - фибриллярные белки, участвующие в сокращении скелетных мышц. Другой пример таких белков - тубулин, из которого построены клеточные органеллы - микротрубочки. Микротрубочки в период деления клетки регулируют расхождение хроматид. Микротрубочки - важные элементы ресничек и жгутиков, с помощью которых клетки передвигаются.
ХАРАКТЕРИСТИКА ПРОСТЫХ БЕЛКОВ (АЛЬБУМИНЫ, ГЛОБУЛИНЫ ГИСТОНЫ, ПРОТАМИНЫ). ОТМЕТЬТЕ
ОСОБЕННОСТИ ИХ СТРОЕНИЯ И ФУНКЦИИ:
Некоторые белки содержат в своём составе только полипептидные цепи, состоящие из аминокислотных остатков. Их называют "простые белки".
Примером простых белков являются гистоны, альбумины, глобулины, протеины;
Структура простых белков представлена только полипептидной цепью (альбумин, инсулин). Однако необходимо понимать, что многие простые белки (например, альбумин) не существуют в „чистом" виде, они всегда связаны с какими-либо небелковыми веществами. Их относят к простым белкам, т.к. связи с небелковой группой слабые.
АЛЬБУМИНЫ
Группа белков плазмы крови с молекулярной массой около 40 кДа, имеют кислые свойства и отрицательный заряд при физиологических рН, т.к. содержат много глутаминовой кислоты. Легко адсорбируют полярные и неполярные молекулы, являются в крови переносчиком многих веществ, в первую очередь билирубина и жирных кислот.
ГЛОБУЛИНЫ
Группа разнообразных белков плазмы крови с молекулярной массой до 100 кДа, слабокислые или нейтральные. Они слабо гидратированы, по сравнению с альбуминами меньше устойчивы в растворе и легче осаждаются, что используется в клинической диагностике в „осадочных" пробах (тимоловая, Вельтмана). Часто содержат углеводные компоненты.
При обычном электрофорезе разделяются, как минимум, на 4 фракции – α1, α2, β и γ.
Так как глобулины включают в себя разнообразные белки, то их функции многочисленны. Часть α-глобулинов обладает антипротеазной активностью, что защищает белки крови от преждевременного разрушения, например, α1-антитрипсин, α1-антихимотрипсин, α2-макроглобулин.
Некоторые глобулины способны к связыванию определенных веществ: трансферрин (переносчик ионов железа), церулоплазмин (содержит ионы меди), гаптоглобин (переносчик гемоглобина), гемопексин (переносчик тема).
γ-Глобулины являются антителами и обеспечивают иммунную защиту организма.
ГИСТОНЫ
Гистоны – внутриядерные белки массой около 24 кДа. Обладают выраженными основными свойствами, поэтому при физиологических значениях рН заряжены положительно и связываются с дезоксирибонуклеиновой кислотой (ДНК)
ПРОТАМИНЫ
Это белки массой от 4 кДа до 12 кДа, имеются в ядрах сперматозоидов многих организмов, в сперме рыб (молóках) они составляют основную массу белка. Протамины являются заменителями гистонов и служат для организации хроматина в спермиях. По сравнению с гистонами протамины отличаются резко увеличенным содержанием аргинина (до 80%). Также, в отличие от гистонов, протамины обладают только структурной функцией, регулирующей функции у них нет, хроматин в сперматозоидах неактивен.
ХАРАКТЕРИСТИКА И ОСОБЕННОСТИ СТРОЕНИЯ КЛАССОВ СЛОЖНЫХ БЕЛКОВ:
Очень многие белки, кроме полипептидных цепей, содержат в своём составе небелковую часть, присоединённую к белку слабыми или ковалентными связями. Небелковая часть может быть представлена ионами металлов, какими-либо органическими молекулами с низкой или высокой молекулярной массой. Такие белки называют "сложные белки". Прочно связанная с белком небелковая часть носит название простетической группы. Сложный белок, состоящий из белковой части (апопротеин) и небелковой части (простетическая группа), называют "холопротеин".
Апопротеин + простетическая группа (ковалент. связи) = сложный белок (холопротеин)
Нуклеопротеины, их типы. Гистоны, их роль в образовании и укладке ДНК.
Нуклеопротеины – это белки, связанные с нуклеиновыми кислотами. Они составляют существенную часть рибосом, хроматина, вирусов.
Врибосомах рибонуклеиновая кислота (РНК) связывается со специфическими рибосомальными белками. Вирусы являются практически чистыми рибо- и дезоксирибонуклеопротеинами.
Ввирусах нуклеиновая кислота обеспечивает воспроизведение вируса в поражаемой клетке, а белковая часть позволяет взаимодействовать с мембраной клетки-хозяина, сохранять вирусную ДНК или РНК, осуществ-лять некоторые специфические ферментативные реакции.
Вхроматине нуклеиновая кислота представлена дезоксирибонуклеиновой кислотой, связанной с разнообразными белками, среди которых можно выделить две основные группы – гистоны и негистоновые белки. Начальный этап упаковки ДНК осуществляют гистоны, более высокие уровни обеспечиваются другими белками.
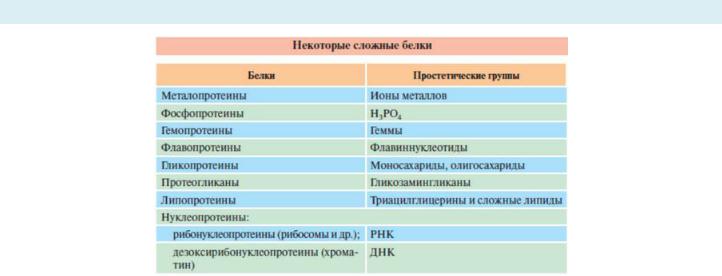
Вначале молекула ДНК обвивается вокруг гистонов, образуя нуклеосомы. Сформированная таким образом нуклеосомная нить напоминает бусы, которые складываются в суперспираль (хроматиновая фибрилла) и суперсуперспираль (хромонемма интерфазы). Благодаря гистонам и другим белкам в конечном итоге размеры ДНК уменьшаются в тысячи раз: длина ДНК достигает 6-9 см (10-1), а размеры хромосом – всего несколько микрометров (10-6).
Гистоны – внутриядерные белки массой около 24 кДа. Обладают выраженными основными свойствами, поэтому при физиологических значениях рН заряжены положительно и связываются с дезоксирибо-нуклеиновой кислотой (ДНК), образуя дезоксирибо-нуклеопротеины. Существуют 5 типов гистонов – очень богатый лизином (29%) гистон Н1, другие гистоны Н2а, H2b, НЗ, Н4 богаты лизином и аргинином (в сумме до 25%).
Радикалы аминокислот в составе гистонов могут быть метилированы, ацетилированы или фосфорилированы. Это изменяет суммарный заряд и другие свойства белков.
Можно выделить две функции гистонов:
1.Регуляция активности генома, а именно – они препятствуют транскрипции.
2.Структурная – стабилизируют пространственную структуру ДНК.
Гистоны в комплексе с ДНК образуют нуклеосомы – октаэдрические структуры, составленные из гистонов Н2а, H2b, НЗ, Н4. Гистон H1 связан с молекулой ДНК, не позволяя ей "соскользнуть" с гистонового октамера. ДНК обвивает нуклеосому 2,5 раза, после чего обвивает следующую нуклеосому. Благодаря такой укладке достигается уменьшение размеров ДНК в 7 раз.
Далее такие "бусы" нуклеосом могут складываться в суперспираль и в более сложную структуру нуклеопротеина.
Благодаря гистонам и формированию более сложных структур размеры ДНК, в конечном итоге, уменьшаются в тысячи раз: на самом деле длина ДНК достигает 6-9 см (10–1), а размеры хромосом – всего несколько микрометров (10–6).
Хромопротеины (гемопротеины, флавопротеины, ретинальпротеины). Понятие о химической структуре их основные представители и функции.
Хромопротеины содержат окрашенные простетические группы. К этим белкам относят гемопротеины (содержат гем), ретинальпротеины (содержат витамин А), флавопротеины (содержат витамин В2), кобамидпротеины (содержат витамин В12).
Гемопротеины подразделяются на:
1.неферментативные (гемоглобин, миоглобин),
2.ферменты (цитохромы, каталаза, пероксидаза).
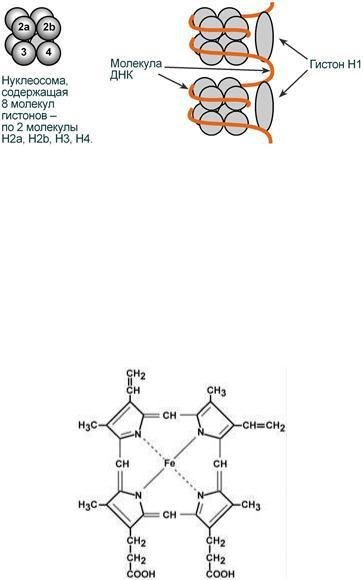
Небелковой частью гемопротеинов является гем – структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe2+. Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями.
Флавопротеины
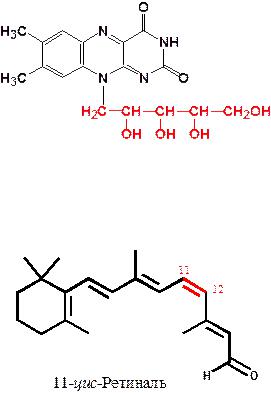
Являются ферментами окислительно-восстановительных реакций, например, сукцинатдегидрогеназа (в цикле трикарбоновых кислот), глицерол-3-фосфат дегидрогеназа (челночная система). Они содержат производные рибофлавина (витамина В2) - флавинмононуклеотид (ФМН) и флавинадениндинуклеотид (ФАД).
Ретинальпротеины
Родопсины – сложные белки, в которых апопротеин (опсин) связан с простетической группой, которая представлена цис-изомером ретиналя (альдегидной формой витамина А)
Гликопротеины и протеогликаны функции в организме. Представление об углеводной части.
Класс под названием гликопротеины или, более корректно, гликоконъюгаты – это белки, содержащие углеводный компонент, ковалентно присоединенный к полипептидной основе. Содержание углеводов в них варьирует от 1 до 85% по массе.
Выделяют два подкласса белков, содержащих углеводы: протеогликаны и гликопротеины. Между этими подклассами имеются существенные отличия:
Гликопротеины
1.доля углеводов 15-20%,
2.не содержат уроновых кислот,
3.углеводные цепи содержат не более 15 звеньев,
4.углевод имеет нерегулярное строение.
Для собственно гликопротеинов характерно низкое содержание углеводов. Углеводный остаток является олигосахаридом, имеет нерегулярное строение и содержит маннозу, галактозу, глюкозу, и их аминопроизводные, также N-ацетилнейраминовую кислоту. Олигосахарид присоединен к аминокислотам белковой цепи либо N-гликозидной связью - к амидному азоту аспарагина, либо О-гликозидной связью - к гидроксигруппе остатков серина, треонина, гидроксилизина.
Функцией гликопротеинов являются:
1. Структурная – клеточная стенка бактерий, костный матрикс, например, коллаген, эластин.
2.Защитная – например, антитела, интерферон, факторы свертывания крови (протромбин, фибриноген).
3.Рецепторная – присоединение эффектора приводит к изменению конформации белка-рецептора, что вызывает внутриклеточный ответ.
4.Гормональная – гонадотропный, адренокортикотропный и тиреотропный гормоны.
5.Ферментативная – холинэстераза, нуклеаза.
6.Транспортная – перенос веществ в крови и через мембраны, например, трансферрин, транскортин, альбумин, Na+,К+-АТФаза.
Протеогликаны
1.доля углеводов 80-85%,
2.имеются уроновые кислоты,
3.углеводные цепи крайне велики,
4.углевод имеет регулярное строение.
Другая группа гликоконъюгатов – протеогликаны – характеризуется наличием крупных полисахаридов, состоящих из повторяющихся дисахаридных остатков.
Дисахариды включают в себя какую-либо уроновую кислоту и аминосахар. Многократно дублируясь, дисахариды образуют олиго- и полисахаридные цепи – гликаны. Для углеводной части встречаются другие названия – кислые гетерополисахариды (т.к. имеют много кислотных групп), гликозаминогликаны (содержат аминогруппы). Избыток анионных групп (сульфатных, карбоксильных) придает молекулам гликозаминогликанов высокий отрицательный заряд.
Основными представителями структурных гликозаминогликанов являются гиалуроновая кислота, хондроитинсульфаты, кератансульфаты и дерматансульфаты. Эти молекулы входят в состав протеогликанов, функцией которых является заполнение межклеточного пространства и удержание здесь воды, также они выступают как смазочный и структурный компонент суставов и других тканевых структур.
Углеводная часть, аналогично с гликопротеинами, связывается с белком через остатки серина и аспарагина.
По функции структурные протеогликаны значимы для межклеточного пространства, особенно соединительной ткани, в которое погружены коллагеновые волокна. При помощи электронной микроскопии выяснено, что они имеют древовидную структуру – в центре находится гиалуроновая кислота, которая через связующие белки присоединяет многочисленные "веточки" из хондроитинсульфатов, кератансульфатов, дерматансульфатов. Молекулы гликанов весьма гидрофильны, создают сетчатый желеподобный матрикс и заполняют пространство между клетками, являясь преградой для крупных молекул и микроорганизмов.
Еще одним компонентом протеогликанов является гепарин, представлящий из себя полимерную сульфатированную цепь гетерополисахарида, связанную с белковым ядром через остатки серина. В крови гепарин, взаимодействуя с антитромбином III, образует комплекс, блокирующий факторы свертывания крови IIа, IХа, Ха, XIa и ХIIа, что применяется для профилактики тромбозов у больных различного профиля.
Липопротеины. Общая структура и функции транспортных липопротеинов (хиломикроны, липопротеины очень низкой плотности, липопротеины низкой плотности, липопротеины высокой плотности).
К липопротеинам, строго говоря, принадлежат только белки, содержащие ковалентно связанные липиды.
Однако традиционно к липопротеинам относят также надмолекулярные образования, переносящие липиды в плазме крови, включающие белки и молекулы всех классов липидов.
Концентрация и соотношение количества транспортных липопротеинов в крови играют ведущую роль в возникновении такой распространенной сосудистой патологии как атеросклероз.
