

Ферменбелковыекаккатализаторы
Актцентриспецифичностьвный
Ферменты – белковыекатализаторыускоряющорганизмереакцив до10^14степенираз.
Субстратнаяспецифичность |
|
Способносеагироватьферменодннесколькимиилитса |
|
субстратами. |
|
1)Абсолюспецифичностьтнаясубстра |
– толькосоднимизо ером |
субстрата |
|
2)Г рупповаясубспецифичностьтратная |
– сгруппойструктурно |
похожихсубстратов |
|
3) Стереоспецефичность – толькосоднимстереоизомеров данноговещества.
Каталитическаяспецифичность
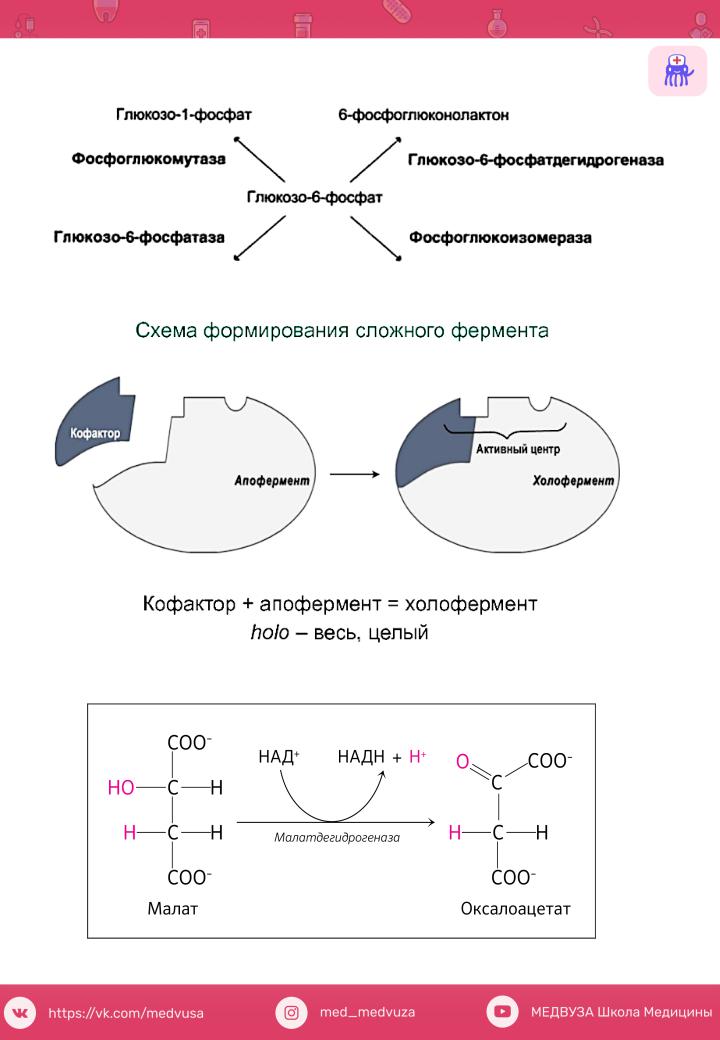
Способностьодногосубстреагироватьразныатафер. ментами
Коферменты.
Коферменты – органическиевещества,производныевитаминов, необходидляработыфер. мыента
Классыиподклассыферментов.
1. Оксидоредуктазы-катализируют окислительно-восстановительные реакции.
а) Дегидрогеназы - катализируютреакцдегидрирования.
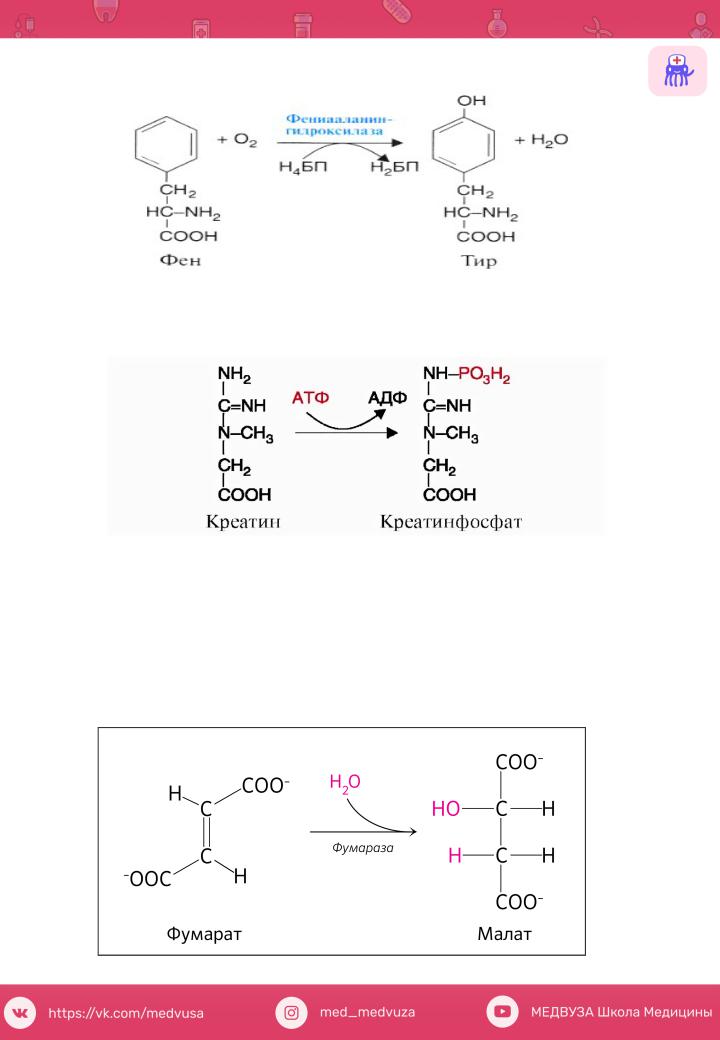
б) Гидроксилазы – включенатомакислородагидроксильнуюегруппу молекулысубстрата.
2.Трансферазы
Перефункциональныхосгрупп
Фосфотрансферазы = киназы
3.Гидроксилазы
Расщепковалентнсвязприсоединениемпоместуйды разрыва.
4.Лиазы
Катализируютотщепразгруппотениеичныхсубстратаили присвподвойнойединениеысвязи.
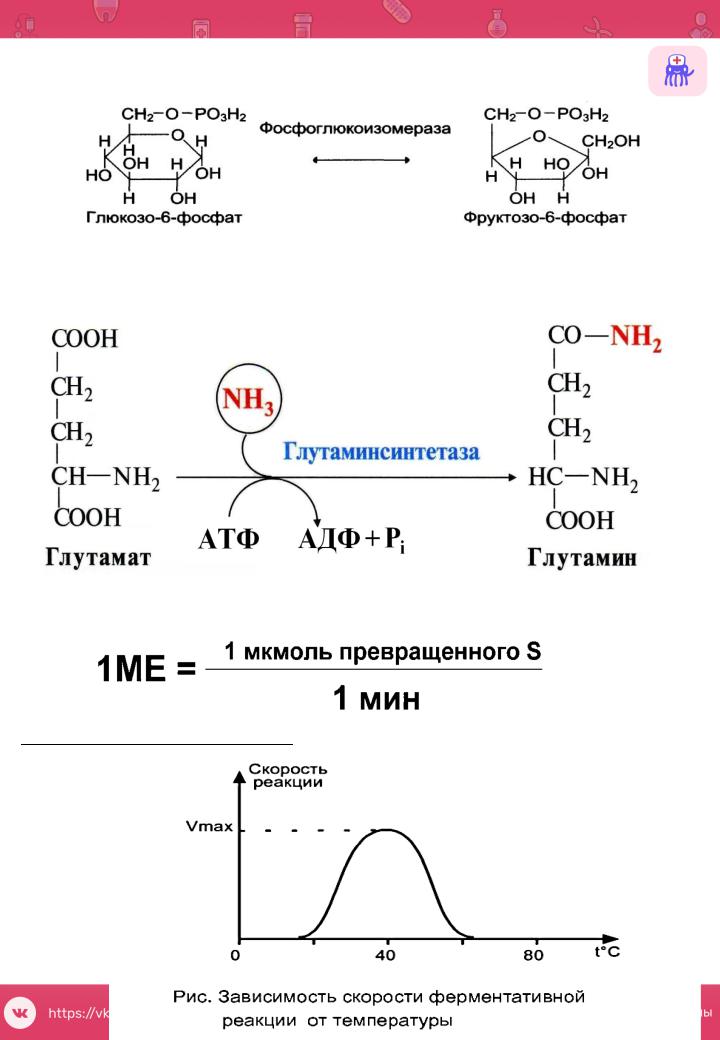
5.Изомеразы
Катализируют внутримолекулярныепревращения
6.Лигазы
Реакцииприсоединениядвухмолекулобразованиемковалентной связизатратойАТФ.
Кинфермтикаеакцийнтативных
Международнаяединицаактивности
Скоростьреакцзависитот: й
1)Температуры
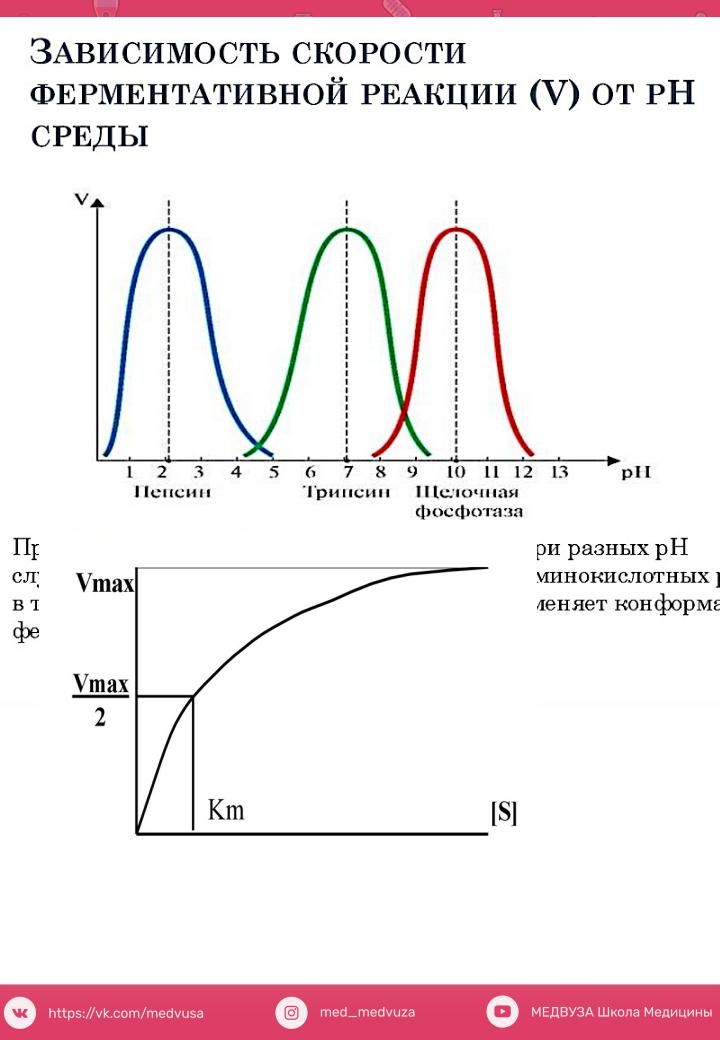
38 – денатурацбелков,снижениеактивностиферментовя. 2)PH среды
Кислотность влияет на степень ионизации аминокислотных радикалов, следовательно – на структуру активного центра.
3)Отконцрентрацииагирующихвеществ.
Константа Михаэлеса – числеравконноцентрациисубстрата,при котдостигройполовинам етсяккоростиимальнойреакц.
Чемнижеконстанта |
Михаэлиса – чемвышеспецифичферментак ость |
субстрату. |
|

Ингибактивноститоры ферментов
1)Обратингимоебирование – ингибиторысвязываются ферментомслабымисвязями
2)Необратимоеингибирование – сильными ковалентыми связями
Конкурентнингибирование Конкурмолсубстреингибиторакулнциязактивныйтацентр. Ингибитор – структурныйаналогсубстрата.
Конкурентнингибирование |
ацетилхолиэстеразы структурным |
анацетилхолиналогом |
– прозерином. |
Неконкурентное ингибирование
Ингибитор неявляетсяструктаналогомурнымбстрата, присоедневактцентреи,ивяетсягибируетомобратимо.

Регуляцияактивностиферментов
А)Аллостерическаярегуляция Б)Белок – белковыевзаимодействия
В) Фосфолилирование – дефосфолилирование ферментов Г)Частичный протеолиз.
А.Аллостерическаярегуляция
Ключевыереакции |
|
1)Необратимые реакции |
|
2)Реакциинаместеразвметаболвленияческого |
пути |
3)Скорослимитьирующие |
реакции |
4)Начальныереакцииметаболическогопути |
|
Б.Белокбелвзаимодействияовые |
|
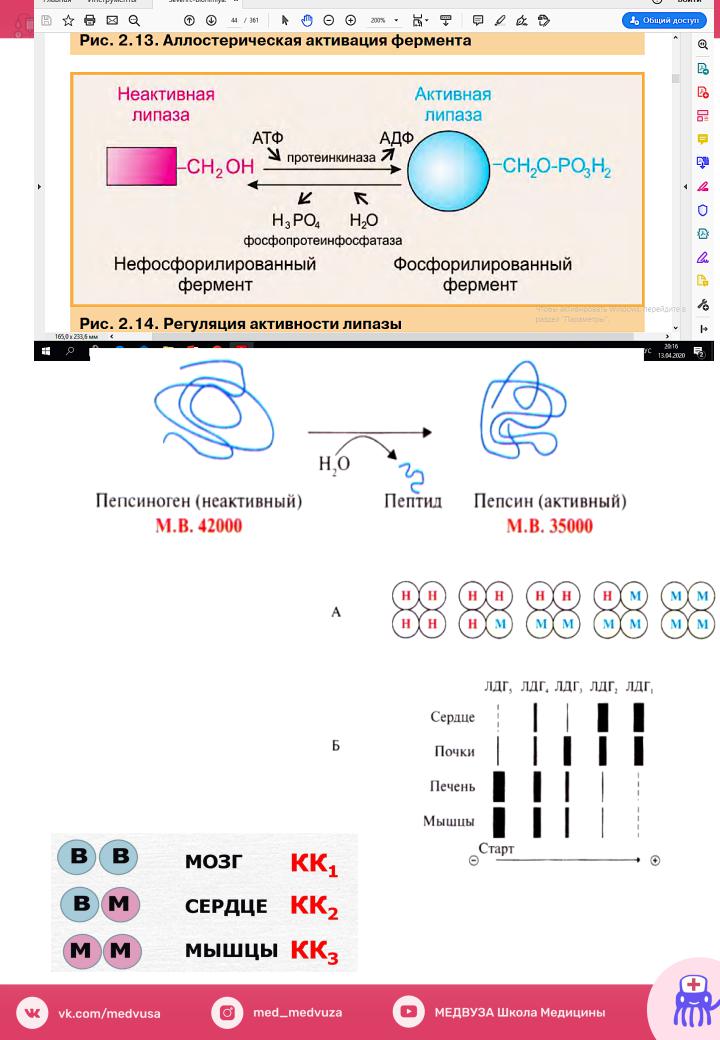
В. Фосфолилирование – дефосфолилирование
Г.Частичный протеолиз.
Энзимодиагностика
ЛДГ1иЛДГ2 |
– почкисердце |
ЛДГ4иЛДГ5 |
– скелетные |
мышцыипечень |
|
Креатинкиназа
