
Лапки в лабке
Белки и методы из разделения
Белки – это полимеры, состоящие из 19 альфа аминокислот и одной иминокислоты – пролина.
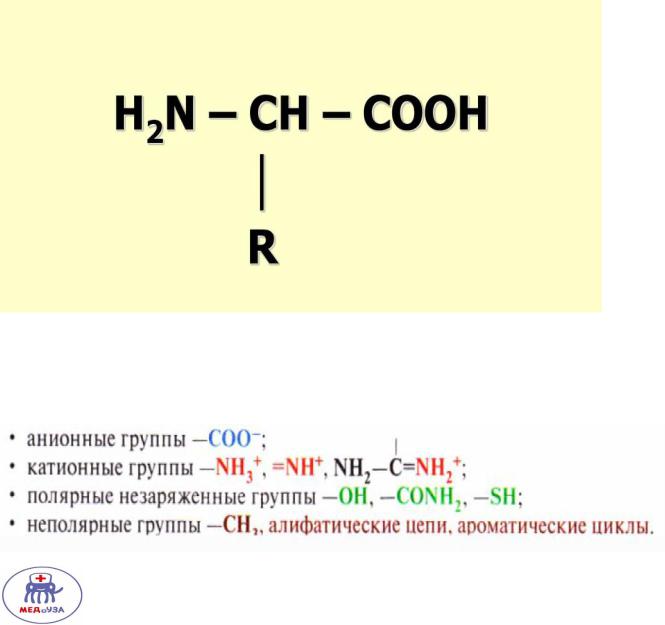
У аминокислоты выделяют карбоксильную, аминогруппу и радикал. Общая формула аминокислоты:
Различают следующие радикалы аминокислот
Растворимость аминокислот в воде.
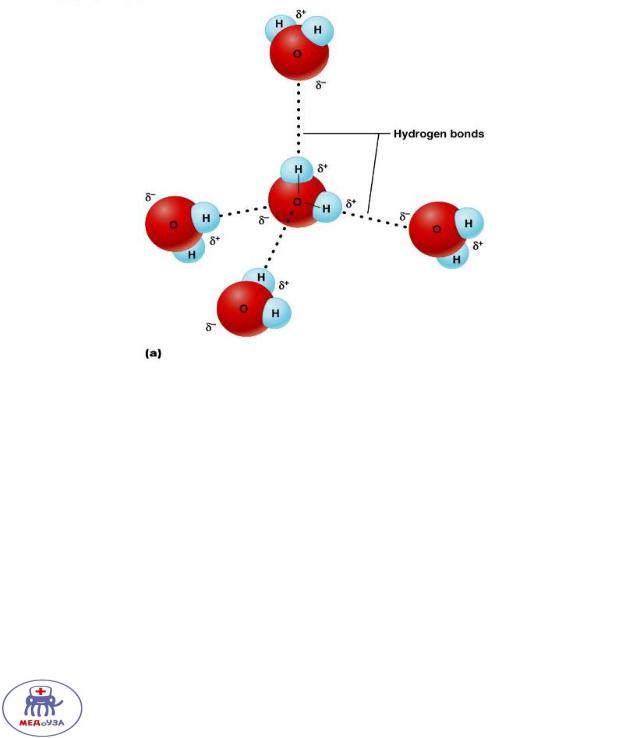
Вода является полярным соединением. Молекулы воды стабилизированы друг с другом водородными связями.
Водородная связь – связь между положительно заряженным водородом одной молекулы и отрицательно заряженным атомом другой молекулы.
В воде растворяются только полярные соединения - подобное растворяется в подобном).

Аминокислоты, содержащие положительно заряженные(анионные), отрицательно заряженные(катионные), полярные незаряженные группы растворимы в воде.
Аминокислоты, содержащие гидрофобные радикалы в воде не растворимы и взаимодействуют друг с другом при помощи гидрофобных связей.
Разделение аминокислот по радикалам
Уровни организации белков
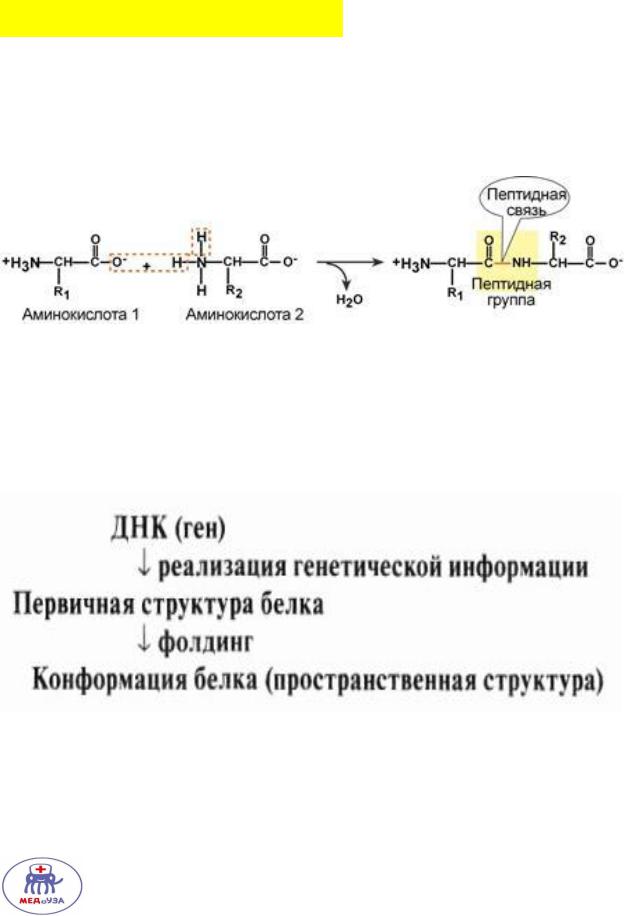
Первичная структура белка – линейная молекула, состоящая из аминокислот, связанных друг с другом пептидной связью.
Первичная структура белков каждом организме сугубо индивидуальна!
Первичная структура белка — это код, в котором заложена информация о последующих конформациях белка.

Конформация – трехмерная, компактная структура белка.
Фолдинг – процесс формирования конформации белка.
Вторичная структура белка.
Альфа спираль.
Спираль, образованная линейным полимером аминокислот, скрепленная водородными связями между кислородом карбоксильной группы и атомом водорода аминогруппы четвертой от него аминокислоты.
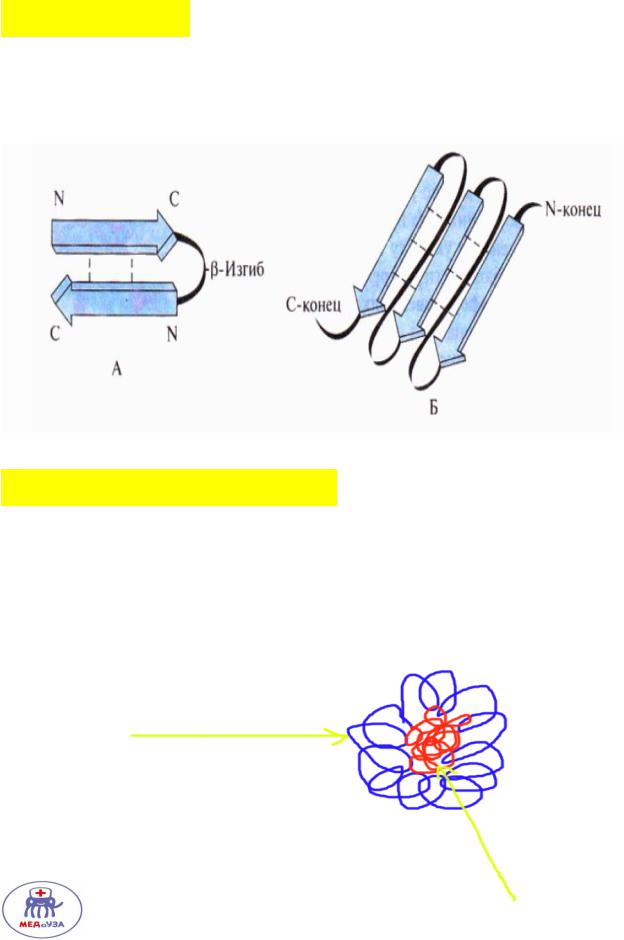
Бета структуры – аминокислотные цепи, скреплённые водородными связями и образующими так называемый бета лист.
Третичная структура белка – это конформация белковой молекулы, стабилизацию которой обеспечивают связи между радикалами аминокислот.
Гидрофильная оболочка Полярные 1.Отридцательно заряженные
2.Положительно заряженные
3.Незаряженные аминокислоты
Гидрофобное ядро
Неполярные аминокислоты

Связи между радикалами аминокислот
1.Ионная связь – между катионным и анионным радикалом
2.Водородная связь – между гидрофильной незаряженной и любым другим радикалом
3.Гидрофобные взаимодействия – между гидрофобными радикалами.
4.Дисульфидные связи – между остатками цистеин
Активный центр белка
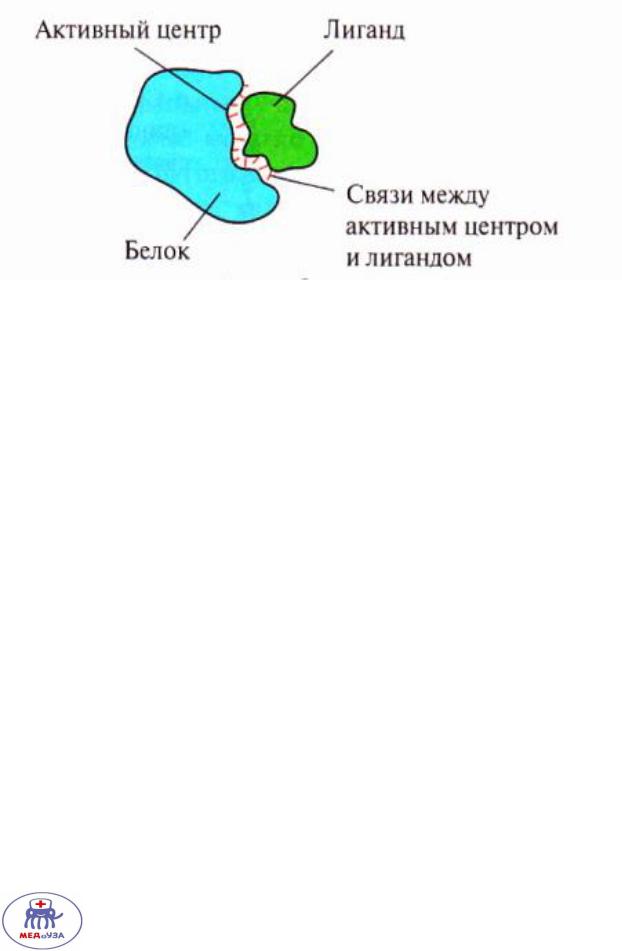
Лиганд и активный центр должны соответствовать друг другу как структурно, как и химически!
Роль лигандов в функционировании белков
1.Вспомогательная роль в функционировании белков
– лиганд как кофактор.
Сложный белок – имеет в своем строении небелковую часть.
Гемоглобин (простетическая группа - гем).
2.Проявление функции белков
а. Альбумины переносят жирные кислоты (транспортная функция)
б. Трипсин расщепляет белки (протеолитическая функция).
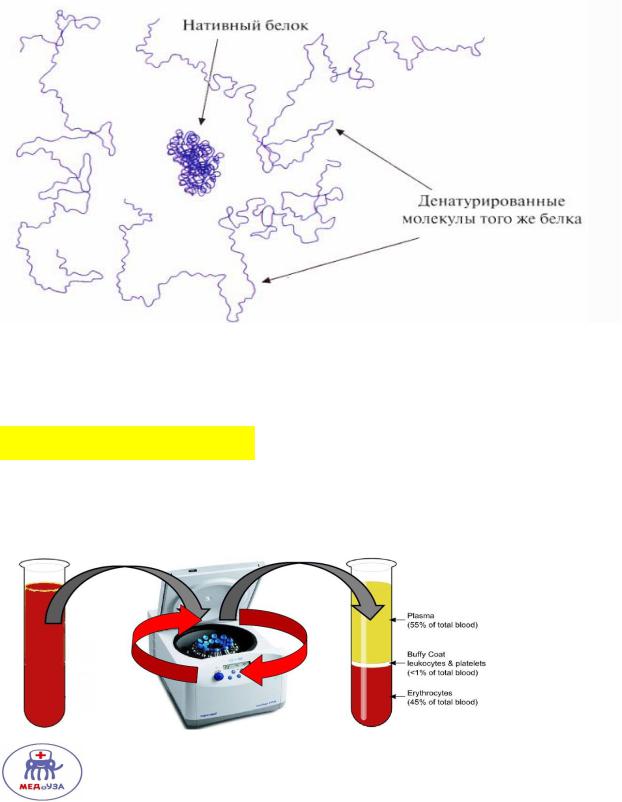
Денатурация белка.
Разрушение нативной конформации белка с потерей активного центра.
Методы разделения белков
Центрифугирование – метод основан на разделении веществ, имеющих различную плотность
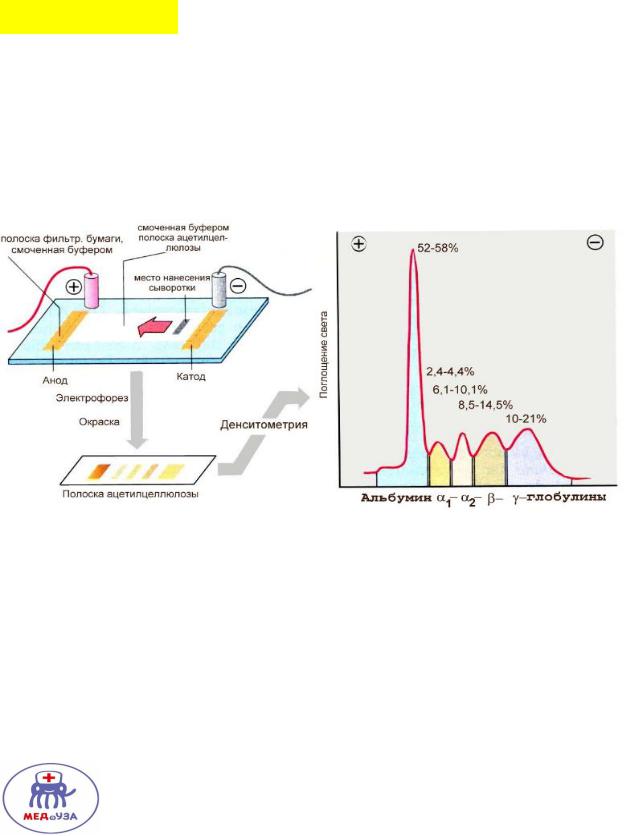
Электрофорез.
Движение заряженных частиц под действием электрического поля.
Зависит от массы молекулы и ее заряда (в условиях геля).
Альбумины имеет наибольшую массу и заряд(отрицательный) – поэтому ближе всех подходят к аноду.
Наименьшую массу и заряд имеют гамма глобулины, которые располагаются дальше всех от анода.
