
- •Контрольные вопросы
- •Лабораторная работа № 2 Определение жесткости воды методом комплексонометрического титрования
- •Оборудование и реактивы
- •Ход работы
- •Контрольные вопросы
- •Лабораторная работа № 3 Определение содержания Fe (II) в анализируемом растворе методом прямого окислительно-восстановительного титрования
- •Оборудование и реактивы
- •Ход работы
- •Контрольные вопросы
- •Оборудование и реактивы
- •Ход работы
- •Контрольные вопросы
- •Лабораторная работа № 5
- •4.1. Определение содержания хлорида калия в анализируемом растворе методом прямой кондуктометрии
- •Оборудование и реактивы
- •Ход работы
- •1. Построение калибровочного графика
- •2. Определение содержания хлорида калия по калибровочному графику
- •Контрольные вопросы
- •4.2. Стандартизация раствора хлорида бария по титрованному раствору сульфата натрия методом кондуктометрического титрования
- •Оборудование и реактивы
- •Ход работы
- •Оборудование и реактивы
- •Ход работы
- •1. В кислой среде
- •2. В щелочной среде
- •Контрольные вопросы
РОССИЙСКАЯ ФЕДЕРАЦИЯ МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ ФГАОУ ВО «ТЮМЕНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ» ИНСТИТУТ ХИМИИ КАФЕДРА ОРГАНИЧЕСКОЙ И ЭКОЛОГИЧЕСКОЙ ХИМИИ
АНАЛИТИЧЕСКАЯ ХИМИЯ
Методические указания к лабораторным работам для студентов I курса Института биологии направлений подготовки «06.03.01 Биология», «06.05.01 Биоинженерия и биоинформатика»
Тюмень, 2018 |
Лабораторная работа № 1
Определение содержания соляной кислоты в анализируемом растворе
методом прямого титрования
Данное определение относится к случаю титрования сильной кислоты сильным основанием. Благодаря наличию большого скачка рН на кривой титрования и тому, что точка эквивалентности соответствует значению рН=7, сильные кислоты можно титровать сильными основаниями с большим числом индикаторов (значение рТ которых лежат как при рН<7, так и при рН>7).
Оборудование и реактивы
Бюретка вместимостью 25,00 см3, конические колбы для титрования вместимостью 250 см3, пипетка Мора вместимостью 10,00 см3, мерная колба вместимостью 100,0 см3, стакан вместимостью 100-150 см3, воронка, капельница, промывалка, раствор гидроксида натрия с точно известной концентрацией, анализируемый раствор соляной кислоты, раствор метилового оранжевого.
Ход работы
Несколько миллилитров раствора соляной кислоты с неизвестной концентрацией, помещают в мерную колбу на 100,0 см3. Содержимое колбы доводят до метки дистиллированной водой, тщательно перемешивают. В бюретке должен находиться титрованный раствор гидроксида натрия. Сполоснув пипетку раствором соляной кислоты, отбирают 10,00 см3 этого раствора и переносят в колбу для титрования, добавляют 1-2 капли раствора метилового оранжевого и титруют раствором гидроксида натрия до изменения окраски индикатора из розовой в желтую. Титрование проводят не менее 3–х раз, до получения сходящихся результатов.
Результаты титрования заносят в таблицу.
V(HCl), см3 |
V(NaOH), см3 |
10,00 |
… |
10,00 |
… |
10,00 |
… |
Титрант – раствор гидроксида натрия (указывают точную молярную концентрацию эквивалента), определяемое вещество – соляная кислота, индикатор – метиловый оранжевый.
По результатам титрования рассчитывают массу соляной кислоты, содержащуюся в анализируемом растворе по формуле:
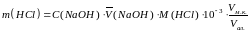 ,
,
где
m(НСl)
– масса соляной кислоты, г; С(NaOH)
– молярная концентрация эквивалента
раствора гидроксида натрия, моль/дм3
эквивалента;
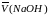 – средний объем раствора гидроксида
натрия, см3;
M(HCl)
– молярная масса эквивалента соляной
кислоты (36,46 г/моль эквивалента);
– средний объем раствора гидроксида
натрия, см3;
M(HCl)
– молярная масса эквивалента соляной
кислоты (36,46 г/моль эквивалента);
 – объем мерной колбы, см3;
– объем мерной колбы, см3;
 – объем аликвотной части раствора
соляной кислоты, см3;
10-3
– коэффициент пересчета.
– объем аликвотной части раствора
соляной кислоты, см3;
10-3
– коэффициент пересчета.
Контрольные вопросы
1. Сущность метода нейтрализации. Вид кривых титрования в методе нейтрализации. Понятия «конечная точка титрования» (КТТ), «точка эквивалентности» (ТЭ), «показатель титрования» (рТ), «интервал перехода окраски индикатора».
2. Рабочие растворы, определяемые вещества и установочные вещества, требования к ним. Понятия «молярная концентрация эквивалента» (нормальность), «молярная концентрация» (молярность), титр, массовая доля.
3. Сущность методов титрования (прямое, обратное, заместителя). Расчеты, применяемые в данных методах.
4. Понятия «эквивалент вещества». Способы определения эквивалентов в реакциях кислотно-основного титрования.
Лабораторная работа № 2 Определение жесткости воды методом комплексонометрического титрования
Метод комплексонометрии основан на реакциях взаимодействия комплексонов (чаще всего трилона Б) с катионами щелочноземельных и тяжелых металлов, которые приводят к образованию растворимых в воде бесцветных прочных внутрикомплексных соединений. Трилон Б – органическое соединение, натриевая соль этилендиаминтетрауксусной кислоты (ЭДТА) образует внутрикомплексные соединения с катионами металлов за счет валентных связей с карбоксильными группами, вытесняя из них атомы водорода, а также за счет координационных связей ионов-комплексообразователей с атомами азота.
Наиболее ценным свойством ЭДТА как титранта является его способность реагировать с ионами металлов в соотношении 1:1 независимо от заряда катиона.
Эти реакции могут быть записаны в виде:
Ме2+ + H2Y2- ↔ MeY2- + 2Н+;
МеЗ+ + H2Y2- ↔ MeY2- + 2Н+;
Ме4+ + H2Y2- ↔ MeY2- + 2Н+;
где H2Y2- - анион двузамещенной соли ЭДТА. Поэтому фактор эквивалента данного комплексона равен 1.
Титрование ведут при определенном значении рН стандартным (рабочим) раствором ЭДТА. Конечную точку титрования определяют с помощью индикаторов: мурексида, кислотного хрома черного, эриохрома черного Т и др. Эти индикаторы представляют собой органические красители, образующие с катионами окрашенные комплексные соединения (металл-индикаторы).
Комплексонометрический метод используется для определения жесткости воды. Жесткая вода обладает рядом отрицательных свойств: дает осадки в виде накипи в котлах, снижает моющую способность мыл, ухудшает развариваемость отдельных продуктов и т.п. Жесткость воды определяют по содержанию в ней солей кальция и магия и выражают в градусах жесткости (мг-экв/дм3). По величине жёсткости различают воду мягкую (до 2 °Ж), средней жёсткости (2-10 °Ж) и жёсткую (более 10 °Ж). Метод комплексонометрии обладает высокой чувствительностью, требует небольших затрат времени и дает хорошие результаты.
Оборудование и реактивы
Бюретка вместимостью 25,00 см3, конические колбы для титрования вместимостью 250 см3, пипетка Мора вместимостью 100,00 см3, воронка, капельница, промывалка, шпатель, анализируемая вода централизованного или нецентрализованного хозяйственно-питьевого водоснабжения (вода из крана, колодца, скважины), раствор трилона Б с точной концентрацией, аммиачный буферный раствор с pH 9,3 – 9,5, 5%-ный раствор сульфида натрия, 1%-ный раствор гидроксиламина солянокислого, индикатор эриохром черный Т.
