
- •7 Теория кислот и оснований Аррениуса. Протолитическая терия кислот и оснований Бренстеда-лоури. Кислоты и основания Льюлиса.
- •8. Ионное произведение воды и водородный показатель.
- •9 Буферные растворы. Механизм действия буферных растворов . Назначение и применение.
- •10.Произведение растворимости. Вывод формул
- •11. Влияние одноимённых и других ионов на растворимость электролитов, солевой эффект .
- •12.Гидролиз солей (три типа). Механизм гидролитического ращепления. Константа и степень гидролиза. Роль процесса гидролиза в химическом анализе.
Качественный анализ, его методы и задачи. Качественные реакции. Систематический и дробный ход анализа. Системы качественного анализа.
Аналитическая химия-это наука, которая разрабатывает теоретические основы и методы химического анализа.
Задачи качественного анализа- Обнаружение или, как иногда говорят, «открытие» отдельных элементов или ионов, входящих в состав веществ
Методы: Физические, физико-химические, химические
--Физические, физико-химические- измерения параметра системы, которая является функцией состава.
--Физико-химический- характерные свойства атомов или ионов
--химический метод-превращение анализируемого вещ. в новое соединение обладающее определёнными свойствами
Методы по способу выполнения: мокрый, сухой
Методы по количеству вещ.: Макроанализ(1-10), Полумикро(0,05-0,5), Микро (0,001-10(-6)), Ультромикро 10(-6)-10(-9), Субмикро 10(-9)-10(-12)
Качественный анализ — совокупность химических, физико-химических и физических методов, применяемых для обнаружения элементов, радикалов и соединений,
Дробным анализом называют обнаружение ионов с помощью специфических реакций в отдельных порциях анализируемого раствора, производимое в любой последовательности.-
Сисmемаmическим ходом анализа – называется определенная последовательность выполнения аналитических реакций, при которой каждый ион обнаруживают после того, как будут обнаружены и удалены другие ионы, мешающие его обнаружению.
Системы качественного анализа:
Сульфидная система анализа катионов- В основе классической сульфидной системы качественного анализа лежит растворимость сульфидов, хлоридов и карбонатов. На основании различной их растворимости катионы элементов делятся на пять аналитических групп.
(1)Группа: К первой аналитической группе относятся катионы щелочных металлов: К+, Na+, а также катионы NH4+ и Mg2+. Она не имеет общего (группового) реагента.
(2)группа: включает катионы щелочноземельных металлов: Ва2+, Sr2+, Са2+. Они осаждаются общим групповым реагентом — карбонатом аммония (NН4)2СО3
(3)группа: относятся катионы А13+, Cr3+, Fe3+, Fe2+, Ni2+, Со2+, Mn2+, Zn2+ и др. Они осаждаются из нейтральных или щелочных растворов (рН = 7-9) общим групповым реагентом - сульфидом аммония (NH4)2S
(4)группа: относятся ионы Сu2+, Cd2+, Hg2+, Bi3+, As3+, As5+, Sb5+, Sb3+, Sn2+, Sn4+ и др. Все катионы четвертой группы осаждаются сероводородом в кислой среде при рН 0,5 в виде сульфидов. Сульфиды их практически нерастворимы в воде и в разбавленных минеральных кислотах. Общий групповой реагент- сероводород H2S в присутствии соляной кислоты.
(5)группа: катионов относятся ионы Ag+, [Hg2]2+, Pb2+ и др. Хлориды их нерастворимы в воде и в разбавленных кислотах. Групповой реагент - 2 н. раствор соляной кислоты.
Аммиачно-фосфатная система В этой системе все катионы делят на пять аналитических групп.
относятся катионы Na+, К+ и NH4+, не имеющие группового реагента.
относятся катионы Ва2+, Sr2+, Ca2+, Mg2+, Fe2+, Fe3+, Mn2+, Al3+, Cr3+, и Bi3+, осаждаемые в виде фосфатов групповым реактивом - гидрофосфатом аммония (NH4)2HPO4
относятся катионы Сu2+, Hg2+, Cd2+, Co2+, Ni2+ и Zn2+, фосфаты которых растворимы в растворе аммиака с образованием аммиакатов типа [Me (NH3)nI2+.
относятся катионы Sn2+, Sn4+, Sb3+, Sb5+, As3+, As5+. Ионы олова и сурьмы при нагревании с азотной кислотой
относятся катионы Ag+, [Hg2]2+ и Pb2+, осаждаемые соляной кислотой в виде малорастворимых хлоридов.
Кислотно-щелочная система-катионы металов на основании их тношения к солянной и серной кислоте, к растворая едких щелочей и аммиака. На шесть групп.
K,Na,NH4- не имеет
Ag,Pb,Hg,- HCL
Ba,Sr,Ca-H2SO4
Al,Cr,Zn,Sn,As,- изб NaOH,KOH
Mg,Mn,Fe,Bi, Sb- NH4OH
Cu,Hg,Cd,Co,Ni-NH4OH
Аналитическая классификация катионов в кислотно- щелочной системе. Аналитическая группа, Групповой реагент.
Кислотно-щелочная система-катионы металов на основании их тношения к солянной и серной кислоте, к растворая едких щелочей и аммиака. На шесть групп.
K,Na,NH4- не имеет
Ag,Pb,Hg,- HCL
Ba,Sr,Ca-H2SO4
Al,Cr,Zn,Sn,As,- изб NaOH,KOH
Mg,Mn,Fe,Bi, Sb- NH4OH
Cu,Hg,Cd,Co,Ni-NH4OH
1 группа - катионы, не имеющие группового реактива (К+ , Na+ , NH+ 4), - характеризуются тем, что с минеральными кислотами и щело- чами они осадка не образуют, их хлориды и сернокислые соли, а также гидроксиды растворимы в воде.4
II группа - катионы группы соляной кислоты (Ag+ , Рb 2+, Hg2+ 2) - характеризуются тем, что с разбавленной соляной кислотой катионы образуют осадки хлоридов.
III группа - катионы группы серной кислоты (Ва2+, Sr2+, Са2+). С разбавленной серной кислотой они образуют осадки сульфатов.
IV группа - катионы амфотерных оксидов (Аl 3+, Сг3+ , Zn2+, Sn 2+ , As 3+ , As5+), которые характеризуются тем, что с избытком едкой щело- чи образуют растворимые щелочные солю NaAIО2 , NaCrО2 , Nа2SnО2, Nа3АsОз , Na3AsО4. Если же вместе с избытком щелочи действовать окислителем, например, Н2О2, то катионы данной группы образуют растворимые соли такого состава: NaAIО2, Na2CrО4, Nа2ZnО2, NазАsО4, Nа2SnО3
V группа - катионы типичных гидроксидов (Fе 2+ , Fе 3+, Mg2+ , Мn 2+, Вi 3+, Sb3+), которые характеризуются нерастворимостью их гид- роксидов ни в сильных, ни в слабых щелочах. Деление катионов на аналитические группы по кислотно-щелочной классификации
VI группа – катионы-комплексообразователи аммиакатов (Сu 2+, Hg2+, Сd 2+ , Со2+ , Ni2+). Для них характерна растворимость их гидроксидов в растворе аммиака с образованием комплексных солей – аммиакатов.
Классификация анионов в кислотно щелочной системе . Групповой реагент.
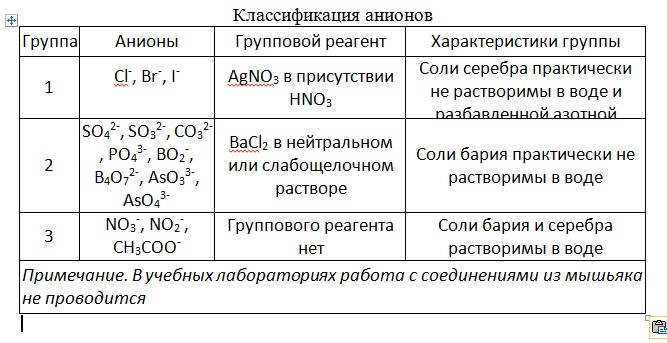
Закон действия масс. Вывод формул константы хим. равновесия
Зако́н де́йствующих масс устанавливает соотношение между массами реагирующих веществ в химических реакциях при равновесии, а также зависимость скорости химической реакции от концентрации исходных веществ. Закон действующих масс открыли в 1864 году норвежские ученые К.Гульдберг (1836-1902) и П.Вааге (1833-1900).
Вся теория качественного анализа есть последовательное применения закона действующих масс к различным видам равновесных химических процессов
Химическая реакция имеет скорость и зависит от: концентрации, природы вещ., Температуры, катализатора.
mA + nB = C + D
V = k [A] [B]
V = альфа a [A] b[B] = k [A] [B]
k- называемый константой скорости.=Альфа(Число столкновений завершился реакцией. Зависит от энергии активации+ природы вещ. )+коэффициенты пропорциональности a,b
Моль есть количество вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде-12 массой 0,012 кг.
Конста́нта равнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями исходных веществ и продуктов в состоянии химического равновесия. Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции.
Константа скорости-скорость реакции, при которой концентрация каждого реагирующего вещества равно 1 моль
k1 [A] [B]= = k2 [С] [D]
 Больше 1- прямая реакция. Меньше 1-
обратная реакция.
Больше 1- прямая реакция. Меньше 1-
обратная реакция.
Основные положения теории электролитической диссоциации С. Аррениус и гидратной теории И.А Кабукова.
Электролиты – вещества, водные растворы и расплавы которых проводят электрический ток.
Вещества, растворы которых являются электролитами, при растворении распадаются на частицы (ионы), несущие положительные и отрицательные заряды.
электролитической диссоциацией – навается Процесс распада электролита на ионы
Катион. Анион. Под действием электрического тока + к -,- к+
не ответила на вопрос: почему одни вещества являются электролитами, а другие – нет, а также какую роль в образовании ионов играет растворитель.
Степень электролитической диссоциации (a) зависит от природы электролита и растворителя, температуры и концентрации. Она показывает отношение числа молекул, распавшихся на ионы (n) к общему числу молекул, введенных в раствор (N).
Теорию
процесса диссоциации разработал И.А.
Каблуков (1891).
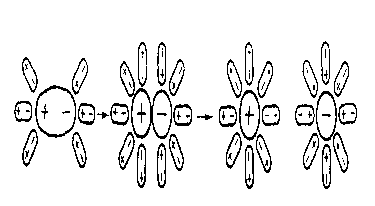
Явление взаимодействия ионов с молекулами воды, в результате чего происходит образование гидратной оболочки, называется гидратацией ионов.
Диссоциация- когда ионы содержащиеся в составе решётке переходят в раствор. Не обратим.
Ионизация-процесс растворения вещества не имеющих свободных ионов.
6 Слабые и сильные электролиты. Степень электролитической диссоциации. Константа электролитической диссоциации. Уравнения связывающее константу со степенью.
Константа ионизации- отношение произведения концентрации ионов к конц не ионизированных молекул. К
Степень ионизации- отношение числа ионизированных молекул к общему числу раст молекул. Альфа.
Сильные- те которые диссоциируют практически полностью .Большая часть солей имеющих кристаллическую решётку, растворы щелочей и сильных кислот
Слабые-если значение степени диссоциации близко к нулю. Слабые кислоты, слабые осн,
Характеризуют один процесс, поэтому одну величину можно выразить через другую.
 =К=
=К=
 концентрация умн степень = конц каждого
иона.
концентрация умн степень = конц каждого
иона.
Если электролит слабый то (1-а)= 0
7 Теория кислот и оснований Аррениуса. Протолитическая терия кислот и оснований Бренстеда-лоури. Кислоты и основания Льюлиса.
Согласно теории Аррениуса: кислотой при диссоциации которого образуются катионы водорода основанием диссоциации которого образуется гидроксид-ион. Амфолитом (амфотерным гидроксидом), диссоциирующий в растворе с образованием как катионов водорода, так и гидроксид – ионов.
Протонная теория кислот и оснований Бренстеда-Лоури
Кислотой называют любое вещество, молекулярные частицы которого (в том числе ионы) способны отдавать протон, т.е. быть донором протонов;
Типы:
1)Нейтральные- HCl, H2SO4, H3PO4
2)Катионные- р NH4+ , Н3О+
3)Анионные- HSO4-, H2PO4-, HPO42
основанием называют вещество, молекулярные частицы которого (в том числе и ионы) способны присоединять протоны, т.е. быть акцептором протонов
Типы:
Нейтральные- NH3,Н2О, С2Н5ОН
Катионные- Н2N−NH3+.
Анионные - Cl-, СН3СОО-, ОН-:
Теория Льюиса (электронная теория).
кислотойназывают вещество, принимающее неподеленную электронную пару, - акцептор электронов. трихлорида брома и оксида серы (VI), галогениды бора, АL.
основанием называют вещество, поставляющее электроны для образования химической связи, - донор электронов. молекулы аммиака и воды. ионы, аммиак, алифатические и ароматические амины, кислородсодержащие соединения общей формулы R2CO (где R- органический радикал).
8. Ионное произведение воды и водородный показатель.

Вода это слабый электролит
Концентрацию молекул воды [H2O], то есть число моль в 1 л воды можно считать постоянной и равной [H2O] = 1000 г/л : 18 г/моль = 55,5 моль/л. Получаем
К´[H2O] = К(H2O) = [H+]×[OH-] = 10-14 (22°С)
Произведение концентраций [H+] и [OH-], то есть ионное произведение воды, есть величина постоянная и равная 10-14 при 22°С: [H+]×[OH-] = 10-14
[H+] =10-7= [OH-] - нейтральная среда
[H+] >10-7> [OH-] - кислая среда
[H+] <10-7< [OH-] - щелочная среда.
Водородный показатель рН - это отрицательный десятичный логарифм концентрации ионов водорода рН = - lg[H+]. это мера активности ионов водорода в растворе, количественно выражающая его кислотность,
9 Буферные растворы. Механизм действия буферных растворов . Назначение и применение.
Буферным раствором называют раствор способный поддерживать постоянное значение Ph.
Типы:
а) Кислотные
б) Основные
в) Белковые
Растворы применимые в Анализе: Формиатный раствор 3,8( смесь муравьиной кислоты и её соли натрия), Ацетатный раствор4,7 (смесь уксусной кислоты и её соли), Аммиачный раствор 9,25 (аммиак и хлорид аммония)
Механизм. Одна составная часть раствора способна взаимодействовать с н+ кислот , а другая с ОН- основания. То есть связывать эти ионы.+
10.Произведение растворимости. Вывод формул
Протекание взаимно противоположных процессов приводит к состоянию динамического равновесия ,где скорость осаждения ионов становится равной скорости растворения.

Константа ПР характеризует способность электролита растворятся и ровняется произведению активностей ионов в растворе.
11. Влияние одноимённых и других ионов на растворимость электролитов, солевой эффект .
При установлении динамического равновесия скорость осаждения равна скорости растворения. Получается насыщенный раствор, где произведение концентрации ионов равно произведению растворимости.
Если к насыщенному раствору электролита прилить раствор другого электролита имующий общий или одноимённый ион, то произведение концентрации ионов превысит произведение растворимости, раствор станет перенасыщенным, а перенасыщенный раствор выделяет част электролита в виде осадка. Пример CaSО4 + H2SO4 в осадок выпадет соль кальция.
Солевым эффектом называется повышение растворимости малорастворимых электролитов в системе осадок-раствор при добавления другого сильного электролита.
Солевой эффект обусловлен уменьшением коэффициентом активности в следствии повышением ионной силы раствора при проливании иного электролита .
