
Ответы на ПЗ / Реакции
.docxМолекулярно-биологические методы, используемые в диагностике инфекционных болезней (ПЦР, рестрикционный анализ и др.). |
||
Полимеразная цепная реакция |
Для проведения этой реакции из исследуемого материала выделяют ДНК, в которой определяют наличие специфичного для данного микроба гена. Обнаружение гена осуществляют его накоплением. Для этого необходимо иметь праймеры комплементарного З'-концам ДНК. исходного гена. Накопление (амплификация) гена выполняется следующим образом. Выделенную из исследуемого материала ДНК нагревают. При этом ДНК распадается на 2 нити. Добавляют праймеры. Смесь ДНК и праймеров охлаждают. При этом праймеры, при наличии в смеси ДНК искомого гена, связываются с его комплементарными участками. Затем к смеси ДНК и праймера добавляют ДНК-полимеразу и нуклеотиды. Устанавливают температуру, оптимальную для функционирования ДНК-полимеразы. В этих условиях, в случае комплементарное™ ДНК гена и праймера, происходит присоединение нуклеотидов к З'-концам праймеров, в результате чего синтезируются две копии гена. После этого цикл повторяется снова, при этом количество ДНК гена будет увеличиваться каждый раз вдвое. Проводят реакцию в специальных приборах — амплификаторах. ПЦР применяется для диагностики вирусных и бактериальных инфекций.
|
позволяет обнаружить микроб в исcледуемом материале (воде, продуктах, материале от больного) по наличию в нем ДНК микроба без выделения последнего в чистую культуру.
|
Рестрикционный анализ. |
Данный метод основан на применении ферментов, носящих название рестриктаз. Рестриктазы представляют собой эндонук-леазы, которые расщепляют молекулы ДНК, разрывая фосфатные связи не в произвольных местах, а в определенных последовательностях нуклеотидов. Особое значение для методов молекулярной генетики имеют рестриктазы, которые узнают последовательности, обладающие центральной симметрией и считывающиеся одинаково в обе стороны от оси симметрии. Точка разрыва ДНК может или совпадать с осью симметрии, или быть сдвинута относительно нее. В настоящее время из различных бактерий выделено и очищено более 175 различных рестриктаз, для которых известны сайты (участки) узнавания (рестрикции). Выявлено более 80 различных типов сайтов, в которых может происходить разрыв двойной спирали ДНК. В геноме конкретной таксономической единицы находится строго определенное (генетически задетерминированное) число участков узнавания для определенной рестриктазы. Если выделенную из конкретного микроба ДНК обработать определенной рестриктазой, то это приведет к образованию строго определенного количества фрагментов ДНК фиксированного размера. Размер каждого типа фрагментов можно узнать с помощью электрофореза в агарозном геле: мелкие фрагменты перемещаются в геле быстрее, чем более крупные фрагменты, и длина их пробега больше. Гель окрашивают бромистым этидием и фотографируют в УФ-излучении. Таким образом можно получить рестрикционную карту определенного вида микробов. Сопоставляя карты рестрикции ДНК, выделенных из различных штаммов, можно определить их генетическое родство, выявить принадлежность к определенному виду или роду, а также обнаружить участки, подвергнутые мутациям. Этот метод используется также как начальный этап метода определения последовательности нуклеотидных пар (секвенирования) и метода молекулярной гибридизации.
|
|
Метод молекулярной гибридизации |
Метод основан на способности двухцепочечной ДНК при повышенной температуре (90 °С) в щелочной среде денатурировать, т. е. расплетаться на две нити, а при понижении температуры на 10 °С вновь восстанавливать исходную двухцепочечную структуру. Метод требует наличия молекулярного зонда. Зондом называется одноцепочечная молекула нуклеиновой кислоты, меченная радиоактивными нуклидами, с которой сравнивают исследуемую ДНК. Для проведения молекулярной гибридизации исследуемую ДНК расплетают указанным выше способом, одну нить фиксируют на специальном фильтре, который затем помещают в раствор, содержащий радиоактивный зонд. Создаются условия, благоприятные для образования двойных спиралей. В случае наличия комплементарности между зондом и исследуемой ДНК, они образуют между собой двойную спираль.
|
позволяет выявить степень сходства различных ДНК. Применяется при идентификации микробов для определения их точного таксономического положения.
|
Риботипирование и опосредованная транскрипцией амплификация рибосомальной РНК. |
Последовательность нуклеотидных оснований в оперонах, кодирующих рРНК, отличается консервативностью, присущей каждому виду бактерий. Эти опероны представлены на бактериальной хромосоме в нескольких копиях. Фрагменты ДНК, полученные после обработки ее рестриктазами, содержат последовательности генов рРНК, которые могут быть обнаружены методом молекулярной гибридизации с меченой рРНК соответствующего виды бактерий. Количество и локализация копий оперонов рРНК и рестрикционный состав сайтов как внутри рРНК-оперона, так и по его флангам варьируют у различных вида бактерий. На основе этого свойства построен метод риботипирования, который позволяет производить мониторинг выделенных штаммов и определение их вида. В настоящее время риботипирование проводится в автоматическом режиме в специальных приборах.
|
|
Опосредованная транскрипцией амплификация рРНК |
1. Амплификация пула рРНК на матрице выделенной из исследуемого материала ДНК при помощи ДНК-зависимой РНК-полимеразы. 2. Гибридизация накопленного пула рРНК с комплементарными видоспецифическим рРНК олигонуклеотидами, меченными флюорохромом или ферментами. 3. Определение продуктов гибридизации методами денситометрии, иммунофермент-ного анализа (ИФА). Реакция проводится в автоматическом режиме в установках, в которых одномоментное определение рРНК, принадлежащих различным видам бактерий, достигается разделением амплифицированного пула рРНК на несколько проб, в которые вносятся комплементарные видоспецифическим рРНК меченые олигонуклеотиды для гибридизации. |
используется для диагностики смешанных инфекций. Этот метод основан на обнаружении с помощью молекулярной гибридизации амплифицированных рРНК, специфичных для определенного вида бактерий. Исследование проводится в три этапа:
|
|
Реакция агглютинации. |
|
|
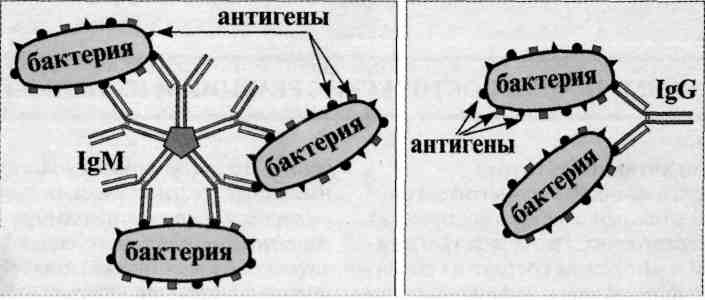
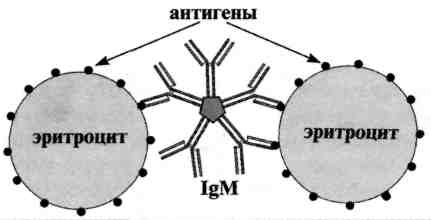
Реакция агглютинации — простая по постановке реакция, при которой происходит связывание антителами корпускулярных антигенов (бактерий, эритроцитов или других клеток, нерастворимых частиц с адсорбированными на них антигенами, а также макромолекулярных агрегатов). Она протекает при наличии электролитов, например при добавлении изотонического раствора натрия хлорида. Применяются различные варианты реакции агглютинации: развернутая, ориентировочная, непрямая и др. Реакция агглютинации проявляется образованием хлопьев или осадка (клетки, «склеенные» антителами, име ющими два или более антигенсвязывающих центра — рис. 13.1). РА используют для: 1) определения антител в сыворотке крови больных, например, при бруцеллезе (реакции Райта, Хеддельсона), брюшном тифе и паратифах (реакция Видаля) и других инфекционных болезнях; 2) определения возбудителя, выделенного от больного; 3) определения групп крови с использованием моноклональных антител против алло-антигенов эритроцитов. Для определения у больного антител ставят развернутую реакцию агглютинации: к разведениям сыворотки крови больного добавляют диагностикум (взвесь убитых микробов,) и через несколько часов инкубации при 37 ˚С отмечают наибольшее разведение сыворотки (титр сыворотки), при котором произошла агглютинация, т. е. образовался осадок. Характер и скорость агглютинации зависят от вида антигена и антител. Примером являются особенности взаимодействия диагностикумов (О- и H-антигенов) со специфическими антителами. Реакция агглютинации с О-диагностикумом (бактерии, убитые нагреванием, сохранившие термостабильный О-антиген) происходит в виде мелкозернистой агглютинации. Реакция агглютинации с Н-диагностикумом (бактерии, убитые формалином, сохранившие термолабильный жгутиковый Н-антиген) — крупнохлопчатая и протекает быстрее. Если необходимо определить возбудитель, выделенный от больного, ставят ориентировочную реакцию агглютинации, применяя диагностические антитела (агглютинирующую сыворотку), т. е. проводят серотипирование возбудителя. Ориентировочную реакцию проводят на предметном стекле. К капле диагностической агглютинирующей сыворотки в разведении 1:10 или 1:20 добавляют чистую культуру возбудителя, выделенного от больного. Рядом ставят контроль: вместо сыворотки наносят каплю раствора натрия хлорида. При появлении в капле с сывороткой и микробами хлопьевидного осадка ставят развернутую реакцию агглютинации в пробирках с увеличивающимися разведениями агглютинирующей сыворотки, к которым добавляют по 2—3 капли взвеси возбудителя. Агглютинацию учитывают по количеству осадка и степени просветления жидкости. Реакцию считают положительной, если агглютинация отмечается в разведении, близком к титру диагностической сыворотки. Одновременно учитывают контроли: сыворотка, разведенная изотоническим раствором натрия хлорида, должна быть прозрачной, взвесь микробов в том же растворе — равномерно мутной, без осадка. Разные родственные бактерии могут агглютинироваться одной и той же диагностической агглютинирующей сывороткой, что затрудняет их идентификацию. Поэтому пользуются адсорбированными агглютинирующими сыворотками, из которых удалены перекрестно реагирующие антитела путем адсорбции их родственными бактериями. В таких сыворотках сохраняются антитела, специфичные только к данной бактерии.
|
РА используют для: 1) определения антител в сыворотке крови больных, например, при бруцеллезе (реакции Райта, Хеддельсона), брюшном тифе и паратифах (реакция Видаля) и других инфекционных болезнях; 2) определения возбудителя, выделенного от больного; 3) определения групп крови с использованием моноклональных антител против алло-антигенов эритроцитов.
|
Реакция Кумбса |
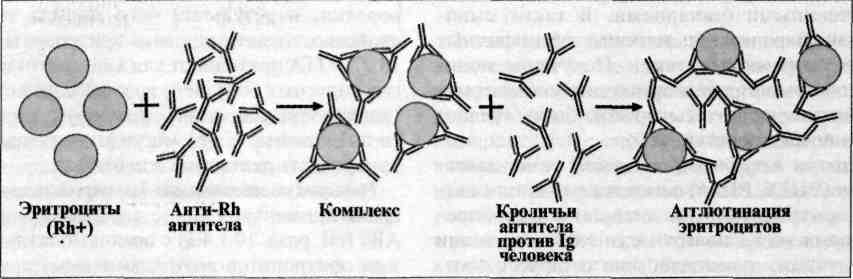
Механизм. Сложность выявления неполных (моновалентных) антител связана с тем, что эти антитела, связываясь с эпитопами специфического антигена, не образуют структуру решетки и реакция между антигенами и антителами не выявляется ни агглютинацией, ни преципитацией, ни другими тестами. Для выявления образовавшихся комплексов антиген — антитело приходится использовать дополнительные тест-системы. Для выявления неполных антител, например к резус-антигену эритроцитов в сыворотке крови беременной женщины, реакция ставится в два этапа: 1) к двукратным разведениям испытуемой сыворотки добавляют эритроциты, содержащие резус-антиген, и выдерживают при 37 °С в течение часа; 2) к тщательно отмытым после первого этапа эритроцитам добавляют кроличью античеловеческую анти-глобулиновую сыворотку (в заранее оттитрованном рабочем разведении). После инкубации в течение 30 мин при 37 °С результаты оценивают по наличию гемагглютинации (положительная реакция). Необходимо ставить контроль ингредиентов реакции: 1) антиглобулиновая сыворотка + заведомо сенсибилизированные специфическими антителами эритроциты; 2) обработанные нормальной сывороткой эритроциты + антиглобулиновая сыворотка; 3) обработанные исследуемой сывороткой резус-отрицательные эритроциты + антиглобулиновая сыворотка.
|
Реакцию агглютинации для определения антирезусных антител (непрямую реакцию Кумбса) применяют у больных при внутрисосудистом гемолизе. У некоторых таких больных обнаруживают антирезусные антитела, которые являются неполными, одновалентными. Они специфически взаимодействуют с резус-положительными эритроцитами, но не вызывают их агглютинации. Наличие таких неполных антител определяют в непрямой реакции Кумбса. Для этого в систему антирезусные антитела + резус-положительные эритроциты добавляют антиглобулиновую сыворотку (антитела против иммуноглобулинов человека), что вызывает агглютинацию эритроцитов. С помощью реакции Кумбса диагностируют патологические состояния, связанные с внутрисосудистым лизисом эритроцитов иммунного генеза, например гемолитическую болезнь новорожденных: эритроциты резус-положительного плода соединяются с циркулирующими в крови неполными антителами к резус-фактору, которые перешли через плаценту от резус-отрицательной матери.
|
|
Реакция непрямой (пассивной) гемагглютинации (РНГА, РПГА) основана на использовании эритроцитов (или латекса) с адсорбированными на их поверхности антигенами или антителами, взаимодействие которых с соответствующими антителами или антигенами сыворотки крови больных вызывает склеивание и выпадение эритроцитов на дно пробирки или ячейки в виде фестончатого осадка. Компоненты. Для постановки РНГА могут быть использованы эритроциты барана, лошади, кролика, курицы, мыши, человека и другие, которые заготавливают впрок, обрабатывая формалином или глютаральдегидом. Адсорбционная емкость эритроцитов увеличивается при обработке их растворами танина или хлорида хрома. Антигенами в РНГА могут служить полисахаридные АГ микроорганизмов, экстракты бактериальных вакцин, АГ вирусов и риккетсий, а также другие вещества. Эритроциты, сенсибилизированные АГ, называются эритроцитарными диагностикумами. Для приготовления эритроцитарного диагностикума чаще всего используют эритроциты барана, обладающие высокой адсорбирующей активностью. Применение. РНГА применяют для диагностики инфекционных болезней, определения гонадотропного гормона в моче при установлении беременности, для выявления повышенной чувствительности к лекарственным препаратам, гормонам и в некоторых других случаях. Механизм. Реакция непрямой гемагглютинации (РНГА) отличается значительно более высокой чувствительностью и специфичностью, чем реакция агглютинации. Ее используют для идентификации возбудителя по его антигенной структуре или для индикации и идентификации бактериальных продуктов — токсинов в исследуемом патологическом материале. Соответственно используют стандартные (коммерческие) эритроцитарные антительные диагностикумы, полученные путем адсорбции специфических антител на поверхности танизированных (обработанных танином) эритроцитов. В лунках пластмассовых пластин готовят последовательные разведения исследуемого материала. Затем в каждую лунку вносят одинаковый объем 3 % суспензии нагруженных антителами эритроцитов. При необходимости реакцию ставят параллельно в нескольких рядах лунок с эритроцитами, нагруженными антителами разной групповой специфичности. Через 2 ч инкубации при 37 °С учитывают результаты, оценивая внешний вид осадка эритроцитов (без встряхивания): при отрицательной реакции появляется осадок в виде компактного.диска или кольца на дне лунки, при положительной реакции — характерный кружевной осадок эритроцитов, тонкая пленка с неровными краями.
|
|
|
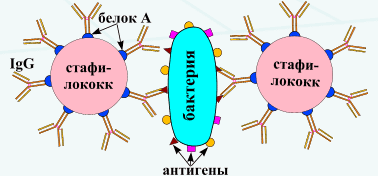
Реакцию коагглютинации применяют для определения антигенов с помощью антител, адсорбированных на белке А клеток стафилококка (антительный диагностикум). Белок А имеет сродство к Fc-фрагменту иммуноглобулинов, поэтому такие бактерии, обработанные иммунной диагностической сывороткой неспецифически адсорбируют антитела сыворотки, которые затем взаимодействуют активными центрами с соответствующими микробами, выделенными от больных. В результате коагглютинации образуются хлопья, состоящие из стафилококков, антител диагностической сыворотки и определяемого микроба. Механизм. Основан на том, что находящийся на поверхности золотистого стафилококка белок А селективно реагирует с Fc-фрагментом IgGl, G2, G4, оставляя свободными антидетерминанты Ат, которые, взаимодействуя с гомологичным Аг, вызывают агглютинацию стафилококков. Для постановки КОА применяют коммерческие стафилококковые реагенты, содержащиеся в ампулах или высушенные в лунках полистироловых пластин или предметных стекол. К реагенту добавляют 0,01-0,1 мл исследуемой культуры или растворимого Аг, инкубируют при комнатной температуре 10-30 мин (в условиях постановки реакции на стекле) или 18 -20 ч (в условиях постановки реакции в капиллярах). Учет проводят так же, как при обычной РА. Агглютинацию учитывают по количеству осадка и степени просветления жидкости. Реакцию считают положительной, если агглютинация отмечается в разведении, близком к титру диагностической сыворотки. Одновременно учитывают контроли: сыворотка, разведенная изотоническим раствором натрия хлорида, должна быть прозрачной, взвесь микробов в том же растворе — равномерно мутной, без осадка.
|
|
|
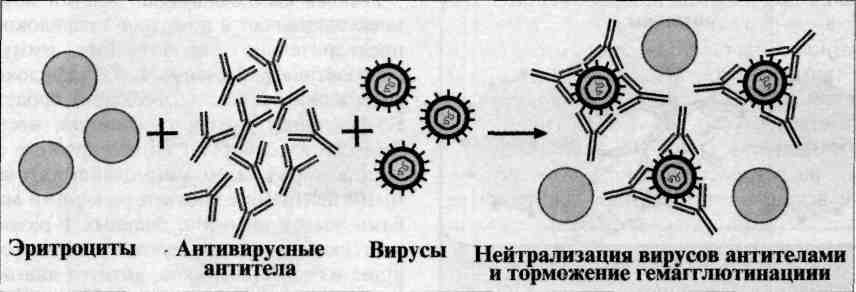
Реакция торможения гемагглютинации (РТГА) - метод идентификации вируса или выявления противовирусных антител в сыворотке крови больного, основанный на феномене отсутствия агглютинации эритроцитов препаратом, содержащим вирус, в присутствии иммунной к нему сыворотки крови. Реакция торможения гемагглютинации (РТГА) основана на блокаде, подавлении антигенов вирусов антителами иммунной сыворотки, в результате чего вирусы теряют свойство агглютинировать эритроциты. РТГА применяют для диагностики многих вирусных болезней, возбудители которых (вирусы гриппа, кори, краснухи, клещевого энцефалита и др.) могут агглютинировать эритроциты различных животных. Механизм. Типирование вируса проводят в реакции торможения гемаг-глютинации (РТГА) с набором типоспецифических сывороток. Результаты реакции учитывают по отсутствию гемагглютинации. Подтипы вируса А с антигенами H0N1, H1N1, Н2N2, H3N2 и др. могут быть дифференцированы в РТГА с набором гомологичных типоспецифических сывороток.
|
|
|
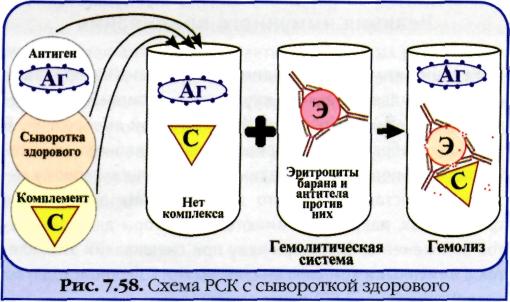
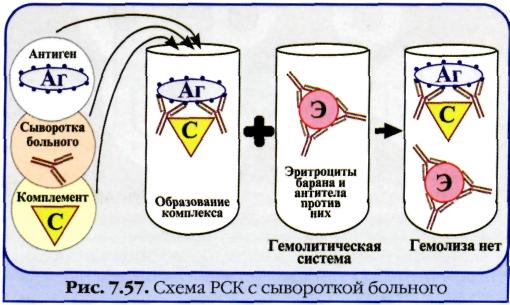
Реакция связывания комплемента (РСК) заключается в том, что при соответствии друг другу антигены и антитела образуют иммунный комплекс, к которому через Fc-фрагмент антител присоединяется комплемент (С), т. е. происходит связывание комплемента комплексом антиген—антитело. Если же комплекс антиген—антитело не образуется, то комплемент остается свободным. Специфическое взаимодействие АГ и AT сопровождается адсорбцией (связыванием) комплемента. Поскольку процесс связывания комплемента не проявляется визуально, Ж. Борде и О.Жангу предложили использовать в качестве индикатора гемолитическую систему (эритроциты барана + гемолитическая сыворотка), которая показывает, фиксирован ли комплемент комплексом АГ-АТ. Если АГ и AT соответствуют друг другу, т. е. образовался иммунный комплекс, то комплемент связывается этим комплексом и гемолиза не происходит. Если AT не соответствует АГ, то комплекс не образуется и комплемент, оставаясь свободным, соединяется со второй системой и вызывает гемолиз. Компоненты. Реакция связывания комплемента (РСК) относится к сложным серологическим реакциям. Для ее проведения необходимы 5 ингредиентов, а именно: АГ, AT и комплемент (первая система), эритроциты барана и гемолитическая сыворотка (вторая система). Антигеном для РСК могут быть культуры различных убитых микроорганизмов, их лизаты, компоненты бактерий, патологически измененных и нормальных органов, тканевых липидов, вирусы и вирусосодержащие материалы. В качестве комплемента используют свежую или сухую сыворотку морской свинки. Механизм. РСК проводят в две фазы: 1-я фаза — инкубация смеси, содержащей три компонента антиген + антитело + комплемент; 2-я фаза (индикаторная) — выявление в смеси свободного комплемента путем добавления к ней гемолитической системы, состоящей из эритроцитов барана, и гемолитической сыворотки, содержащей антитела к ним. В 1-й фазе реакции при образовании комплекса антиген—антитело происходит связывание им комплемента, и тогда во 2-й фазе гемолиз сенсибилизированных антителами эритроцитов не произойдет; реакция положительная. Если антиген и антитело не соответствуют друг другу (в исследуемом образце нет антигена или антитела), комплемент остается свободным и во 2-й фазе присоединится к комплексу эритроцит — ан-тиэритроцитарное антитело, вызывая гемолиз; реакция отрицательная. Применение. РСК применяют для диагностики многих инфекционных болезней, в частности сифилиса (реакция Вассермана).
|
|
|
№ 81 Реакция нейтрализации токсина антитоксином. Механизм. Способы постановки, применение.
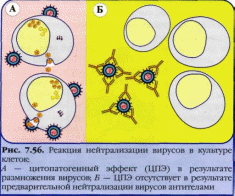
В основе этой реакции лежит способность специфической антитоксической сыворотки нейтрализовать экзотоксин. Антитела иммунной сыворотки способны нейтрализовать повреждающее действие микробов или их токсинов на чувствительные клетки и ткани, что связано с блокадой микробных антигенов антителами, т. е. их нейтрализацией. Реакцию нейтрализации (РН) проводят путем введения смеси антиген—антитело животным или в чувствительные тест-объекты (культуру клеток, эмбрионы). При отсутствии у животных и тест-объектов повреждающего действия микроорганизмов или их антигенов, токсинов говорят о нейтрализующем действии иммунной сыворотки и, следовательно, о специфичности взаимодействия комплекса антиген—антитело. Для проведения реакции исследуемый материал, в котором предполагается наличие экзотоксина, смешивают с антитоксической сывороткой, выдерживают в термостате и вводят животным (морским свинкам, мышам). Контрольным животным вводят фильтрат исследуемого материала, не обработанный сывороткой. В том случае, если произойдет нейтрализация экзотоксина антитоксической сывороткой, животные опытной группы останутся живыми. Контрольные животные погибнут в результате действия экзотоксина.
|
|
|
№ 79 Реакция преципитации. Механизм. Компоненты. Способы постановки. Применение.
Реакция преципитации (РП) - это формирование и осаждение комплекса растворимого молекулярного антигена с антителами в виде помутнения, называемого преципитатом. Он образуется при смешивании антигенов и антител в эквивалентных количествах; избыток одного из них снижает уровень образования иммунного комплекса. РП ставят в пробирках (реакция кольцепреципитации), в гелях, питательных средах и др. Широкое распространение получили разновидности РП в полужидком геле агара или агарозы: двойная иммунодиффузия по Оухтерлони, радиальная иммунодиффузия, иммуноэлектрофорез и др. Механизм. Проводится с прозрачными коллоидными растворимыми антигенами, экстрагированными из патологического материала, объектов внешней среды или чистых культур бактерий. В реакции используют прозрачные диагностические преципитирующие сыворотки с высокими титрами антител. За титр преципитирующей сыворотки принимают то наибольшее разведение антигена, которое при взаимодействии с иммунной сывороткой вызывает образование видимого преципитата — помутнение. Реакция кольцепреципитации ставится в узких пробирках (диаметр 0,5 см), в которые вносят по 0,2—0,3 мл преципити-рующей сыворотки. Затем пастеровской пипеткой медленно наслаивают 0,1—0,2 мл раствора антигена. Пробирки осторожно переводят в'вертикальное положение. Учет реакции производят через 1—2 мин. В случае положительной реакции на границе между сывороткой и исследуемым антигеном появляется преципитат в виде белого кольца. В контрольных пробирках преципитат не образуется.
|
|
|
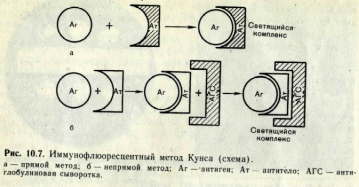
№ 82 Реакция иммунофлюоресценции. Механизм, компоненты, применение.
Иммунофлюоресцентный метод (РИФ, реакция иммунофлюоресценции, реакция Кунса) - метод выявления специфических Аг с помощью Ат, конъюгированных с флюорохромом. Обладает высокой чувствительностью и специфичностью. Применяется для экспресс-диагностики инфекционных заболеваний (идентификация возбудителя в исследуемом материале), а также для определения Ат и поверхностных рецепторов и маркеров лейкоцитов (иммунофенотипирование) и др. клеток. Обнаружение бактериальных и вирусных антигенов в инфекционных материалах, тканях животных и культурах клеток при помощи флюоресцирующих антител (сывороток) получило широкое применение в диагностической практике. Приготовление флюоресцирующих сывороток основано на способности некоторых флюорохромов (например, изотиоцианата флюоресцеина) вступать в химическую связь с сывороточными белками, не нарушая их иммунологической специфичности. Различают три разновидности метода: прямой, непрямой, с комплементом. Прямой метод РИФ основан на том, что антигены тканей или микробы, обработанные иммунными сыворотками с антителами, меченными флюорохромами, способны светиться в УФ-лучах люминесцентного микроскопа. Бактерии в мазке, обработанные такой люминесцирующей сывороткой, светятся по периферии клетки в виде каймы зеленого цвета. Непрямой метод РИФ заключается в выявлении комплекса антиген - антитело с помощью антиглобулиновой (против антитела) сыворотки, меченной флюорохромом. Для этого мазки из взвеси микробов обрабатывают антителами антимикробной кроличьей диагностической сыворотки. Затем антитела, не связавшиеся антигенами микробов, отмывают, а оставшиеся на микробах антитела выявляют, обрабатывая мазок антиглобулиновой (антикроличьей) сывороткой, меченной флюорохромами. В результате образуется комплекс микроб + антимикробные кроличьи антитела + антикроличьи антитела, меченные флюорохромом. Этот комплекс наблюдают в люминесцентном микроскопе, как и при прямом методе. Механизм. На предметном стекле готовят мазок из исследуемого материала, фиксируют на пламени и обрабатывают иммунной кроличьей сывороткой, содержащей антитела против антигенов возбудителя. Для образования комплекса антиген — антитело препарат помещают во влажную камеру и инкубируют при 37 °С в течение 15 мин, после чего тщательно промывают изотоническим раствором хлорида натрия для удаления не связавшихся с антигеном антител. Затем на препарат наносят флюоресцирующую антиглобулиновую сыворотку против глобулинов кролика, выдерживают в течение 15 мин при 37 °С, а затем препарат тщательно промывают изотоническим раствором хлорида натрия. В результате связывания флюоресцирующей антиглобулиновой сыворотки с фиксированными на антигене специфическими анти телами образуются светящиеся комплексы антиген — антитело, которые обнаруживаются при люминесцентной микроскопии.
|
|
|
№ 83 Иммуноферментный анализ, иммуноблоттинг. Механизм, компоненты, применение.
Иммуноферментный анализ или метод — выявление антигенов с помощью соответствующих им антител, конъюгированных с ферментом-меткой (пероксидазой хрена, бета-галактозидазой или щелочной фосфатазой). После соединения антигена с меченной ферментом иммунной сывороткой в смесь добавляют субстрат/хромоген. Субстрат расщепляется ферментом и изменяется цвет продукта реакции — интенсивность окраски прямо пропорциональна количеству связавшихся молекул антигена и антител. ИФА применяют для диагностики вирусных, бактериальных и паразитарных болезней, в частности для диагностики ВИЧ-инфекций, гепатита В и др., а также определения гормонов, ферментов, лекарственных препаратов и других биологически активных веществ, содержащихся в исследуемом материале в минорных концентрациях (1010-1012 г/л). Твердофазный ИФА — вариант теста, когда один из компонентов иммунной реакции (антиген или антитело) сорбирован на твердом носителе, напр., в лунках планшеток из полистирола. Компоненты выявляют добавлением меченых антител или антигенов. При положительном результате изменяется цвет хромогена. Каждый раз после добавления очередного компонента из лунок удаляют несвязавшиеся реагенты путем промывания,
I II. При определении антигена (правый рисунок) в лунки с сорбированными антителами вносят антиген (напр., сыворотку крови с искомым антигеном), добавляют диагностическую сыворотку против него и вторичные антитела (против диагностической сыворотки), меченные ферментом, а затем субстрат/хромоген для фермента. Конкурентный ИФА для определения антигенов: искомый антиген и меченный ферментом антиген конкурируют друг с другом за связывание ограниченного количества антител иммунной сыворотки. Другой тест - Конкурентный ИФА для определения антител: искомые антитела и меченные ферментом антитела конкурируют друг с другом за антигены, сорбированные на твердой фазе. Иммуноблоттинг — высокочувствительный метод выявления белков, основанный на сочетании электрофореза и ИФА или РИА. Иммуноблоттинг используют как диагностический метод при ВИЧ-инфекции и др. Антигены возбудителя разделяют с помощью электрофореза в полиакриламидном геле, затем переносят их из геля на активированную бумагу или нитроцеллюлозную мембрану и проявляют с помощью ИФА. Фирмы выпускают такие полоски с «блотами» антигенов. На эти полоски наносят сыворотку больного. Затем, после инкубации, отмывают от несвязавшихся антител больного и наносят сыворотку против иммуноглобулинов человека, меченную ферментом. Образовавшийся на полоске комплекс [антиген + антитело больного + антитело против Ig человека] выявляют добавлением хромогенного субстрата, изменяющего окраску под действием фермента. |
|
|
Серологические реакции, используемые для диагностики вирусных инфекций. |
|
|
Иммунные реакции используют при диагностических и иммунологических исследованиях у больных и здоровых людей. С этой целью применяют серологические методы, т. е. методы изучения антител и антигенов с помощью реакций антиген—антитело, определяемых в сыворотке крови и других жидкостях, а также тканях организма. Обнаружение в сыворотке крови больного антител против антигенов возбудителя позволяет поставить диагноз болезни. Серологические исследования применяют также для идентификации антигенов микробов, различных биологически активных веществ, групп крови, тканевых и опухолевых антигенов, иммунных комплексов, рецепторов клеток и др. При выделении микроба от больного проводят идентификацию возбудителя путем изучения его антигенных свойств с помощью иммунных диагностических сывороток, т. е. сывороток крови гипериммунизированных животных, содержащих специфические антитела. Это так называемая серологическая идентификация микроорганизмов. В микробиологии и иммунологии широко применяются реакции агглютинации, преципитации, нейтрализации, реакции с участием комплемента, с использованием меченых антител и антигенов (радиоиммунологический, иммуноферментный, иммунофлюоресцентный методы). Перечисленные реакции различаются по регистрируемому эффекту и технике постановки, однако, все они основаны на реакции взаимодействия антигена с антителом и применяются для выявления как антител, так и антигенов. Реакции иммунитета характеризуются высокой чувствительностью и специфичностью. Особенности взаимодействия антитела с антигеном являются основой диагностических реакций в лабораториях. Реакция in vitro между антигеном и антителом состоит из специфической и неспецифической фазы. В специфическую фазу происходит быстрое специфическое связывание активного центра антитела с детерминантой антигена. Затем наступает неспецифическая фаза — более медленная, которая проявляется видимыми физическими явлениями, например образованием хлопьев (феномен агглютинации) или преципитата в виде помутнения. Эта фаза требует наличия определенных условий (электролитов, оптимального рН среды). Связывание детерминанты антигена (эпитопа) с активным центром Fab-фрагмента антител обусловлено ван-дер-ваальсовыми силами, водородными связями и гидрофобным взаимодействием. Прочность и количество связавшегося антигена антителами зависят от аффинности, авидности антител и их валентности. |
|


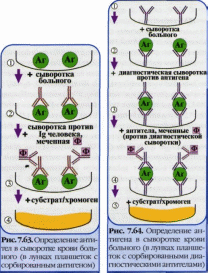 .
При определении антител (левый рисунок)
в лунки планшеток с сорбированным
антигеном последовательно добавляют
сыворотку крови больного,
антиглобулиновую сыворотку, меченную
ферментом, и субстрат/хромоген для
фермента.
.
При определении антител (левый рисунок)
в лунки планшеток с сорбированным
антигеном последовательно добавляют
сыворотку крови больного,
антиглобулиновую сыворотку, меченную
ферментом, и субстрат/хромоген для
фермента.