Неорганическая химия / Химия Элементов / Химическая и биологическая роль Озона / Рощина В.В. Озон и живая клетка / Введение_Ф
.DOC
ВВЕДЕНИЕ
В 1785 году голландец Ван Марум обратил внимание, что воздух, после пропускания через него электрических искр, приобретает характерный запах и обнаруживает окислительно-восстановительные свойства. Это явление швейцарский исследователь Шенбейн объяснил в 1840 году образованием особого газа, который он назвал озоном, от
-
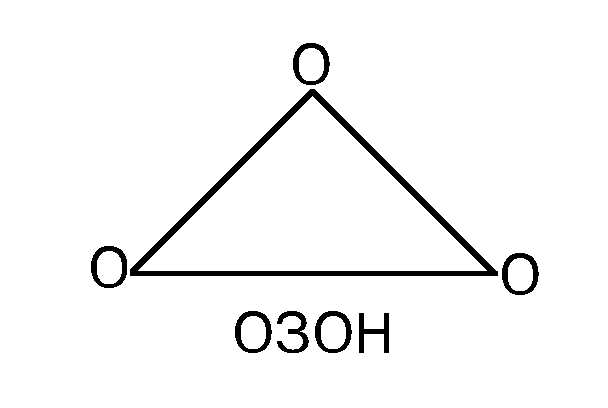
O3
греческого слова “озо” или ”о”, что означает “пахну”.
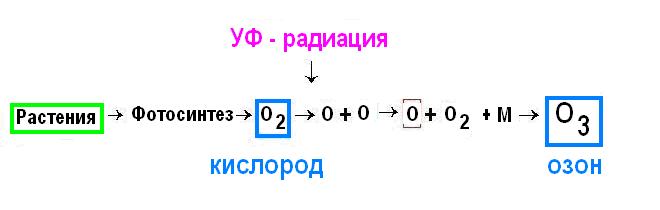
Озон или О3 является аллотропическим видоизменением кислорода - триоксидом и постоянно присутствует в воздухе. Основная масса этого газа образуется в атмосфере под действием ультрафиолетовой радиации, и его концентрация особенно возрастает в утренние часы, когда поток УФ-излучения максимален. Озон возникает также при грозе, что наиболее заметно в лесу, где его предшественниками являются выделения деревьев. Технический прогресс внес свой вклад в образование озона, поскольку многие современные приборы являются излучателями ультрафиолетовых лучей, и, следовательно, источниками озона. Этот газ возникает при диссоциации кислорода, образуемого при фотосинтезе растениями (Рис.1).
|
Рис.1. Схема образования озона из кислорода, выделяемого растениями в природе |
В процессе диссоциации обычного кислорода воздуха под влиянием ультрафиолетовой радиации (200-320 нм) в начале образуется атомарный кислород, который при ассоциации с двухатомным кислородом в присутствии любых частиц (М) превращается в озон. О3 может возникать в любых процессах, где возникает атомарный кислород. В Институте проблем химической физики РАН под руководством профессора Шилова удалось показать, что в присутствии в качестве катализатора марганца хлоропласты способны образовывать озон, поскольку при окислительных процессах часто образуется атомарный кислород. Озон обнаруживается даже в газовых выбросах вулканов, и глобальную важность для проблемы существования жизни на других планетах представляет недавно установленный факт присутствия озона на спутниках Сатурна. Таким образом, существует возможность образования озона на других планетах Галактики.
Образование и разрушение озона происходят как в верхних слоях атмосферы при участии коротковолновой радиации Солнца, так и в приземных слоях воздуха. Озон составляет небольшую часть атмосферы- всего 0,64 х 10-6 всей ее массы. Общее содержание озона в атмосфере принято характеризовать слоем озона (сконцентрированным в стратосфере, приведенным к нормальным условиям (0o С, 1 атм). Этот слой достигает величины 0,4-0,6 см. На рис.2 показано распределение озона по отдельным воздушным слоям, а также
|
Рис.2. Концентрации озона в атмосфере и его предельно допустимая концентрация |
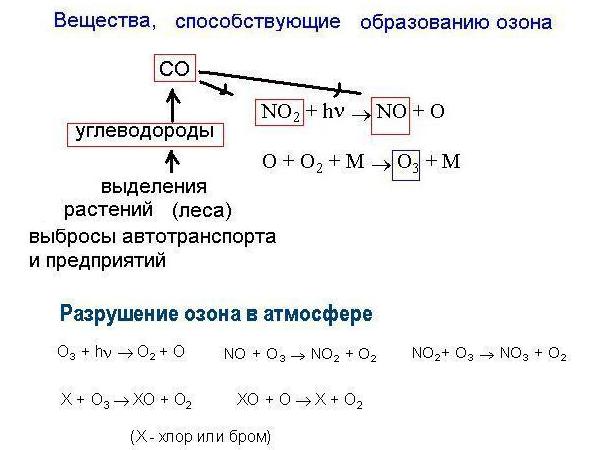
предельно допустимая для живых организмов концентрация, поскольку выше нее наблюдается опасное для живых существ загрязнение среды озоном. Основной баланс озона в атмосфере определяется соотношением веществ, способствующих образованию озона или, напротив, разрушающих это соединение (Рис.3):
|
Рис. 3. Образование и разрушение озона в атмосфере |
Распределение озона в атмосфере неравномерно и зависит от географической широты и времени года (больше в высоких широтах, максимально весной и минимально осень),а также погодных и многих других условий. Озон, содержащийся в верхних слоях атмосферы (в основном в стратосфере), целиком поглощает коротковолновые ультрафиолетовые лучи. Благодаря этому ультрафиолетовое излучение физиологически опасного для жизни диапазона (короче 295 нм) не достигает поверхности Земли. Озоновый слой стал истончаться в 70-х годах двадцатого столетия, а в 80-х началось регулярное снижение стратосферного слоя озона (образование “озоновых дыр”). Особенно сильно это наблюдалось в Антарктиде (до 50 %), по-видимому, из-за большой конвекции воздушных масс в сторону промышленных районов, где наблюдается усиленное разрушение озона за счет выбросов вредных веществ в атмосферу. Сокращение озонового слоя зафиксировано и в Северном полушарии, а в феврале- марте 1995 года вдвое уменьшилось количество озона над Сибирью. В большей мере исчезновение озона происходит при различных реакциях с химическими соединениями, образовавшимися в приземном слое Земли и затем из-за перемешивания воздуха поднятыми в стратосферу. Кроме фотохимических реакций, на содержание озона влияют динамические процессы в стратосфере - перенос воздушных масс по вертикали и горизонтали. (Количество атмосферного озона уменьшается еще в большей степени благодаря присутствию в воздухе химикатов, имеющих антропогенное происхождение).
Тропосфера - нижний слой атмосферы, простирающийся до высоты 8-15 км, где в приземном слое толщиной 30-50 м. сосредоточены все живые существа. В нем обычно озона немного, однако вследствие производственной деятельности человека оно нарастает. В приземном слое особенно больших городов (Токио, Лос-Анжелес и др.) наблюдается повышение концентрации атмосферного озона в 40-50 раз. В последнее десятилетие уровень приземного озона увеличился и в сельской местности, поскольку загрязняющие атмосферу вещества могут транспортироваться за сотни километров от их источника (главным образом, промышленных предприятий и автотранспорта). Во многих сельскохозяйственных районах содержание озона в 2-3 раза выше по сравнению с районами, где нет антропогенных влияний. Содержание этого газа в тропосфере за последние 30 лет возросло в среднем на 60%, а в целом за столетие в Европе - приблизительно в 5 раз. В высоких концентрациях озон является опасным токсикантом.
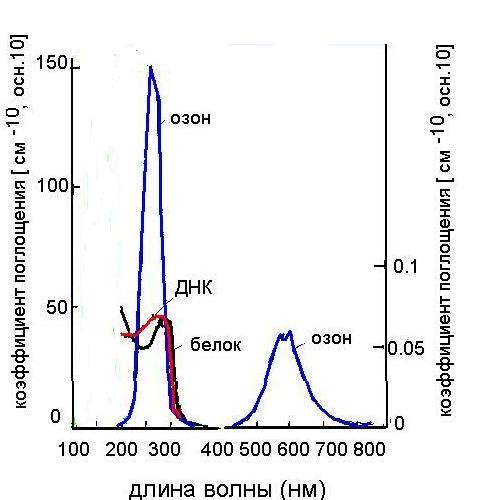
Главный эффект сокращения озонового слоя в стратосфере - увеличение ультрафиолетовой радиации в опасном для жизни диапазоне (250-320 нм), которая в норме поглощается озоном. Это - как раз то излучение, которое эффективно поглощается нуклеиновыми кислотами и белками (Рис.4). Ультрафиолетовое излучение, усилившееся из-за уменьшения озонового слоя Земли, вызывает возбуждение хромофоров, затем образуются фотопродукты,
|
Рис.4. Спектр поглощения озона и важнейших компонентов живых клеток
|
начинаются биохимические изменения в клетках, приводящие к образованию опухолей, раку кожи, катаракте, иммунологические и другие нарушения у человека. Заметные сдвиги под влиянием возросшего облучения могут наблюдаться и в общем состоянии экосистем, особенно наземной растительности и фитопланктона, а также осуществлении биогеохимических циклов. Таким образом, поглощение ультрафиолетовой радиации озоновым слоем страхует живые организмы от ее опасного влияния. Можно сказать, что озон защищает наиболее важные для жизни компоненты клеток - нуклеиновые кислоты и белки. В противном случае могли бы возникать повреждения, приводящие к возникновению мутаций, а иногда и гибели клеток.
Озон определяет и термический режим атмосферы. В инфракрасной области спектра озон имеет линию поглощения около 960 нм. Тем самым энергия, излучаемая Землей в инфракрасном диапазоне, задерживается озоном и остается в пределах земной атмосферы, что сохраняет тепловой баланс нашей планеты. Иначе наша планета сильно бы охлаждалась. Таким образом, содержание озона в атмосфере связано с изменением климата и условий жизни на Земле.
Проблема озона для землян становится столь важной, что 16 октября ежегодно отмечается День защиты Озонового слоя, а более 20 лет назад многими странами подписан Монреальский протокол о сокращении выбросов в атмосферу продуктов промышленности, уменьшающих озоновый слой атмосферы. Недавно введено понятие озоносферы для озонового слоя Земли. Озоносфера защищает организмы от губительного действия ультрафиолетовой радиации. Именно благодаря образованию озона стала возможна биосфера.
Снижение содержания озона в стратосфере связано с присутствием различных химических соединений антропогенного происхождения, проникающих в атмосферу в результате ядерных взрывов, космических полетов и полетов сверхзвуковой авиации, применения хлорорганических удобрений в сельском хозяйстве и др. C увеличением выбросов автотранспорта и промышленности возникает новая проблема - проблема тропосферного (приземного) озона, который составляет значительную часть смога больших городов. За последние пять лет она стала очень важной для здоровья Человека и даже для сохранения зеленых насаждений и предупреждения снижения урожаев сельскохозяйственных растений. В США создан специальный проект № NE-1030 “Характеристика и механизмы ответов растений на озон в США”на 2007-2012 годы по выработке защиты от тропосферного озона как сильного окислителя, оказывающего негативное влияние. Сезонными изменениями концентрациями озона в атмосфере городов, особенно в весенний период, объясняется нарушение многих функций у людей и животных (обостряются хронические заболевания легких, нервной и иммунной систем, обнаруживается рак кожи и сетчатки глаз и т.д.). Высокие концентрации озона особенно опасны при физических нагрузках, например при занятиях спортом и тяжелыми видами работ, когда токсическое действие газа проявляется в высшей степени.
В тоже время установлена роль озона не только как загрязнителя. Присутствие озона ощутимо в местах, богатых кислородом: в лесу, в приморской зоне или около водопада, что благотворно влияет на человеческий организм. Озон уже давно является необходимым фактором санитарии (Впервые озон как антисептическое средство был использован во время первой мировой войны). В 1857г. Вернер фон Сименс сконструировал первую техническую установку для очистки питьевой воды. С тех пор озонирование позволяет получить гигиенически чистую воду. В России действует несколько крупных станций, которые используются для доочистки питьевой воды, подготовки воды плавательных бассейнов, при глубокой очистке сточных вод в оборотном водоснабжении автомобильных моек и для очищения продуктов питания. К 1977 г. во всем мире действует более 1000 установок по озонированию питьевой воды. В настоящее время 95% питьевой воды в Европе обрабатывается озоном. Неслучайно озон используется для обеззараживания воздуха в помещениях и воды на очистительных станциях, где О3 образуется из молекулярного кислорода при электрическом разряде или под действием ультрафиолетового излучения. С 1935г. стали использовать ректально введение озоно-кислородной смеси для лечения различных заболеваний кишечника (проктит, геморрой, язвенный колит, свищи, подавление патогенных микроорганизмов, восстановление кишечной флоры). Изучение действия озона позволили использовать его в хирургической практике при инфекционных поражениях, лечении туберкулеза, пневмонии, гепатитов, герпетической инфекции, анемии и пр. В Москве в 1992г. создан Научно-практический центр озонотерапии, где озон используется для лечения широкого круга заболеваний, В концентрациях 0.015 частей на миллион озон вызывал повышение содержания кислорода в крови, укрепление иммунной системы, нормализацию давления, исчезновение многих симптомов стресса. Кислородно-озоновые смеси используются в лечении различных заболеваний, косметологии и многих сферах хозяйствования.
Сравнительно малые дозы озона могут оказаться полезными для стимуляции развития, повышения продуктивности и изменения регуляторных процессов в живых организмах. Окислительные свойства озона могут использоваться для обеззараживания материалов, в том числе питьевой воды и для модификации обмена веществ микроорганизмов в целях получения из них ценных метаболитов. Озонированная вода, например, применяется и как пестицид для уничтожения некоторых паразитов на растениях.
Как отрицательное, так и положительное действие озона на живые клетки следует учитывать в экологии среды обитания организмов. Угроза истощения озона в атмосфере и порой чрезмерное повышение его концентрации в приземном слое воздуха, а также возможное благотворное влияние малых концентраций озона выдвигает проблему соотношения жизни и содержания озона в атмосфере на одно из первых мест в науке.
Общие сведения об озоне атмосферы
Физико-химические свойства озона |
Образование озона в атмосфере |
Разрушение озона в атмосфере и в воде |
При нормальной температуре и давлении это – газ (тяжелее воздуха) синего цвета с характерным резким запахом. При температуре - 111,5С озон сгущается и превращается в нестойкую жидкость темно-синего цвета (Озон сжижается легче, чем кислород, и поэтому эти газы можно разделить). При температуре 100С О3 распадается до кислорода. В чистой воде озон разлагается быстрее, чем в газовой фазе. Растворимость озона в воде 0,394 г/л (при 0С), т.е. в 15 раз больше, чем у кислорода. В водных растворах солей озон растворяется слабее, чем в воде. В отличие от кислорода озон диамагнитен, взрывоопасен и ядовит. О3 в 3 раза токсичнее синильной кислоты, в 5 раз фосгена, в 10-15 раз хлора, в 50 раз фенола Исключительно высока его реакционная способность. О3 окисляет все металлы, за исключением серебра и платины. C неорганическими и органическими соединениями он образует озониды - один из видов перекисных соединений. 40 красителей флуоресцируют при наличии озона в воздухе: родамин, люминол, эозин, рибофлавин и др.
|
Озон
образуется при участии первичных
загрязняющих атмосферу веществ (окиси
углерода, углеводородов, окиси азота,
водорода) и солнечного света. Окись
углерода (СО) образуется при сгорании
любых видов углеводородного топлива
в результате неполного окисления
углерода, вклад вносит также
растительность, выделяющая этот газ.
Окись углерода образуется при распаде
полифенолов (на свету), при окислении
изопрена и терпеноидов, выделяемых
растениями. Окислы азота, также
принимающие участие в образовании
озона, вырабатыва--ются нефтеперерабатывающими
заводами, образуются при нитрификации
в почве и др. процессах. Значительный
вклад в образование СО и NOx
вносит автомобильный транспорт. . В
образовании озона участвуют
гидроксирадикал ( CO
+
Н
+ O2
+ M
Н Н 2 + NO NO2 + OH , где М - любая молекула или атом. Далее происходит фотолиз диоксида азота и последующее взаимодействие атома кислорода с молекулой кислорода:
NO2 + h NO + O O + O2 + M O3 + M |
Разрушение озона происходит вследствие его реакции с малыми составляющими атмосферы , такими как NO, NO2, Cl2, Br2 и др., большинство из которых имеет антропогенное происхождение. Реакции протекают по цепному механизму: NО + О3 NO2 + O2 NО2+ O3 NОЗ + O2 или X + O3 XO + O2 XO + O X + O2 (X - фтор, хлор или бром). Озон может вступать в реакции практически со всеми типами органических соединений. Скорость и механизм этих реакций зависят от природы вещества, с которым он реагирует. В природе озон взаимодействует с органическими веществами и газами, экскретируемыми живыми организмами. С непредельными соединениями озон реагирует очень быстро, внедрясь по двойной связи, протекая по свободно-радикальному механизму и образуя озониды, соединения с перекисной и эфирной связями. Эти соединения быстро распадаются, а в качестве конечных продуктов реакции образуются спирты, кетоны, кислоты. Медленнее протекают реакции с разрывом ковалентной С-Н связи. |
Основные физические характеристики и реакции этого соединения подробно описаны в монографии Лунина с соавторами (1998).
Список обозначений доз озона
1 часть/млн = 1 часть газа на миллион частей воздуха =1мкл/л = 1000 часть/млрд = 1960 мкг/м3= 0,41 х 10 -7 моль/л = 9,3 х 10-5 % ~
1 часть/миллиард = 1 часть газа на миллиард (биллион) частей воздуха = 1нл/л = 0,001 часть/млн = 0,001 мкл/л = 1,96 мкг/м3 = 0,41 х 10-11 моль/л
Объемный 1 % = 1,07 х 104 часть/млн = 1,07 х 104 мкл/л = 1,07 х 107 часть/миллиард = 21,4 х 106 мкг/м3 = 42,8 x 10-5 моль/л