
12 Диссертация Смолянова
.pdf11
определения содержания специфических антител в фармацевтической субстанции и ЛП ИГЧ против COVID-19.
Входе выполнения работы был использован комплекс физико-химических,
биофармацевтических, иммунохимических, иммунологических методов исследования, а также статистические методы исследования и обработки результатов.
Степень достоверности и апробация полученных результатов
Достоверность полученных результатов обусловлена достаточным количеством экспериментальных исследований, обеспечивающих статистическую достоверность и репрезентативность выборок, с применением современных методик анализа и статистической обработки материала в соответствии с требованиями Государственной Фармакопеи РФ.
Апробация результатов исследования
Результаты исследований представлены на научно-практической конференции
«ИммуноБиотех-2021» (Томск, 2021), научно-практической конференции «Разработка и регистрация ЛП» (Москва, 2022), II международной научно-практической конференции
«Актуальные проблемы и перспективы фармацевтической науки и практики» (Кемерово, 2022).
Публикация материалов исследования
По теме диссертации опубликовано 9 работ, из них 5 статей – в рецензируемых научных изданиях, 4 тезиса докладов в сборниках трудов научных конференций, а также оформлена заявка на выдачу Евразийского патента «Способ получения иммуноглобулина G против COVID-
19», номер заявки 202290695.
Личный вклад автора в проведенное исследование и получение научных
результатов
Результаты экспериментов, представленные в диссертации, получены лично автором или при его непосредственном участии. Автором проведен спектр исследований, включая разработку методик, анализ и статистическую обработку полученных данных, подготовку материалов к публикации, написание диссертационной работы. Исследования проводились в лабораториях АО
«НПО «Микроген».
Соответствие диссертации паспорту научной специальности
Научные положения диссертации соответствуют паспорту специальности
14.4.2. Фармацевтическая химия, фармакогнозия, а именно пункту 2 «формулирование и развитие принципов стандартизации и установление нормативов качества, обеспечивающих терапевтическую активность и безопасность лекарственных средств», пункту 3 – «разработка новых, совершенствование, унификация и валидация существующих методов контроля качества лекарственных средств на этапах разработки, производства и потребления».
12
Положения, выносимые на защиту
1. Обоснование научно-методического подхода, заключающегося в выборе метода оценки специфической активности, заменяющего реакцию вируснейтрализации (РВН), для фор-
мирования фармацевтической субстанции – специфической плазмы для фракционирования, с це-
лью разработки лекарственного препарата иммуноглобулина человека против COVID-19.
2.Разработка методики количественного определения антител к SARS-CoV-2 в
фармацевтической субстанции и стандартный образец для определения специфической активности в фармацевтической субстанции с аттестованным значением 20 АКЕ/мл для производства лекарственного препарата иммуноглобулина человека против COVID-19.
3.Разработка стандартного образца для количественного определения антител к SARS- CoV-2 в лекарственном препарате иммуноглобулина человека против COVID-19 с аттестован-
ным значением 320 АКЕ/мл.
4. Разработка фармакопейной методики определения специфической активности лекар-
ственного препарата иммуноглобулина человека против COVID-19, обеспечивающая получение достоверных и сопоставимых с международными стандартами значений специфической актив-
ности.
5. Апробация методики количественного определения антител к SARS-CoV-2 с целью изучения фармакокинетических параметров лекарственного препарата иммуноглобулина человека против COVID-19.
Объем и структура диссертации
Диссертационная работа изложена на 216 страницах компьютерного текста,
иллюстрирована 26 рисунками и 73 таблицами, состоит из введения, обзора литературы,
описания материалов и методов, 4 глав экспериментальных исследований, заключения, выводов,
списка литературы, включающего 174 источника (из них 93 на иностранных языках), включая 13
приложений на 53 страницах.
13
ГЛАВА 1. ОБЗОР ЛИТЕРАТУРЫ
1.1. Обзор эпидемиологической ситуации, вызванной новой коронавирусной инфекцией и терапевтических средств для лечения COVID-19
В конце декабря 2019 года в Китае (г. Ухань), было зафиксировано появление новой опасной вирусной инфекции, которая быстро распространилась по всему миру. Было установлено, что возбудителем этой инфекции является новый тип коронавируса, родственный коронавирусу SARS-CoV-1, вызывающий тяжелый острый респираторный синдром. По этой причине, он был назван SARS-CoV-2 [1, 44, 45].
11 марта 2020 г. ВОЗ официально признала вспышку новой коронавирусной инфекции
COVID-19, вызванной вирусом SARS-CoV-2, пандемией. К 10 июня 2021 года в мире было зарегистрировано более 175 миллионов лабораторно подтвержденных случаев заражения SARS- CoV-2 и более 3,5 миллионов смертей [1].
Сложившаяся эпидемиологическая ситуация срочно требовала эффективных и специфических лекарственных препаратов и как следствие активизировала научный поиск средств диагностики и эффективного лечения по всему миру.
Самой эффективной лечебной стратегией при инфекционной патологии по праву считается этиотропная терапия. Существует тенденция ограничивать понятие этиотропной терапии инфекций исключительно лечением при помощи противомикробных химиопрепаратов.
Однако, к этиотропной терапии относится также эффективный метод лечения с применением лечебных препаратов специфических иммуноглобулинов – антител к антигенам тех или иных возбудителей инфекционных болезней. Терапия при помощи лечебных препаратов специфических иммуноглобулинов имеет ряд бесспорных преимуществ по сравнению с современной химиотерапией и должна занимать достойное место в алгоритмах лечения различных инфекционных болезней человека [24-26].
Иммуноглобулинотерапия не имеет альтернатив при необходимости быстрого ограничения эпидемии инфекционной болезни, к возбудителю которой отсутствует специфическая вакцина [24-26].
Почти с самого начала пандемии COVID-19 появились сообщения об использовании плазмы реконвалесцентов (ПР), как перспективном методе лечения [6-13]. Опыт лечения больных, полученный во время предыдущих эпидемий, вызванных (SARS-CoV, MERS-CoV),
позволяет рассматривать как потенциально эффективный терапевтический подход трансфузию плазмы реконвалесцентов [2-5].
Результаты нескольких исследований подтверждают положительное влияние ПР на лечение пациентов с COVID-19 на различных стадиях заболевания [6-13].
14
Результаты завершенных исследований кажутся противоречивыми в отношении эффективности и преимуществ ПР. В настоящее время, согласно международным рекомендациям по терапии ПР с высоким титром антител к SARS-CoV-2 (высокотитрованной ПР) разрешена в соответствии с Emergency Use Authorizations (EUA) для лечения госпитализированных больных с COVID-19 и лиц с ослабленным иммунитетом [14-16].
По результатам многоцентрового обсервационного когортного исследования, в котором проводили анализ эффективности/безопасности применения реконвалесцентной плазмы у пациентов с COVID-19 в зависимости от сроков введения и титра антител в стационарах Департамента здравоохранения г. Москвы, оптимальные результаты применения ПР достигнуты с применением плазмы с высоким титром специфических антител. [12].
Проведенный анализ кажущихся противоречивыми результатов клинических испытаний показал, что использование ПР с высоким титром антител к SARS-CoV-2 (RBD домену S белка)
на ранней стадии заболевания (предпочтительно в течение 3 дней с момента появления симптомов) может снизить смертность и прогрессирование COVID-19 [19].
Основная проблема терапии ПР — контроль её качества и стандартизация. Существует ряд ограничений в применении, связанных с необходимостью применения плазмы с высоким титром специфических антител для обеспечения эффективности терапии. Классическим методом определения вируснейтрализующей активности является реакция вируснейтрализации (РВН),
которая имеет ряд ограничений в рутинном использовании и может привести к невозможности стандартизации используемой ПР.
При этом, использование ЛП ИГЧ, полученного из плазмы, содержащей очищенные антитела к SARS-CoV-2, может иметь ряд преимуществ.
Гипериммунные иммуноглобулины давно доказали свою эффективность и являются основным способом экстренной профилактики и лечения бешенства, столбняка, клещевого энцефалита и ряда других бактериальных и вирусных инфекций [24-29].
Интерес к таким разработкам продемонстрировали ведущие мировые производители препаратов крови, которые приступили к созданию ПЛ ИГЧ против COVID-19: израильская компания Камада в сотрудничестве с итальянской компанией Кедрион объявили о своем сотрудничестве 28 апреля 2020 года, а 4 ведущих мировых производителя CSL Behring, Takeda, Emergent BioSolutions и Grifols организовали альянс для работы по данному проекту 6 апреля
2020 года [32-34].
Общие методы фракционирования плазмы с этапами очистки и удаления вирусов обеспечивают безопасность ЛП гипериммунных ИГЧ по сравнению с используемой для этих же целей ПР [41]. При производстве препаратов иммуноглобулинов обеспечивается и
15
контролируется также содержание специфической активности, что позволяет стандартизовать ЛП [21, 22, 23].
Вандеберг с соавторами описал производство нескольких партий ЛП ИГЧ, содержащих антитела к SARS-CoV-2 и показал, что характеристики продукта были аналогичны характеристикам для препарата ЛП ИГЧ «Gamunex», и соответствовали высокоочищенному продукту, который сохраняет специфическую активность иммуноглобулинов класса G,
обнаруженную в исходной плазме [36, 37].
Цель фармацевтической разработки – создать качественный, эффективный и безопасный ЛП, и обосновать процесс его производства для того, чтобы постоянно выпускать продукт с требуемыми свойствами (характеристиками).
Таким образом, начало разработки нового препарата специфического внутривенного анти-COVID-19 гипериммунного глобулина требует в первую очередь разработки и стандартизации критерия, характеризующего основной параметр качества разрабатываемого ЛП
– специфическая активность.
Фармацевтическая разработка специфических иммуноглобулинов (СИГ), полученных из плазмы крови человека, включает выбор фармацевтической субстанции, способа (метода)
промышленного выделения основного действующего вещества (ОДВ), состава и вида лекарственной формы, первичной и вторичной (потребительской упаковки), показателей качества и методов их оценки для обоснования свойств ЛП, программ (объема) доклинических и клинических исследований и показаний к медицинскому применению.
Одним из важнейших показателей, определяющих качество специфических противовирусных ЛП ИГЧ, является содержание антител, нейтрализующих вирус, – показатель специфической активности. Однако в настоящее время получают противоречивые результаты исследований различных наборов для иммунологического анализа. Исследования показывают,
что серологическая оценка SARS-CoV-2 с помощью одной тест-системы требует осторожности не только при выявлении инфекции, но и при оценке иммунологического статуса [46-49].
Требования к показателям качества сырья и ЛП, полученных из плазмы крови человека, и
методам их оценки определены и описаны в государственных фармакопеях США, ЕС и РФ [5052].
В условиях отсутствия фармакопейных стандартов качества на препараты ИГЧ производители самостоятельно разрабатывают нормативные документы по качеству ЛП,
содержащие перечень показателей качества, критерии и методы их оценки. Поэтому перед началом разработки показателей качества специфической активности иммуноглобулина против
COVID-19 и метода его оценки требуется провести анализ возможных методов оценки специфической активности.
16
1.2.Анализ современного состояния проблемы оценки уровня антител,
специфичных к вирусу SARS-CoV-2 для оценки показателя специфической активности
При создании и внедрении в практику ЛП специфических ИГЧ одной из основных задач является разработка критериев для оценки их качества, а в препаратах для профилактики и лечения инфекционных заболеваний в первую очередь — это разработка методов оценки специфической активности, которая напрямую связана с эффективностью данных ЛП [53,54].
Так как разработка препарата ЛП ИГЧ против COVID-19 проводилась одновременно с разработкой подобных препаратов другими производителями препаратов крови, отсутствовал общепринятый подход к оценке уровня специфической активности. Для разработки принципа оценки специфической активности ЛП ИГЧ против COVID-19 следовало изучить применяемые методики и подходы для оценки уровня специфических антител к вирусу SARS-CoV-2 и оценить,
могут ли какие-либо из используемых подходов быть применены для оценки специфической активности ЛП ИГЧ против COVID-19.
С момента официальной регистрации вспышки COVID-19 не было найдено модели с использованием лабораторных животных, инфицирование которых вирусом SARS-CoV-2
приводило бы к смерти. Однако, достаточно оперативно был изучен механизм проникновения вируса в клетки организма, были определены типы клеток, чувствительные к вирусу SARS-CoV- 2 [55-57].
Было установлено, что важную роль в процессе проникновения вируса в клетку играет рецептор связывающий домен (Receptor Binding domain, RBD-домен) поверхностного гликопротеина S вируса SARS-CoV-2. Вирус проникает в клетки, несущие на своей поверхности АПФ-2 рецептор, который находится на поверхности всех эпителиальных клеток [58]. Таким образом, были установлены, чувствительные к вирусу перевиваемые клеточные культуры. Одной из наиболее восприимчивых культур оказалась широко распространенная и удобная в лабораторной работе культура клеток VERO [56]. В связи с этим, в качестве стандарта определения уровня вируснейтрализующих антител, специфичных к SARS-CoV-2 была выбрана РВН на культуре клеток VERO [59, 60 61]
Было сделано предположение, что блокировка (связывание) RBD области S белка препятствует проникновению вируса в клетки, и как следствие позволяет организму полностью нейтрализовать вирус.
Далее в экспериментах на культуре клеток VERO было подтверждено, , что вещества,
обладающие вируснейтрализующей активностью (ВНА) в основном направлены к RBD домену
S белка SARS-CoV-2 и при взаимодействии с ним блокируют способность вируса связываться с вирусным рецептором АПФ-2 на поверхности клетки мишени [55-62] (Рис. 1.1).

17
Рисунок 1.1 – Схематическое изображение нейтрализации вируса SARS-CoV-2
антителами. а — адсорбция вириона на клетке-мишени SARS-CoV-2 путём образования связи между гликопротеином S вируса и клеточным АПФ-рецептором; б — антитела, обладающие вируснейтрализующей активностью, блокируют адсорбцию вируса на клетке-мишени [61]
Вируснейтрализующий эффект был также подтвержден при переносе антител,
специфичных RBD-домену, чувствительным к инфекции SARS-CoV-2 животным (мыши, хомяки и макаки резусы), у которых наблюдалась защитная активность этих антител [62-65].
Предполагают, что положительный клинический опыт применения ПР для лечения пациентов с
COVID-19 также связан с наличием в плазме вируснейтрализующих антител, поэтому ряд стран издали рекомендации по отбору плазмы по уровню ВНА [13, 15, 16, 66]. Основным показателем специфической активности большинства профилактических вакцин против COVID-19 также является наличие антител с ВНА в сыворотке крови вакцинированных лиц [66]. Таким образом,
тест на уровень ВНА широко востребован в области биомедицинских исследований.
Традиционные методы оценки уровня ВНА веществ, в частности антител к SARS-CoV-2,
основаны на способности ингибировать бляшкообразование или цитопатогенное действие (ЦПД)
вируса на чувствительной культуре клеток VERO [60]. Применительно к SARS-CoV-2,
поскольку работа ведётся с вирулентным штаммом вируса, проведение РВН является достаточно трудоемким и сложным процессом, требующим наличия специальной лаборатории, отвечающих требованиям безопасности работ с патогенными биологическими объектами II группы патогенности. Метод РВН является биологическим, для которых характерно достаточно
18
длительный период проведения исследования. Все вышеописанные ограничения не позволяют применять РВН в рутинной практике.
Также описаны несколько альтернативных подходов к определению ВНА, не требующих работы с вирусом. Это «суррогатные» тест-системы, основанные на использовании псевдовирусных частиц на основе рекомбинантных вирусов и различных репортерных систем [67, 68, 69]. Некоторые альтернативные подходы к определению ВНА позволяют получать результат значительно быстрее, чем методы, основанные на регистрации вирусного ЦПД. Однако, несмотря на отмеченные ограничения, традиционные методы титрования остаются «золотым стандартом» определения ВНА, поскольку наиболее точно моделируют естественный процесс нейтрализации вируса различными веществами, в том числе антителами.
Учитывая необходимость проведения большого числа рутинных тестирований в процессе производства ЛП ИГЧ против COVID-19, представлялось целесообразным изучить возможность замены трудоемкого, дорогостоящего и длительного по исполнению метода РВН на более простой метод.
Наиболее подходящим для целей рутинного использования представляется метод,
который поддается валидации, является количественным и может быть легко масштабирован и освоен другими лабораториями, например, метод иммуноферментного анализа (ИФА)
достаточной чувствительности и специфичности. Считается, что антитела со специфичностью к
RBD домену демонстрируют выраженную ВНА в РВН, что позволяет предположить, что именно антигенная специфичность ИФА тест-системы к S белку, поддомену S1 и RBD домену может демонстрировать корреляцию с результатами в РВН для определения ВНА антител [70].
Важно отметить, что, вопреки устоявшемуся мнению, антитела, обладающие ВНА к
SARS-CoV-2, направлены не только к эпитопам RBD, но и к эпитопам других доменов белка
S [65, 71, 72]. С момента официальной регистрации вспышки COVID-19 стали доступны многочисленные тест-системы ИФА, предназначенные для диагностического определения антител, специфичных к SARS-CoV-2 [73]. Тест системы были разработаны для определения антител как на отдельные белки вируса SARS-CoV-2 (тест-системы для определения антител,
специфичных к N белку, S белку, различным доменам S белка), так и для определения антител различным доменам белка S [74].
Считается, что только традиционные методы РВН способны достоверно свидетельствовать о ВНА антител при выраженном эффекте защиты животных моделей, или в экспериментах на культуре клеток, тогда как «суррогатные» тест-системы, основанные на твердофазном ИФА, выявляют только антитела, направленные к эпитопам белков, используемых в тест-системах и напрямую не свидетельствуют о ВНА. Однако, исходя из требований ВОЗ,
19
замена методов определения возможна при наличии коэффициента корреляции между сравниваемыми методами не менее, чем 0,9 [75].
Таким образом, замена РВН как метода оценки специфической ВНА антител к SARS-CoV-
2 на метод ИФА возможна, но требует дополнительного всестороннего изучения. В первую очередь, требуется изучить опыт применения иммунологических методов для контроля специфической активности в ЛП ИГЧ, начиная с номенклатуры показателей специфической активности и методов определения, зарегистрированных ЛП специфических ИГЧ.
1.3.Состояние проблемы разнообразия ИФА тест-систем для определения антител
кSARS-CoV-2
В ответ на крайне быстрое распространение инфекции за несколько месяцев от начала пандемии появилось большое количество тест-систем для определения антител, специфичных к вирусу SARS-CoV-2 [76-78].
Данные тест-системы разрабатывались с целью диагностики, то есть качественного обнаружения патоген-специфических антител, которые появляются в течение нескольких дней после заражения, так как антитела представляет собой устойчивый биомаркер контакта с инфекцией.
Появившиеся к середине 2020 года ИФА тест-системы отличались различными характеристиками по классу детектируемых антител (IgA, IgM и IgG), по специфичности к различным белкам вириона SARS-CoV-2, эффективности, интерпретации результатов, но часто с недостаточной валидацией на клинических образцах [79].
По антигенной специфичности различными группами были разработаны ИФА тест-
системы для обнаружения антител к SARS-CoV-2 с использованием различных антигенов, таких как нуклеокапсиды (N), рецептор-связывающий домен (RBD-домен), субъединицы S1 и S2
шиповидного гликопротеина (S), полноразмерный S белок, а также смеси всех белков вириона
[80].
Анализ структуры вириона SARS-CoV-2 и патогенеза вируса привел к появлению предположений, что именно S белок участвует в проникновении вируса в клетку и соответственно является перспективной мишенью для терапевтических средств [81-83]. Также данный предполагаемый механизм проникновения вируса в клетку по средствам взаимодействия
S белка с АПФ-2 рецептором клетки может обуславливать специфичность нейтрализующих антител. Так большинство источников сходилось на том, что антитела именно специфичные к S
белку должны обладать выраженной ВНА (Рис 1.2) [82-83].
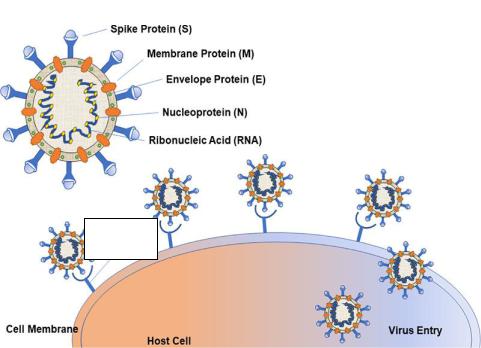
20
Шиповидный белок (S-белок)
АПФ
рецептор
Клеточная |
|
|
|
|
|
|
|
механизм |
|
мембрана |
|
|
|
|
|
Клетка |
|||
|
|
|
проникновения в |
|
|
|
|
|
|
|
|
|
|
клетку |
|
|
|
|
|
Рисунок 1.2 – Схематическое изображение строения вируса SARS-CoV-2 и механизма проникновения в клетку [81]
Однако литературные данные о специфичности, а также корреляции данных ИФА тест-
систем с ВНА были крайне противоречивыми [84-85].
Так исследование 16 ИФА тест-систем (в трех из которых использовался рекомбинантный нуклеокапсидный антиген (rN), а в восьми использовался рекомбинантный шиповидный антиген
(rS) RBD; в двух не был указан белок (белки), используемый в качестве захватывающего антигена, а в двух использовался как rN, так и rS) показало, что выбранный антиген сам по себе влияет на эффективность анализа. Вместо этого различия в эффективности, по-видимому,
связаны с общим дизайном ИФА тест-систем, а не с выбором антигена. Это соответствует наблюдениям, сделанным Haveri et al., которые продемонстрировали одновременное появление антител, специфичных к белкам N и S, обладающих ВНА [84-85].
Анализ 101 донора с COVID-19 10 тест-системами с использованием рецептор-
связывающего домена (RBD), доменов 1 и 2 S белка и N белка показали, что коэффициенты корреляции Спирмена между серологическими результатами и результатами, полученными в РВН варьировались от 0,41 до 0,69. Чувствительность и специфичность ИФА-тестов в прогнозировании ВНА антител составляли 35–100% и 35–90% соответственно (Рис. 1.3) [86].
