
9527
.pdf
30
6. ОСНОВНЫЕ ГАЗОВЫЕ ПРОЦЕССЫ
Основными термодинамическими процессами являются:
1) процесс сообщения или отнятия теплоты при постоянном объеме газа
(v = const) – изохорный процесс;
2) процесс сообщения или отнятия теплоты при постоянном давлении
(р =const) – изобарный процесс;
3) процесс сообщения или отнятия теплоты при постоянной температуре
(t = const) – изотермический процессе:
4) процесс без сообщения или отнятия теплоты извне (dq = 0) – адиабат-
ный процесс; 5) процесс, в котором изменение параметров подчиняется уравнению
pvm const,
где m – величина, постоянная для данного процесса, – политропный процесс.
6.1Изохорный процесс
Вдиаграмме p-v этот процесс изображается прямой 1-2, параллельной оси ординат. Уравнение прямой 1-2 (рис. 4), называемой изохорой,
vconst.
Рис. 4

31
Зависимость между начальными и конечными параметрами процесса
|
p1 |
|
T1 |
. |
|
|
(70) |
|
|
|
|
|
|
||||
|
p2 |
T2 |
|
|
|
|||
Изменение внутренней энергии |
|
|
|
|
|
|
||
uv qv cv/n(t2 t1). |
|
|
(71) |
|||||
Если в процессе участвует М кг или Vн м3 газа, то количество теплоты или |
||||||||
изменение внутренней энергии газа |
|
|
|
|
|
|
||
Qv Uv Mcvm(t2 |
|
|
|
(t2 |
t1), |
(72) |
||
t1) Vнcvm |
||||||||
где Vн – количество газа в м3 при нормальных условиях.
Если количество теплоты необходимо подсчитать, пользуясь нелинейной зависимостью теплоемкости от температуры, то следует пользоваться форму-
лой (41) или (43).
В изохорном процессе газ работы не совершает (L = 0).
Задача
В закрытом сосуде емкостью V = 0,6 м3 содержится воздух при давлении
р1 = 0,5 МПа и температуре t1 = 20° С. В результате охлаждения сосуда воздух,
содержащийся в нем, теряет 105 кДж.
Принимая теплоемкость воздуха постоянной, определить, какое давление и какая температура устанавливаются после этого в сосуде.
Решение
Пользуясь уравнением состояния, находим массу воздуха в сосуде:
MpV 0,5 106 0,6 3,57 кг. RT 287 293
Количество теплоты, отводимой от воздуха в процессе, определяется уравнением (72):
Q Mcvm(t2 t1),
откуда
32
t |
|
|
|
Q |
t |
|
|
105 |
|
20 40,7 20 20,7 C. |
|
|
|||
|
|
Mc |
3,57 0,723 |
|
|
||||||||||
|
2 |
|
|
1 |
|
|
|
|
|
|
|
||||
|
|
|
|
vm |
|
|
|
|
|
|
|
|
|
|
|
Значение |
|
сvт = |
0,723 |
получено |
из выражения c |
|
μcvm |
|
20,93 |
(для |
|||||
|
|
28,96 |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
vm |
|
μ |
|
||
двухатомных газов).
Из соотношения параметров в изохорном процессе имеем
p |
p |
T2 |
0,5 |
273 20,7 |
0,43 МПа. |
|
|
||||
2 |
1 T |
293 |
|
||
|
|
1 |
|
|
|
6.2Изобарный процесс
Вдиаграмме p-v этот процесс изображается прямой 1-2, параллельной оси абсцисс. Уравнение прямой 1-2 (рис. 3), называемой изобарой,
p const.
Зависимость между начальными и конечными параметрами процесса
|
v1 |
|
T1 |
. |
(73) |
|
|
|
|||
|
v2 |
T2 |
|
||
Работа 1 кг газа |
|
|
|
||
l p(v2 |
v1) |
(74) |
|||
или |
|
|
|
||
l R(T2 T1). |
(75) |
||||
Рис. 3

33
Для М кг газа
L Mp(v2 |
v1) p(V2 V1) |
(76) |
или |
|
|
L MR(t2 t1). |
(77) |
|
Если в процессе р = const участвует М кг или Vн м3 газа, то количество |
||
теплоты |
|
|
Qp Mcpm(t2 |
t1) Vнсpm(t2 t1), |
(78) |
где Vн – количество газа в м3 при нормальных условиях.
Если количество теплоты необходимо подсчитать, пользуясь нелинейной зависимостью теплоемкости от температуры, то следует пользоваться форму-
лой (42) или (44).
Изменение внутренней энергии газа определяют по формуле (71) или (41).
Задача
Какое количество теплоты необходимо затратить, чтобы нагреть 2 м3 воз-
духа при постоянном избыточном давлении р = 0,2 МПа от t1 = 100 °С до t2 = 500 °С? Какую работу при этом совершит воздух? Давление атмосферы при-
нять равным 101325 Па.
Решение
Согласно уравнению (42):
qp cpm2t2 cpm1t1.
Определяем теплоемкости воздуха по справочным данным
cpm1 1,0061 кДж/(кг К); cpm2 1,0387 кДж/(кг К).
Следовательно,
qp 1,0387 500 1,0061 100 418,7 кДж/кг.
Массу воздуха определяем из характеристического уравнения
M pV (0,2 0,1013) 106 2 5,63 кг.
RT |
287 373 |
34
Таким образом,
Qp Mqp 5,63 418,7 2357 кДж.
Количество теплоты можно получить не только по массе воздуха, но и по его объему. В этом случае уравнение (42) следует написать так:
qp cpm2t2 cpm1t1.
Пользуясь справочными данными, получаем
cpm1 (cpm1)1000 1,3004 кДж/(м3 К);
cpm2 (cpm2)5000 1,3427 кДж/(м3 К).
Тогда
qp 1,3427 500 1,3004 100 541,4 кДж/ м3.
Объем воздуха должен быть приведен к нормальным условиям. Согласно уравнению (22)
V |
pVTн |
|
0,3013 2 273 |
4,35 м3. |
|
|
|||
н |
Tp |
373 0,1013 |
||
|
н |
|
|
|
Таким образом,
Qp qpVн 541,4 4,35 2356 кДж.
Работа газа по уравнению (77)
L MR(t2 t1) 5,63 287 400 646,3 кДж.
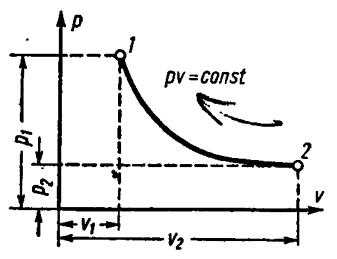
6.3 Изотермический процесс
Кривая изотермического процесса, называемая изотермой, в диаграм-
ме p-v изображается равнобокой гиперболой (рис. 5). Уравнение изотермы в координатах p-v
pv const.
35
Рис. 5
Зависимость между начальными и конечными параметрами определя-
ется формулами:
|
p1 |
|
v2 |
; |
|
|
|
|
(79) |
||||||
|
|
|
|
|
|
|
|||||||||
|
p2 |
|
v1 |
|
|||||||||||
|
p1 |
|
V2 |
. |
|
|
|
|
(80) |
||||||
|
|
|
|
|
|
|
|||||||||
|
p2 |
|
V1 |
|
|||||||||||
Работу 1 кг идеального газа находят из уравнений: |
|
||||||||||||||
l RTln |
v2 |
; |
(81) |
||||||||||||
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
v1 |
|
||||||
l RTln |
|
|
p1 |
; |
(82) |
||||||||||
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
p2 |
|
|||||||
l pv ln |
v2 |
; |
(83) |
||||||||||||
|
|||||||||||||||
1 1 |
|
|
|
|
|
v |
|
||||||||
|
|
|
1 |
|
|
|
|
|
|||||||
l p v |
ln |
p1 |
. |
(84) |
|||||||||||
|
|||||||||||||||
1 1 |
|
|
|
|
|
p |
|
||||||||
|
|
|
2 |
|
|
|
|
|
|||||||
Если в процессе участвуют М кг газа, то полученные из формул (81) - (84) значения нужно увеличить в М раз. Можно также для этого случая в формулах (83) и (84) заменить удельный объем v полным объемом V. Тогда получим
36
L pV ln |
v2 |
; |
(85) |
|||
v |
||||||
1 1 |
|
|
|
|
||
|
|
1 |
|
|
|
|
L pV ln |
|
p1 |
. |
(86) |
||
|
|
|||||
1 1 |
|
p |
|
|
|
|
|
|
2 |
|
|
||
Так как в изотермическом процессе t = const, то для идеального газа
u cvm(t2 t1) 0.
Количество теплоты, сообщаемой газу или отнимаемой от него,
qt |
l |
(87) |
или для М кг газа |
|
|
Qt |
L. |
(88) |
Натуральный логарифм, входящий в формулы, может быть заменен деся-
тичным по соотношению
ln N 2,303lgN.
Задача
1 кг воздуха при температуре t1 = 30 °С и начальном давлении р1 = 0,1 МПа сжимается изотермически до конечного давления р2 = 1 МПа.
Определить конечный объем, затрачиваемую работу и количество тепло-
ты, отводимой от газа.
Решение
Найдем начальный объем воздуха из уравнения состояния:
v |
RT1 |
|
287 303 |
0,87 м3/ кг. |
|
p |
0,1 106 |
||||
1 |
|
|
|||
|
1 |
|
|
|
Так как в изотермическом процессе
p1v1 p2v2,
то конечный объем
v |
v |
p1 |
0,87 |
1 |
0,087 м3/ кг. |
|
|
||||
2 |
1 p |
10 |
|
||
|
|
2 |
|
|
|
Работа, затрачиваемая на сжатие 1 кг воздуха, получается из уравнения
|
|
|
|
37 |
|
(82): |
|
|
|
|
|
l RTln |
p1 |
2,303RTlg |
p1 |
2,303 287 303 lg10 200 кДж/ кг. |
|
p2 |
p2 |
||||
|
|
|
Количество теплоты, отводимой от газа, равно работе, затраченной на сжатие. Следовательно,
q 200 кДж/ кг.
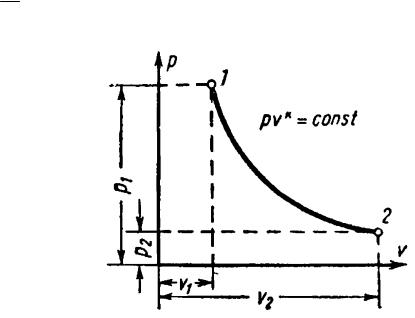
6.4 Адиабатный процесс
Уравнение адиабаты в системе координат p-v (рис. 6) при постоянной теплоемкости (сv = const) для идеального газа
pvk const,
где k cp – показатель адиабаты. cv
Рис. 6
Зависимости между начальными и конечными параметрами процесса:
между p и v
p2 |
|
k |
|
||
|
v1 |
|
, |
(89) |
|
p1 |
|
||||
v2 |
|
|
|
||

38
между T и v
T2 v1 k 1,
T1 v2
между p и T
k 1
T2 p2 k .
T1 p1
Работу 1 кг газа находят по следующим формулам:
l |
1 |
|
(pv p v |
|
); |
||||||||
|
|
|
|||||||||||
|
|
k 1 |
1 1 |
|
|
|
2 |
2 |
|
|
|||
|
p1v1 |
|
|
v |
|
|
k 1 |
|
|||||
l |
|
|
1 |
|
|
; |
|||||||
|
|
|
|
|
|
|
|||||||
|
|
|
1 |
v |
|
|
|||||||
|
k 1 |
|
|
|
|
|
|||||||
|
|
|
|
|
|
2 |
|
|
|
||||
(90)
(91)
(92)
(93)
l |
|
|
R |
|
(T |
T ); |
|
|
(94) |
|||||||||
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
k 1 1 |
|
2 |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
p2 |
|
|
k 1 |
|
|
|
|||||
l |
p1v1 |
|
|
k |
|
|
|
|||||||||||
|
|
1 |
|
|
|
|
|
|
|
. |
|
(95) |
||||||
k 1 |
|
p |
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Для определения работы M кг газа нужно в формулах (92), (93) и (95) |
||||||||||||||||||
заменить удельный объем v общим объемом V газа. Тогда получим |
|
|||||||||||||||||
L |
|
1 |
|
(pV p V ); |
|
(96) |
||||||||||||
k 1 |
|
|||||||||||||||||
|
|
1 |
|
1 |
|
|
|
2 |
|
2 |
|
|
||||||
|
|
|
pV |
|
V |
1 |
k 1 |
|
|
|||||||||
|
|
|
1 1 |
|
|
|
|
|
|
|
|
|
||||||
L |
|
|
|
|
|
|
; |
(97) |
||||||||||
|
|
|
|
|
1 |
V2 |
|
|||||||||||
|
|
|
k 1 |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
k 1
L |
pV1 1 |
|
p2 |
k |
|
|
|
|
1 |
|
|
. |
(98) |
||
k 1 |
p |
||||||
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
Формула (94) для M кг газа примет следующий вид:
L |
MR |
(T |
T ). |
(99) |
|
||||
|
k 1 1 |
2 |
|
|
Уравнение первого закона для адиабатного процесса имеет вид

39
0 du dl,
следовательно,
du dl
или |
|
u l, |
(100) |
т. е. изменение внутренней энергии газа и работа адиабатного процесса равны по величине и противоположны по знаку.
Изменение внутренней энергии идеального газа в адиабатном процессе
может быть также выражено уравнением |
|
u cvm(t2 t1). |
(101) |
Задача
1 кг воздуха при начальной температуре t1 = 30 °С и давлении р1 = 0,1 МПа сжимается адиабатно до конечного давления р2 = 1 МПа.
Определить конечный объем, конечную температуру и затрачиваемую работу.
Решение
Из соотношения параметров в адиабатном процессе по уравнению (91)
находим
k 1
T2 p2 k .
T1 p1
Откуда
|
|
|
|
k 1 |
|
|
|
|
|
k |
|
T T |
|
p2 |
. |
||
|
|||||
2 1 |
|
p |
|
||
|
|
|
|||
|
1 |
||||
Принимая k = 1,4, получаем
0,4
T2 303 101,4 303 100,286 303N;
lgN lg100,286 0,286 lg10 0,286;
