
8441
.pdf
70
термодинамики для изобарного процесса имеет вид (26), в котором давление следует считать постоянным.
Если обозначить через Ср молярную теплоемкость газа процесса, протекающего при постоянном давлении, то согласно (25) выражение для притока тепла при изобарическом нагревании можно записать в виде:
δQ = |
m |
× C p × dT . |
(31) |
|
|||
|
μ |
|
|
Приравнивая правые части соотношений (30) и (31), получим:
mμ × C p × dT = dU + p × dV
и делением обеих частей равенства на m dT/μ преобразуем эту формулу к виду:
C p |
= |
μ |
|
dU |
+ |
μ |
× p × |
dV |
. |
(32) |
|
|
|
|
|||||||
|
|
m dT m dT |
|
|||||||
Значение производной dU/dT, входящей в правую часть полученного равенства, можно подставить из формулы (28). При вычислении dV/dT можно воспользоваться уравнением состояния pV=m/μ RT, но необходимо помнить, что процесс изобарический (p=const). В результате dV/dT=mR/(μp) и выражение (32) перейдет в следующее:
Сp=Cυ+R |
(33) |
Это соотношение называется уравнением Майера. Из него следует, что
теплоемкость при изобарическом нагревании всегда больше такого же процесса, происходящего при постоянном объеме (Ср>Cυ). Уравнение Майера справедливо в случае идеального газа, но вывод, что (Ср>Cυ) имеет место в случае любых газов и многих других систем. Он обязан способности тел расширяться при нагревании. При изохорном нагревании подведенная теплота идет только на увеличение внутренней энергии системы, а при изобарном процессе дополнительно затрачивается на работу, производимую телом при его расширении против сил внешнего давления. Поэтому для нагревания на один градус в изобарическом процессе требуется затратить большее количество тепла, а процесс имеет большую теплоемкость.
Таким образом, молярная теплоемкость Cр идеального газа в процессе изобарического нагревания тоже не зависит от термодинамических параметров:
|
С |
|
= C + R = |
i + 2 |
× R |
(34) |
||
|
p |
|
||||||
|
|
|
υ |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
и количество теплоты при изобарном нагревании от температуры T1 до T2 |
||||||||
может быть подсчитано как: |
|
|
|
|
|
|
|
|
Q = |
m |
× C × (T - T ) . |
|
|||||
μ |
|
|||||||
|
p |
|
|
p p |
1 |
|
|
|
|
|
|
|
|
|
|||
Изотермический процесс (T=const). Согласно первому началу термодинамики для любого процесса справедливо:
Q= U+A

71
Для идеального газа внутренняя энергия U$ определяется его температурой T, следовательно для изотермического процесса (поскольку T=0 и U=0) первое начало дает:
QT=A. |
(35) |
Таким образом, при изотермическом процессе вся подведенная теплота расходуется на совершение работы газа. При этом подвод тепла не приводит к изменению температуры газа. Теплоемкость газа в таком процессе бесконечна (CТ= ∞ ). Действительно, какое бы ни было большое количество тепла подведено к газу, изменить его температуру (даже на один градус) не удастся (поскольку
T=const).
Найдем работу расширения газа при изотермическом процессе. В соответствии с формулой (22)
V2 |
|
A = ∫ p × dV . |
(36) |
V1 |
|
Воспользовавшись уравнением состояния идеального газа найдем закон изменения давления:
p = m RT ,
μ V
который подставим под знак интеграла и вынесем постоянные за знак интегрирования (T=const):
|
|
|
|
A = |
m |
× R ×T ×V2 |
dV |
. |
|
|
||||
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
T |
μ |
V∫ |
V |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
После интегрирования будем иметь: |
|
|
|
|
||||||||||
A |
|
= |
m |
× R ×T × ln |
V2 |
|
, причем Q =A . |
(37) |
||||||
|
|
|
||||||||||||
T |
|
μ |
|
|
|
V1 |
|
|
|
T |
T |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|||
Во всех рассмотренных процессах мы рассматривали ситуацию, когда |
||||||||||||||
теплота подводится к |
газу |
(δQ ³ 0 ). |
В |
этом |
случае |
газ нагревается |
||||||||
( dU ³ 0, dT ³ 0 ), расширяется ( dV ³ 0,V2 ³ V1 ) и совершает работу (δA ³ 0 ). Однако полученные при этом формулы сохраняют свой вид и в обратном процессе сжатия и охлаждения газа. В последнем случае все перечисленные величины имеют ту же абсолютную величину, но обратный знак. Это означает, что для сжатия газа необходимо совершать работу внешними силами (над газом), а тепло газом отдается другим телам.
2.2.Адиабатический процесс
Вуравнение состояния газа входят три термодинамических параметра: p,V,T. Первое начало термодинамики также оперирует тремя величинами
δQ,dU, δА. Выше мы рассмотрели простейшие процессы, при которых один из термодинамических параметров остается постоянным. При этом, поскольку внутренняя энергия идеального газа определяется только температурой (U=m/μCυT), изотермический процесс является в то же время процессом постоянной внутренней энергии (dU=0). Аналогично этому можно сказать, что
72
изохорный процесс (V=const) является процессом без совершения работы (δA=0). Таким образом, из простейших процессов, описываемых названными шестью величинами, мы не рассмотрели только процесс, в котором δQ=0.
р
1
3
2
0
V
Рис. 10. График адиабатического процесса (пунктирная линия – изотерма)
Адиабатическим называется процесс, протекающий без теплообмена с окружающей средой. В таком процессе Q=0 , причем не только суммарное количество теплоты, полученное термодинамической системой, равно нулю, но и в каждом элементарном процессе выполняется условие δQ=0.
При этом процессе температура изменяется, несмотря на отсутствие теплопередачи. При адиабатном процессе теплоемкость газа, в соответствии с определением (33), равна нулю. Примером такого процесса может быть рассмотренный выше процесс сжатия или расширения газа в цилиндре под поршнем при условии, что стенки цилиндра и поршень имеют идеальную тепловую изоляцию. Данный процесс изображен в координатах {р,V} линией 1 -2 (рис.8), которая называется адиабатой. Поскольку при адиабатном процессе Q=0, первое начало термодинамики имеет вид:
DU+Aад=0 |
|
откуда |
|
Aад=-DU |
(38) |
Таким образом, в адиабатическом процессе работа, совершается газом против внешних сил только за счет уменьшения внутренней энергии газа. Поэтому при адиабатическом расширении температура газа уменьшается, а при адиабатическом сжатии - увеличивается. В результате этого адиабата в плоскости {р, V} проходит круче, чем изотерма (кривая 1-3 на рис.2.4). Эффект адиабатического изменения температуры широко используется в технике, например при сжижении газов.
В дифференциальной форме первое начало термодинамики для
адиабатического процесса имеет вид (δQ=0): |
|
dU+p×dV=0. |
(39) |
Заменяя в (39) dU выражением (28), и выразив р из уравнения состояния идеального газа, получим:
73
|
|
|
m |
C × dT + |
m |
|
|
RT × dV |
= 0 . |
|
|||||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
μ |
υ |
|
μ |
|
|
V |
|
|||||
|
|
|
|
|
|
|
|
|
|
||||||
Разделив левую и правую часть этого выражения на m×СυT/μ, получим: |
|||||||||||||||
|
|
|
|
|
dT |
+ |
|
R |
× |
dV |
= 0 . |
(40) |
|||
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
T |
Cυ |
|
|
V |
|
|||||
Для идеального газа Сυ - |
постоянная величина, |
поэтому легко |
|||||||||||||
проинтегрировать равенство (40) и получить: |
|
||||||||||||||
ln T + |
R |
× lnV = const , или ln(T ×V R / Cυ ) = const . |
|
||||||||||||
|
|
||||||||||||||
|
Cυ |
|
|
|
|
|
|
|
|
|
|
|
|
||
Логарифм какой-либо величины имеет постоянное значение, если под |
|||||||||||||||
знаком логарифма также стоит постоянная величина, поэтому |
|
||||||||||||||
|
|
|
|
T ×V R / Cυ |
= const . |
(41) |
|||||||||
Это соотношение дает связь термодинамических параметров при адиабатическом процессе.
Безразмерная величина g=CР/Cυ называется показателем адиабаты и определяется числом степеней свободы молекулы газа. Подставив значения CР
и Cυ из выражений (29) и (34), получим: |
|
|
|
|
|||||
|
|
|
γ = |
i + 2 |
1. |
(42) |
|||
|
|
|
|
||||||
|
|
|
|
|
i |
|
|
|
|
Через величину g удобно выразить показатель степени в уравнении (41). |
|||||||||
Действительно, из уравнения Майера (33) можно получить: R= CР-Cυ в |
|||||||||
результате показатель R/ Cυ можно преобразовать: |
|
||||||||
|
R |
= |
C p - Cυ |
= |
C p |
-1 = γ -1. |
|
||
|
Cυ |
|
|
|
|||||
|
|
Cυ |
Cυ |
|
|||||
Подставив это выражение в формулу (2.21), запишем ее компактнее: |
|
||||||||
|
|
|
T ×V γ −1 |
|
= const . |
(43) |
|||
Из этого выражения следует, что T=const/Vγ-1, а поскольку согласно (44) g- |
|||||||||
1>0, температура уменьшается при адиабатическом расширении и, наоборот, увеличивается при сжатии. Этот вывод мы уже сделали раньше, исходя из первого начала термодинамики, но выражение (43) позволяет вычислить изменение температуры количественно. Например, если в начальном состоянии объем V1 и температура $T1 известны, а также известен конечный объем V2, то можно записать уравнение (41) для начального и конечного состояний:
T ×V γ −11 |
= T |
×V γ −12 (const) . |
||
1 |
2 |
|
|
|
Из этого равенства найдем: |
|
|
|
γ −1 |
|
|
V |
||
T2 |
= T1 |
|
1 |
|
|
||||
× |
. |
|||
|
|
V2 |
|
|
Характер изменения давления при адиабатическом процессе также можно найти, исходя из (43), если заменить в нем температуру, воспользовавшись уравнением Клайперона - Менделеева (T=pVµ/mR). В результате получим:
= pV γ × μ / mR = const .
74
Поскольку m, µ, R являются постоянными для данной массы газа,
полученное выражение можно записать в виде: |
|
p.Vγ=const. |
(45) |
Это соотношение называется уравнением адиабаты Пуассона.
Работа при адиабатическом расширении газа равна площади под кривой процесса 1-2 (см. рис.10). Если известны начальная и конечная температуры процесса, то нет необходимости вычислять эту площадь - достаточно воспользоваться формулой (38) и выражением для внутренней энергии идеального газа. Это приведет нас к соотношению:
A |
= |
m |
C × (T - T ) . |
(46) |
|
μ |
|||||
ад |
|
υ 1 2 |
|
||
|
|
|
2.2.Второе начало термодинамики
Первое начало термодинамики устанавливает неизменность общего количества энергии в изолированной термодинамической системе и эквивалентность разных видов энергии при их превращениях в
термодинамических |
процессах. Но |
|
оно |
не |
накладывает |
никаких |
|||||
ограничений |
на направление процессов, |
происходящих |
в термодинамических |
||||||||
системах, не |
описывает условий, при которых возможно то или иное |
||||||||||
превращение энергии. Опыт показывает, |
что |
направления |
процессов не |
||||||||
равновероятны. |
|
Условия, |
характеризующие |
возможное направление |
|||||||
протекающих |
|
в |
термодинамических |
системах процессов, |
пределы |
||||||
возможного |
превращения теплоты в работу, |
определяются вторым началом |
|||||||||
термодинамики. |
|
|
|
|
|
|
|
|
|
|
|
Существует |
несколько |
формулировок |
второго |
начала |
термодинамики. |
||||||
Остановимся на двух из них. |
|
|
|
|
|
|
|
|
|||
1.Невозможен процесс, единственным конечным результатом которого является передача энергии в форме теплоты от холодного тела к горячему (формулировка Р.Клаузиуса).
2.Невозможен процесс, единственным результатом которого является отнятие от некоторого тела энергии в форме теплоты и превращение этой энергии в эквивалентную ей работу (формулировка В.Томсона).
Обе формулировки эквивалентны. Действительно, пусть существует процесс, с помощью которого можно было бы повысить температуру одного тела за счет охлаждения другого, при одинаковых начальных температурах обоих тел. Тогда, используя известные процессы, можно было бы превратить полученную разность температур в механическую энергию без каких-либо изменений в состоянии окружающей среды.
Таким образом, если бы могли происходить процессы, запрещенные вторым началом термодинамики, то за счет отбора энергии в форме теплоты,
например от мирового океана, |
имелся бы практически неисчерпаемый |
источник механической энергии. |
Подобное устройство было бы равноценно |
75
вечному двигателю. Поэтому второе начало термодинамики иногда формулируют так: <<Невозможен вечный двигатель второго рода>>.
2.2.1. Термодинамические циклы. Цикл Карно
Циклом, как указывалось ранее, называется такой процесс, в результате которого термодинамическая система возвращается в исходное состояние. Циклы или круговые процессы используются во всех тепловых машинах: двигателях внутреннего сгорания, газотурбинных установках, холодильниках и т.п. Изучение циклов является одной из основных задач термодинамики.
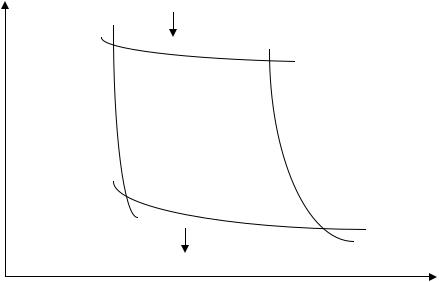
Рассмотрим произвольный цикл 1-а-2-b-1, изображенный на рис. 11. Его можно разбить на два процесса: 1-а-2 - процесс расширения и 2-b-1 - процесс сжатия. На участке 1-а-2 газ получает извне количество теплоты Q1 и в результате совершается работа и изменяется внутренняя энергия газа:
Q1=A1+(U2-U1). (*)
Работа A1 может быть найдена как площадь фигуры С1a2D.
p |
a |
1 |
2 |
b
V
C D
Рис. 11. Схема прямого цикла тепловой машины
На участке 2-б-1, наоборот, внешние силы совершают положительную работу A2 над газом, а работа газа – A 2 при этом отрицательна. Для того, чтобы суммарная работа газа AΣ, численно равная площади фигуры, ограниченной кривой 1a2b1, при выбранном направлении цикла была положительна (AΣ=A1- A2>0), процесс сжатия должен происходить при меньшем давлении и температуре. Это означает, что в ходе процесса сжатия газ необходимо охлаждать, отводя от него тепло другому телу. Другими словами количество теплоты, полученное газом при сжатии –Q 2 - величина отрицательная (Q2>0 - теплота, отданная газом). Таким образом, уравнение первого начала термодинамики для процесса 2-b-1 можно записать в виде:
-Q2=(U1-U2)-A2/ (**)
Из равенств (*) и (**) нетрудно получить
76
AΣ=A1-A2=Q1-Q2.
Это равенство выражает первое начало термодинамики для полного цикла.
Оно показывает, во-первых, что работа совершается вследствие превышения теплоты Q1, полученной газом при расширении, над теплотой Q, отданной им при сжатии. Во-вторых, можно сделать вывод, что при циклическом процессе невозможно все полученное от нагревателя тепло превратить в работу - необходимо <<поделиться>> частью полученного тепла с другим телом, которое является холодильником.
КПД тепловой машины. Цикл с положительной работой газа называется прямым циклом и лежит в основе всех тепловых двигателей. В них рабочее вещество (газ или пар) получает от нагревателя некоторую теплоту, а отдает холодильнику теплоту Q2. Отношение
η = |
A∑ |
= |
Q1 − Q2 |
= 1 − |
Q2 |
. |
(49) |
|
|
|
|||||
|
Q1 |
|
Q1 |
|
Q1 |
|
|
показывает, какая доля полученной от нагревателя теплоты превращена в работу и носит название коэффициента полезного действия тепловой машины. Видим, что эта величина не может быть большей 1.
КПД холодильной машины. Если при круговом процессе газ, расширяясь, совершает работу, меньшую той работы, которую производят внешние силы при его сжатии, т.е. A1<A2, то такой цикл носит название обратного цикла. Он может происходить, когда расширение газа происходит при более низкой температуре, чем сжатие. Легко видеть, что обход прямого цикла на графике в координатах {p,V} всегда происходит по часовой стрелке, а обратного цикла - против часовой стрелки.
Обратные циклы используются в холодильных установках. В холодильных установках рабочее тело отбирает тепло Q2 у тела с более низкой температурой, вызывая его охлаждение, и отдает телу с более высокой температурой теплоту Q1 (по аналогии с прямым циклом Q2<Q1). Этот процесс требует совершения работы внешними силами, AΣ=A2 – A 1. Первое начало термодинамики для обратного цикла запишется в виде:
Q2-Q1=A1-A2<0.
Поскольку цель холодильника - забрать тепло от охлаждаемого тела, а затраты при этом - совершаемая работа, эффективность холодильника можно характеризовать отношением Q2 к AΣ. Это отношение:
ε x |
= |
Q2 |
= |
Q2 |
. |
(50) |
A∑ |
|
|||||
|
|
|
Q1 − Q2 |
|
||
может превышать 1 и называется холодильным коэффициентом. Эффективность теплового насоса. Обратный цикл может использоваться
также для обогрева. При этом теплота Q2 забирается из внешней среды и в обогреваемое помещение (при более высокой температуре) передается теплота Q1. Обогрев производится за счет внешней силы и все соотношения между величинами в точности совпадают с величинами для холодильника. Однако, поскольку цель в данном случае другая - обогреть помещение, то <<польза>> определяется количеством теплоты, переданным помещению т.е.
77
величиной Q1, а затраты - по-прежнему состоят в совершении работы AΣ. Такое устройство называется тепловым насосом, а его эффективность определяется формулой:
Q1
p |
2 |
1
4 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
V |
|
|
|
|
Q2 |
|
|
|
|
|
|
|
|
Рис. 12 Цикл Карно |
||||
ε |
|
= |
Q1 |
= |
Q1 |
= 1 + |
Q2 |
1 |
x |
|
|
|
|||||
|
|
A∑ |
|
Q1 − Q2 |
|
Q1 − Q2 |
||
|
|
|
|
|
||||
и всегда превышает единицу. В связи с этим заметим, что старый анекдот о том, что некоторые народности Крайнего Севера греются в холодильниках, имеет под собой научную основу! Правда бытовой холодильник в этом случае следует разместить камерой на улицу (с открытой дверцей), а теплообменником (задняя часть холодильника) - внутрь помещения.
Цикл Карно. В термодинамике особое место занимает цикл, рассмотренный французским инженером Сади Карно в 1824 году. Цикл состоит из четырех обратимых процессов для идеального газа (см. рис. 12). Подразумевается, что имеется нагреватель с температурой T1 и холодильник с температурой T2.
Участок 1-2 - изотерма с температурой Т1, участок 2-3 - адиабата, участок 3-4 - изотерма с температурой Т2, участок 4-1 - адиабата (две изотермы и две адиабаты). Подвод тепла к рабочему телу осуществляется на участке 1-2, а отвод тепла - на участке 3-4. Карно доказал, что КПД этого цикла максимальный по сравнению со всеми другими возможными рабочими циклами в диапазоне температур между Т1 и Т2, а также не зависит от рода рабочего тела. Действительно, на участке 1-2 тело получает от нагревателя теплоту, которая вся (без потерь) идет на выполнение работы (см. 37) A1-2:
Q = A |
= |
m |
RT ln |
V2 |
. |
μ |
|
||||
1 1−2 |
|
1 |
V1 |
||
|
|
|
|
||

78
Значения объема V1 газа в точке 1 и V2 в момент окончания изотермического участка 1-2, как будет видно, не войдут в окончательное выражение для КПД.
Далее газ необходимо подготовить к стадии сжатия. Чтобы работа газа в цикле была положительной, необходимо понизить давление, охладив газ от температуры T1 до T2. Охлаждение осуществляется на участке 2-3 адиабатически. Этот процесс также оптимален, поскольку на этом участке не происходит потери тепловой энергии (δQ=0), а, кроме того, совершается дополнительная положительная работа A2-3 за счет уменьшения внутренней энергии газа (см. выражение 46)):
A2−3 = mμ Cυ × (T1 - T2 ) .
Таким образом, на стадии расширения газ совершил работу A1=A1-2+A2-3, получив теплоту Q1.
В процессе 3-4 изотермического сжатия газа от объема V3, который газ имел в конце адиабатического расширения, до некоторого объема V4 газ совершает работу A3-4, получив такое же по величине количество тепла Q3-4:
Q |
= A |
= |
m |
RT ln |
V4 |
. |
μ |
|
|||||
3−4 |
3−4 |
|
2 |
V3 |
||
|
|
|
|
|||
Поскольку V4<V3, логарифм в этой формуле, а вместе с ним и величины Q3- 4=A3-4 отрицательны, что означает не получение газом, а передачу тепла Q2=- Q3-4 холодильнику. Положительная работа также совершается внешними силами. Работа внешних сил на этом участке имеет наименьшее из возможных значение, поскольку газ все время имеет наименьшую температуру T2 (значит, и наименьшее давление).
Участок 4-1 необходим, чтобы вернуть газ в исходное состояние с температурой T1. Это нагревание в цикле Карно осуществляется также оптимальным образом - адиабатически (без затраты тепловой энергии). При этом работа A4--1<0, т.е. совершается над газом внешними силами.
Нетрудно убедиться, что A2-3=-A4-1 и работа газа на двух адиабатических участках компенсирует друг друга, так же как и изменение внутренней энергии (теплопередача на этих участках отсутствует). Поэтому основу цикла составляют два изотермических процесса, при первом из которых полученная теплота полностью превращается в работу, а второй происходит при наименьшей возможной температуре и давлении и соответствует наименьшей отрицательной работе газа и наименьшей теплоотдаче холодильнику. Эти доводы еще раз подчеркивают оптимальность цикла Карно.
Подставив величины Q1 и Q2 в общую формулу (49), вычислим КПД идеальной тепловой машины Карно:
η = T1 ln(V2 /V1 ) - T2 ln(V3 /V4 ) . T1 ln(V2 /V1 )
Найдем соотношения между объемами V1, V2, V3, V4. Напишем соотношение для адиабатного расширения газа от объема V2 до V3 и для адиабатического сжатия от объема V4 до V1 (см. формулу 41):

79
T1V2γ-1=T2V3γ-1,
T1V2γ-1=T2V4γ-1,
Поделим левую часть первого равенства на левую часть второго, а правую часть первого на правую часть второго (если делить два равных числа на равные числа, равенство сохранится):
V |
γ −1 |
= |
V |
γ −1 |
|
2 |
3 |
. |
|||
V |
γ −1 |
|
γ −1 |
||
1 |
V |
4 |
|
||
Это равенство можно упростить:
V2 = V3
V1 V4
и с его помощью исключить V2/V1 в выражении для η. Это приведет к сокращению одинаковых логарифмических множителей. Окончательно получим:
η = |
T1 − T2 |
. |
(47) |
|
|||
|
T1 |
|
|
Этот вывод можно сформулировать так: термический КПД цикла Карно не
зависит от природы рабочего тела и является только функцией температур нагревателя и холодильника. Это заключение получило название теоремы Карно.
Цикл Карно сыграл большую роль в развитии тепловых двигателей.
Соотношение (47) показывает |
путь повышения КПД реальных |
двигателей: |
|
повышение |
температуры рабочего тела и снижение |
температуры |
|
холодильника. |
Одновременно |
можно утверждать, что в рамках заданных Т1, |
|
Т2 тот цикл будет иметь больший КПД, который ближе к циклу Карно.
2.2.2. Понятие об энтропии
Помимо внутренней энергии в термодинамике большую роль играет еще одна функция состояния, которая получила название энтропия.
Величина Q/T называется приведенной теплотой. Приведенная теплота, полученная телом, равна количеству полученной теплоты, деленной на температуру тела. Уже говорилось, что подведенная к системе теплота при переходе от одного состояния в другое зависит от пути процесса, а при совершении цикла не равна нулю. С точки зрения математики это означает, что теплота не является полным дифференциалом.
В случае цикла Карно тело получает теплоту Q1 при изотермическом расширении с температурой T1 и отдает тепловую энергию Q2 при температуре T. Полная теплота, полученная телом за цикл Q1-Q2, не равна нулю. В то же время приведенное количество теплоты, полученное телом при расширении, равно Q1/T1, а при сжатии –Q 2/T1 (теплообмен газа с внешними телами
