
Лекция 6. Экспериментальные методы изучения механизмов химических реакций. Изотопные эффекты.
При изучении механизмов химических реакций основные наиболее важные результаты получают из результатов экспериментальных исследований. В данной лекции мы не будем изучать кинетические методы, хотя они совершенно необходимы при исследовании механизмов. Эти методы достаточно подробно рассматриваются в курсах физической химии и химической кинетики. По необходимости предельно кратко мы рассмотрим (скорее даже перечислим) наиболее важные их современных физических методов. При этом несколько подробнее остановимся на методах колебательной и вращательной спектроскопии, поскольку их данные важны для определения колебательной и вращательной составляющих статсуммы, вносящих существенный вклад в термодинамические функции исходных молекул.
Прежде чем излагать этот материал кратко обсудим первичный и вторичный изотопные эффекты, которые позволяют получить важную информацию о механизме реакции. Эти методы редко рассматриваются в традиционных курсах, читаемых в технологических вузах. В то же время изучение кинетического изотопного эффекта позволяет определить, разрывается или нет данная связь на стадии, определяющей скорость всего процесса.
Первичный кинетический изотопный эффект
Особым случаем использования кинетики для определения механизма является применение изотопов (почти всегда дейтерия или трития) путем введения их в положения, по которым осуществляется реакция. Силы, обусловливающие притяжение и отталкивание атомов в молекуле, имеющие электростатическую природу, не будут изменяться, если атом водорода в молекуле заменить на атом дейтерия, так как заряды ядер двух изотопов равны. Однако большая масса атома дейтерия приведет к меньшей величине нулевой энергии для дейтерированного соединения по сравнению с протиевым (водородным) соединением. Таким образом, энергия диссоциации связи в дейтерированном соединении будет примерно на 5 кДж-моль-1выше, чем в случае водородного соединения. В химических реакциях, в которых связь С—Dили С—Н по крайней мере частично разрывается, следует ожидать более высокой энергии активации для дейтерированного соединения (рис. 1), хотя любая остаточная нулевая энергия в переходном состоянии будет уменьшать разность междуEDиEH. Если в реакции скорость определяющая стадия включает ослабление связиX—Н, то замена этого водорода на дейтерий будет замедлять реакцию. Отношение констант скорости реакций недейтерированной и дейтерированной молекул,kH/kD, называют первичным изотопным эффектом изучаемой реакции. Максимальная величина первичного изотопного эффекта зависит от разности нулевых энергий; для реакций, проходящих по связям С—Н,kH/kDне может быть больше, чем ~7 при 25 °С, аkH/kTне больше, чем ~17, если не действуют другие факторы. Несколько большие величины возможны для связей N—Н и О—Н. Величина первичного изотопного эффекта, близкая максимальному значению, показывает, что данная связь почти полностью разрывается в переходном состоянии. Меньшие величины могут свидетельствовать в пользу частичного разрыва связи в переходном состоянии, в то время как близость изотопного эффекта к единице подразумевает, что связь либо не разрывается, либо это происходит в незначительной степени.
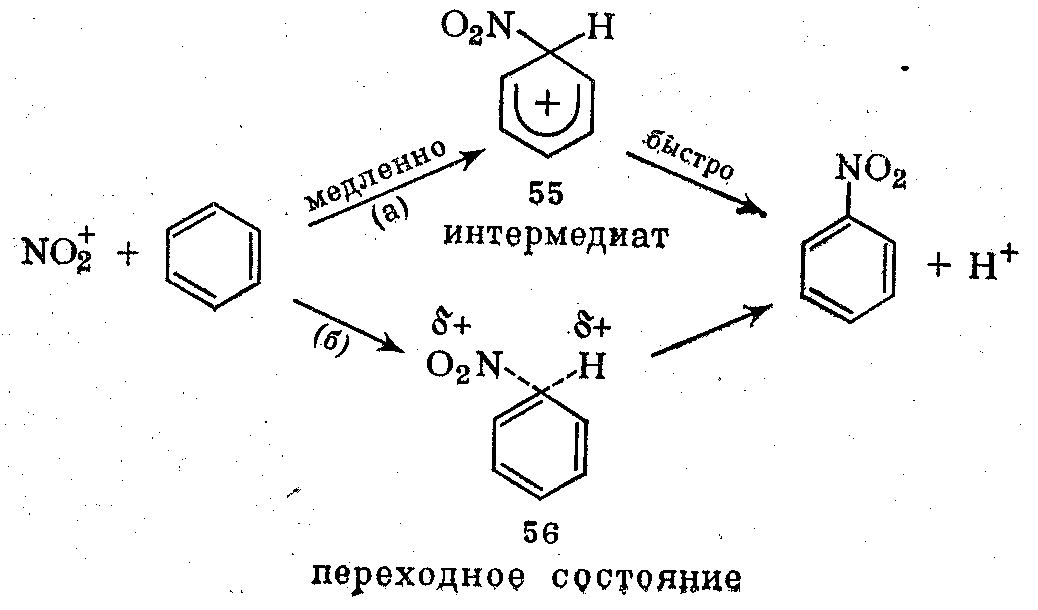
Использование этого метода подтвердило представление, что механизм электрофильного ароматического замещения [например, реакция нитрования (1)] включает присоединение иона нитрония к ароматическому ядру с образованием интермедиата Уэланда 55, а не является альтернативным синхронным процессом, проходящим через переходное состояние 56.

Рис. 1. Первичный изотопный эффект при замене водорода (протия) на дейтерий:
(а) — гомолитическая диссоциация алкана. Разность между энергиями диссоциации связей R—Н иR—Dобусловлена разностью нулевых энергий (преувеличена на рисунке); (б) —реакция, в которой нулевая энергия в переходном состоянии частично сохраняется.ED— EH—меньше, чем D(R–D)—D (R–H).
 (1)
(1)
В механизме (а) на медленной стадии, ведущей к образованию интермедиата Уэланда 55, не происходит значительного растяжения связи С—Н, тогда как по альтернативному механизму (б) связь С — Н в переходном состоянии 56 приблизительно наполовину разорвана. Согласно этому, для реакции, протекающей по механизму (б), в противоположность (а), можно ожидать заметного изотопного эффекта. Экспериментально бензол, содержащий очень небольшое количество трития, был превращен в моно- и динитро-бензолы. Обогащенных тритием продуктов нитрования с точностью эксперимента не обнаружено; из этого следует, что реакции проходят одинаково быстро как по положениям С—Т, так и по С—Н. Эти данные согласуются с механизмом (а) и не согласуются с механизмом (б).
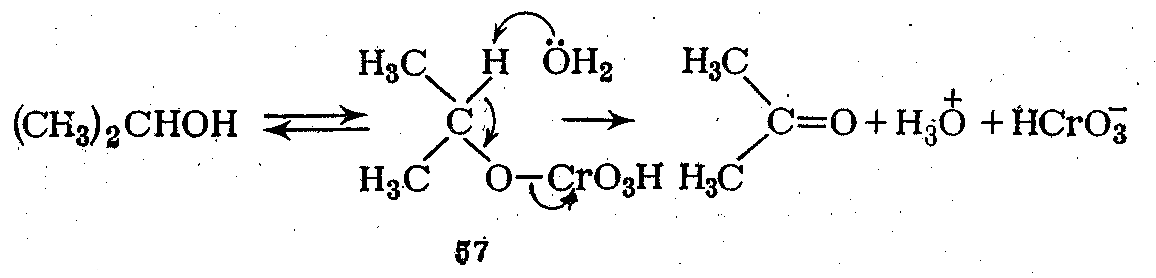
Примером реакции, в которой наблюдали изотопный эффект, является окисление спиртов под действиемCr(VI). В разбавленном кислотном растворе изопропанол окисляется ионом НСrО4–до ацетона со скоростью, пропорциональной произведению [Спирт][НСrО4–][Н+]. Если заменить изопропанол на дейтерированное соединение (СНз)2СDОН, то скорость окисления уменьшается в семь раз. Следовательно, связь углерод — дейтерий в дейтерированном изопропаноле должна быть в переходном состоянии частично разорвана. Наряду с другими данными этот результат подтверждает механизм (114), включающий равновесие между спиртом и хроматом 57. Вслед за этим протекает определяющий скорость отрыв водорода (или дейтерия) от 57 под действием основания с одновременным образованием двойной связи С=О и расщеплением связи хром—кислород, как показано в (114) [роль основания в уравнении (2) играет вода, однако им может быть при некоторых условиях один из атомов кислорода хроматиона] .
 (2)
(2)
Аналогичный изотопный эффект (около семи) наблюдался в случае катализируемого основанием бромирования ацетона, в котором, как полагают, скорость определяющей стадией является отрыв протона основанием [реакция (3)]:
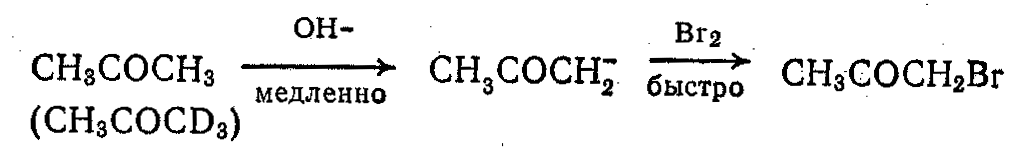 (3)
(3)
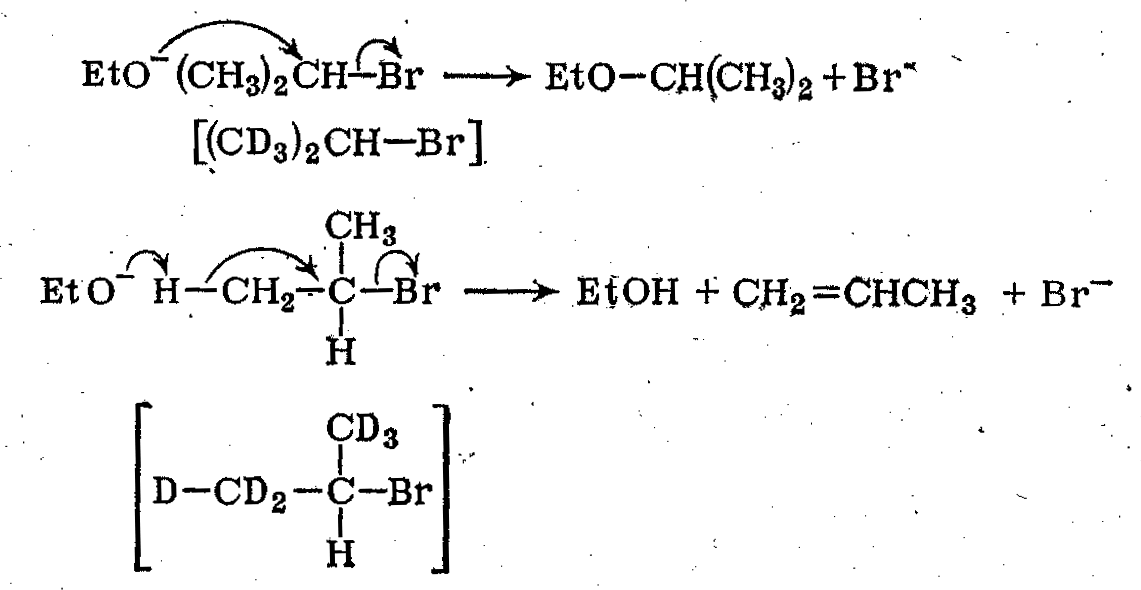
Введение дейтерия в метальные группы изопропилбромида не вызывает заметного изменения скорости его SN2-реакции (4) с этоксильным ионом, однако конкурентный процесс элиминирования (5) в случае дейтерированного соединения замедляется в 6.7 раза.
(4)
(5)
