
3856
.pdf11
Лабораторная работа № 2
Очистка хромсодержащих сточных вод реагентным методом
Цель работы: Ознакомиться с реагентным методом очистки сточных вод, содержащих хром.
АППАРАТУРА И РЕАКТИВЫ
1.Стеклянные конические колбы на 100 - 200, 500 мл.
2.Набор пипеток.
3.Электроплитка.
4.Бисульфит натрия (NaHSО3) и железный купорос (FeSO4*7Н2О).
5.Известь (СаО) - в порошке.
6.Фильтрованная бумага.
7.Стеклянные воронки диаметром 5 см.
8.Весы аналитические.
9.Реактивы для определения хрома:
-серная кислота, разбавленная (1:3) раствор,
-азотная кислота, разбавленная (1:1) раствор,
-нитрат серебра 2,5% -ный раствор,
-персульфат аммония,
-соль Мора 0,1N титрованный раствор,
-N - фенилантраниловая кислота.
ОБЩАЯЧАСТЬ
На некоторых химических производствах, на многих машиностроительных, станкостроительных, автомобильных и авиационных заводах, а также на обогатительных фабриках цветной металлургии, в красильных цехах текстильных предприятий, на кожевенных заводах, где производят хромовое дубление в промышленную канализацию сбрасываются сточные воды, загрязненные хромом.
Всанитарных нормах предельно допустимая концентрация шестивалентного хрома - хром (VI) - в воде водоемов - отсутствие, трехвалентного хрома (III) - 0,5 мг/л - для водоемов культурно-бытового водопользования, и 0,001 мг/л - для водоемов рыбохозяйствеиного назначения.
Врастворе хром может встречаться в виде трехзарядного катиона или в виде анионов хромат или бихромат-ионов.
Хром (III) устойчив и в обычных условиях нельзя предполагать окисление его до шестивалентного. В растворенном состоянии хром (III) находится только
вкислой среде. В нейтральной и щелочной средах он гидролизуется с выделением гидроокиси хрома (III). Комплексообразующие вещества препятствуют гидролизу.
Хром (VI) может встречаться в щелочных растворах в виде хроматионов, в кислых растворах - в виде бихромат-ионов. Если же восстановители

12
присутствуют, то происходит восстановление шестивалентного хрома до трехвалентного. В твердой фазе находится преимущественно гидроокись хрома (III).
Воснове химического метода очистки сточных вод от шестивалентного хрома лежит реакция восстановления его до трехвалентного, который затем может быть выделен в осадок в виде нерастворимой гидроокиси.
Вкачестве восстановителя могут быть применены следующие реагенты: сернистый натрий (сульфид) – Na 2S;
сульфит натрия – Na 2SО3; бисульфит натрия - NaНSО3; железный купорос – FeSO 4*7H2O; сернистый газ – S О2 и др.
Реакция восстановления шестивалентного хрома до трехвалентного идет
по следующим уравнениям: |
|
1) с сернистым натрием |
|
Cr2O72- + 3S2- + 14H+ → 2Cr3+ + 3S0 + 7H2O |
(1) |
2) с бисульфитом натрия
Cr2O72- + 3НSО3- + 5H+ → 2Cr3+ + 3SО4-2 + 4H2O (2)
3) с железным купоросом
Cr2O72- + 6Fe2+ + 14H+ → 2Cr3+ + 3Fe3+ + 7H2O (3)
Ввиду того, что сульфит натрия в водных растворах сильно гидролизуется с образованием ОН- -ионов, для выделения гидроокиси трехвалентного хрома в осадок нет необходимости в специальном добавлении извести, так как
образовавшиеся ОН--ионы обеспечивают осаждение Сг(ОН)3. S2- + 2H2O → H2S + 2OH-
Для осаждения трехвалентного хрома, полученного в результате реакций 2 и 3, к раствору добавляется известковое молоко (или любая другая
щелочь).
Сr3+ + 3OH- → Cr(OH)3↓
Из уравнений (1) – (3) видно, что реакция восстановления шестивалентного хрома до трехвалентного протекает в кислой среде, т.е. в присутствии ионов Н+. Поэтому для успешного прохождения реакции сточная вода должна быть подкислена до рН =2 - 4.
Такое подкисление обычно выполняется присоединением к хромсодержащим сточным водам кислых стоков или технической H2SO4. Поэтому кислые и хромсодержащие сточные воды рекомендуется объединять в общую канализационную нитку.
По реакциям 1 -3 легко подсчитать теоретическую дозу реагента. Для сернистого натрия:
3 × (23 × 2 + 32) =
2,24 (реакция 1)
52 × 2
13
где 52 - атомный вес хрома; 23 - атомный вес натрия; 32 - атомный вес серы.
Следовательно, для восстановления 1 вес. ед. шестивалентного хрома до трехвалентного необходимо 2,24 вес. ед. безводного 100% -ного сернистого натрия. Для лучшего эффекта восстановления расход следует увеличить в
1,25 раза.
Для бисульфита натрия: |
|
|||
|
3× (23× 2 +1+ 32 +16 ×3) |
= 3,0 |
(реакция 2) |
|
52 × 2 |
||||
|
|
|||
где 23 - атомный вес натрия; 1 - атомный вес водорода; 32 - атомный вес серы; 16 - атомный вес кислорода.
На восстановление 1 вес. ед. шестивалентного хрома до трехвалентного необходимо 3 вес. ед. безводного бисульфита натрия, причем реакция идет полнее при увеличении этой дозы в 1,75 - 2,5 раза.
Для железного купороса:
6 × (56 + 32 +16 × |
4 +14 ×1 +16 × 7) |
= 16,0 |
(реакция 3) |
|
52 |
× 2 |
|||
|
|
где 56 - атомный вес железа.
Таким образом, для восстановления одной весовой единицы шестивалентного хрома до трехвалентного требуется 16 весовых частей семиводного железного купороса (FeSO4*7H2O). Для создания лучших условий протекания реакций следует эту теоретическую дозу увеличить в 1,25 раза.
Продолжительность обработки хромсодержащей сточной воды восстановителем принимается 30 мин.
После перевода всего имеющегося в растворе хрома в трехвалентный, последний осаждают в виде гидроокиси Cr(OH)3 любой щелочью. Количество щелочи добавляется такое, чтобы рН после нейтрализации был равен 8 - 9. При избытке щелочи, при рН больше 9 идет обратный процесс, т.е. переход трехвалентного хрома в шестивалентный.
СОСТАВ РАБОТЫ И ПОРЯДОК ЕЕ ПРОВЕДЕНИЯ
1.Определить концентрацию шестивалентного хрома в сточной воде.
2.Определить общую концентрацию хрома в сточной воде.
3.Рассчитать дозу реагента (бисульфита натрия и железного купороса) для восстановления шестивалентного хрома в сточной воде до трехвалентного (пересчитать на 100 мл сточной воды).
4.Налить в две колбы по 100 мл сточной воды.

14
5.Отвесить необходимое количество на аналитических весах NaНSО3 и FeSO4*7H2O и внести восстановители в отдельные колбы со сточной водой. Перемешать содержимое колб и оставить на 30 мин.
6.Рассчитать дозу извести (СаО) для осаждения хрома (III). Для этого необходимо рН сточной воды довести до 8 - 9.
7.Отвесить нужное количество извести и внести в колбу с железным купоросом через 30 мин после внесения восстановителя. Содержимое перемешать, дать осесть образовавшейся гидроокиси Cr(OH)3.
8.Профильтровать воду из обеих колб и проверить содержание шестивалентного хрома в очищенной сточной воде.
9.Подсчитать эффект очистки.
МЕТОДИКАОПРЕДЕЛЕНИЯХРОМАВСТОЧНОЙВОДЕ
СУЩНОСТЬ МЕТОДА
Ионы хрома (III) окисляют до бихромат-ионов в кислой среде
персульфатом аммония.
2Cr3+ + ЗS2О82- + 7Н2O = Сr2O72- + 6SO42- + 14Н+
Бихромат-ионы титруют солью железа (II) в присутствии окислительно-
восстановительного индикатора.
Сr2O72- + 6Fe2+ + 14Н+ = 2Cr3+ + 6Fe3+ + 7Н2O.
Так находят суммарное содержимое хрома (III) и хрома (VI).
В другой порции пробы титрование солью железа (II) проводят без предварительного окисления персульфатом. Это титрование показывает содержание хрома (VI). По разнице между результатами обоих титрований рассчитывают содержание хрома (III).
ХОДОПРЕДЕЛЕНИЯ
Определение общего содержания хрома в сточной воде
В коническую колбу помещают 5 - 50 мл анализируемой сточной воды (в зависимости от содержания в ней хрома), пробу разбавляют дистиллированной водой до 300 мл, прибавляют 15 мл серной кислоты, 3 мл азотной кислоты, 0,2 мл раствора нитрата серебра, вносят 0,5 г персульфата аммония, нагревают смесь до кипения и кипятят 10 мин.
Весь хром, находящийся в анализируемой воде, переходит в хром (VI), и раствор окрашивается в желтый цвет. Раствор охлаждают до комнатной температуры, приливают 10-15 капель раствора N-фенилантраниловой кислоты и титруют солью Мора до перехода окраски индикатора.
Расчет.
Содержание хрома (X) вычисляют по формуле (в мг/л):
= a × K ×1,73 ×1000
X
V
где а - объем 0,1 N раствора соли Мора, израсходованного на титрование, мл;
15
К - поправочный коэффициент для приведения концентрации раствора соли Мора точно к 0,1 N;
1,73 - число миллиграммов хрома, эквивалентное 1 мл 0,1 N раствора соли Мора;
V- объем анализируемой сточной воды, мл.
ОПРЕДЕЛЕНИЕ ХРОМА (VI)
Определение проводят так же, как и определение общего содержания, но без предварительного окисления хрома персульфатом аммония. По разнице между результатами обоих определений вычисляют содержание хрома (III) в исследуемой сточной воде.
КОНТРОЛЬНЫЕВОПРОСЫ
1.В чем состоит реагентный метод очистки хромсодержащих сточных вод?
2.Почему не требуется подщелачивание при использовании в качестве восстановителя бисульфита натрия (NaHSO3)?
3.Преимущества применения в качестве восстановителя бисульфита натрия по сравнению с железным купоросом?
Лабораторная работа № 3
Очистка хромсодержащих сточных вод методом электрокоагуляции
Цель работы: Изучить влияние основных электротехнических и технологических параметров процесса электрокоагуляции на эффективность очистки сточных вод от соединений шестивалентного хрома.
АППАРАТУРА И РЕАКТИВЫ
1.Электрокоагулятор.
2.Выпрямитель.
3.Мерные цилиндры.
4.Секундомер.
ОБЩАЯ ЧАСТЬ
В практике очистки сточных вод метод электрокоагуляции может быть использован для решения следующих задач:
-удаления дисперсных загрязнений за счет изменения их агрегативного состояния под действием ионов металлов, поступающих в раствор в процессе анодного растворения металлов;
-выделения из сточных вод ионов тяжелых металлов (Ni2+, Zn2+ , Си2+ и др.) путем перевода их в нерастворимые гидроокиси и последующего осаждения в отстойных сооружениях;

16
- восстановления ионов шестивалентного хрома до трехвалентного ионами двухвалентного железа.
Метод электровосстановления ионов шестивалентного хрома ионами двухвалентного железа в практике очистки сточных вод (особенно цехов гальванопокрытий) находит в последнее время достаточно широкое использование.
Очистка сточных вод от соединений шестивалентного хрома основана на восстановлении бихромат - и хромат-ионов до трехвалентных соединений ионами двухвалентного железа, образующимися в процессе анодного растворения стальных электродов с последующим удалением их из обрабатываемой жидкости
ввиде нерастворимых гидроокисей.
Вобщем виде процесс электрохимического восстановления ионами Fe2+ шестивалентного хрома можно представить следующим образом:
Cr2O72- + 6Fe2+ + 14H+ → 6Fe3+ + 2Сr3+ + 7Н2O,
H2O → H+ + OH-
Образование гидроокисей идет по уравнению:
Cr3+ + OH-→ Cr(OH)3↓,
Fe3+ + OH- → Fe(OH)3 ↓.
Кроме того, может происходить химическое восстановление на катоде:
Cr2O72- + 14H+ + 6ё → 2Cr3+ + 7Н20,
Cr2O72- +3ё + 4Н2O → Cr(OH)3↓,+ 5OН-.
В соответствии с приведенными уравнениями, на восстановление 1 вес. ед. шестивалентного хрома требуется 3,22 вес. части железа. Теоретический расход электричества на восстановление весовой единицы хрома составляет:
0,96*3,22 = 3,09 А-ч
Таким образом, зная концентрацию ионов шестивалентного хрома в исходной сточной жидкости, можно определить требуемое количество электричества для полного восстановления хрома ионами двухвалентного железа, поступившими в раствор в процессе анодного растворения металла. Количество
железа, выделившегося в процессе электролиза, можно определить по формуле:
m =η × I × A × t F × n
где А - атомный вес вещества; I - сила тока, А; t – продолжительность электролиза, с; F- число Фарадея; п - валентность вещества; η - выход металла по току, %.
Понятие «выход вещества по току», вводится для характеристики степени использования тока, протекающего между электродами. Определяется как отношение величины тока, расходуемого на основную реакцию, к общему количеству тока.
η = Iн ×100,% Iобщ
Величина выхода по току обычно выражается в долях единицы или в процентах.

17
Теоретическое количество выделившегося при электролизе вещества определяется по числу Фарадея. Для выделения грамм-эквивалента любого вещества требуется пропустить примерно 26,8 А-ч электричества.
Величина силы тока на анодах определяется из выражения
I = ia × Sa , A
где ia - плотность тока, A/дм2; Sa - рабочая поверхность анодов, дм2.
Определение необходимой величины анодного тока для восстановления шестивалентного хрома до трехвалентного может быть произведено по формуле:
I = Q = V × C0 ×11120 16 t t
где Q - общее количество электричества, которое необходимо пропустить через электролизер, в кулонах;
V - объем обрабатываемой жидкости, м3;
Со - исходная концентрация Сr6+ в сточных водах, г/м3; t - продолжительность обработки, с;
11120 - теоретическое значение электричества, необходимое для восстановления одного грамма Сr6+.
Важной характеристикой процесса электрокоагуляции, характеризующей экономические показатели метода, являются удельные затраты электроэнергии, которые определяются по формуле (в кВт-ч/м3)
Wуд = I ×U ×× t
1000 V
где U - напряжение между электродами, В.
Таким образом, эффективность процесса очистки сточных вод электрокоагуляцией зависит от количества подведенного электричества (плотности тока на электродах, продолжительности электрообработки), а удельные затраты электроэнергии - от напряжения электролиза (электропроводимости системы, расстояния между электродами), продолжительности обработки и количества электричества (определяется из исходной концентрации хрома).
В задачу настоящей работы входит выявление эффективности электрокоагуляционной очистки сточных вод от хрома в зависимости от продолжительности обработки при различных плотностях тока на аноде, и оценка метода электрокоагуляции с точки зрения электрозатрат на обработку жидкости.
МЕТОДИКАПРОВЕДЕНИЯРАБОТЫ
Опытная установка состоит из модели электрокоагулятора 1, (рис. 1), представляющего прямоугольный в плане сосуд из органического стекла, в прорези боковых стенок которого установлены пластинчатые электроды из низкоуглеродистой стали (железные) (рис. 2), электроды присоединены к плюсу (анод) и к минусу (катод) выпрямителя 3. Для опорожнения электрокоагулятора в нижней части его установлен сливной патрубок 4. Приготовление исходной рабочей жидкости производится в резервуаре 5, перемешивание жидкости
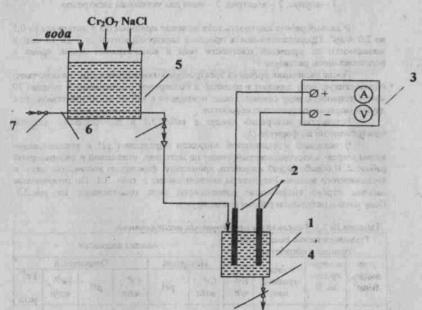
18
осуществляется воздухом, при помощи перфорированного воздухопровода 6. Установка имеет запорную арматуру 7-9. Установка работает следующим образом. Приготовленный в резервуаре 5 рабочий раствор перемешивается и заливается в электрокоагулятор 1, включается выпрямитель 3 и в течение заранее заданного промежутка времени происходит обработка жидкости. Выпрямитель отключают, обработанный раствор сливают и отстаивают. Опыт закончен. При необходимости его повторяют в той же последовательности.
ХОДВЫПОЛНЕНИЯРАБОТЫ
Резервуар 5 заполняют до определенного объема водопроводной водой, вводят концентрированный раствор хромового ангидрита (из расчета получения в исходной воде концентрации ионов Сr6+, равной 30 - 50 мг/л). Для повышения электропроводности жидкости в резервуар можно ввести 0,5 - 1,0 г/л NaCl. Приготовленную смесь перемешивают в течение 2 – 5 мин при помощи воздуха, открыв вентиль 7. После перемешивания подачу воздуха в резервуар прекращают. Рабочий раствор готов.
Подготавливают к работе электрокоагулятор. В боковые пазы электрокоагулятора на определенном расстоянии параллельно друг другу устанавливаются электроды. Расстояние между ними варьирует от 1 до 4 см. Присоединяют электроды к плюсу (+) и минусу (-) выпрямителя. Определяют объем электрокоагулятора (с учетом объема занимаемого электродами) и рабочую площадь (часть электрода, погруженную в жидкость) анода. Заполняют электрокоагулятор приготовленным раствором до рабочей отметки (вентиль 8 открывают), включают выпрямитель. Устанавливают рабочую величину тока процесса (исходя из принятой плотности тока на аноде), измеряют по секундомеру продолжительность работы электрокоагулятора.
Рис. 1. Схема электрокоагуляционной установки:
1 - электрокоагулятор; 2 - электроды; 3 - выпрямитель; 4 - трубопровод опорожнения; 5 - резервуар исходной жидкости; 6 - воздухопровод; 7, 8, 9 - запорная арматура.
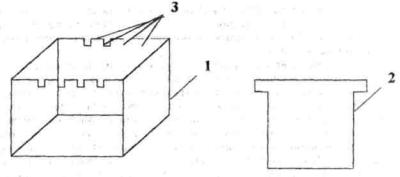
19
Рис. 2. Фрагменты коагулятора:
1 - корпус; 2 - электрод; 3 - пазы для установки электродов
В данной работе плотность тока на аноде принимается в интервале от 0,5 до 2,0 A/дм2. Продолжительность процесса электрообработки от 1 до 10 мин, в зависимости от принятой плотности тока и концентрации ионов хрома в подготовленном растворе.
После окончания процесса электрообработки выпрямитель 3 отключают, обработанную воду сливают в цилиндр и подвергают отстаиванию в течение 30 мин. Отстоянную воду сливают, опыт повторяют в той же последовательности с другой продолжительностью обработки.
Результаты измерений сводят в табл. 1 и подсчитывают затраты электроэнергии по формуле (5).
В исходной и очищенной жидкости определяют рН и концентрацию хрома в трех- и шестивалентной форме по методике, описанной в лабораторной работе 2. В обработанной жидкости, кроме того, фиксируют количество двух- и трехвалентого железа. Результаты анализа сводят в табл. 1. По полученным данным строят графические зависимости (см. рис. 3). Полученные результаты работы анализируют.
Таблица1. Результатыпроведенныхисследований
Технологическиепоказатели |
|
|
Анализжидкости |
|
|
||||||
|
процессаобработки |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
||
а на |
иэлек- |
t элек- |
Wуд |
Исходной |
|
|
Очищенной |
|
|||
аноде, |
тролиза, |
тролиза, |
Вт-ч/л |
Cr6+, |
рН |
|
Cr6+, |
рН |
|
Fe2+, |
Fe3+, |
А/дм2 |
В |
мин. |
|
мг/л |
|
|
мг/л |
|
|
мг/л |
мг/л |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
КОНТРОЛЬНЫЕВОПРОСЫ
1. Какие электротехнические параметры оказывают влияние на эффективность процесса очистки от хрома?
2.От чего зависят затраты электроэнергии при реализации метода электрокоагуляции при очистке сточных вод от хрома?
3.Оцените эффективность электрохимического метода очистки сточных вод от шестивалентного хрома.
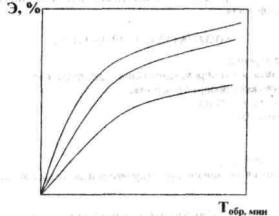
20
Рис. 3. График зависимости эффективности удаления хрома от продолжительности обработки
Лабораторная работа № 4
Очистка сточных вод от фенола методом экстракции
Цель работы. Определить эффективность очистки сточных вод от фенола в зависимости от числа экстракции. Установить влияние величины рН на эффект извлечения фенола.
АППАРАТУРА И РЕАКТИВЫ
1.Делительные воронки.
2.Стандартная шкала для определения концентрации фенола.
3.Колориметрические пробирки в штативе.
4.Мерный цилиндр на 100 мл.
5.Колбы емкостью 250 мл.
6.Пипетки.
7.Экстрагент.
8.2% раствор NaOH.
9.Индикатор пара-нитро-анилин диазотированный свежеприготовленный.
ОБЩИЕ СВЕДЕНИЯ О ФЕНОЛАХ
Фенолы – многочисленный класс ароматических соединений, содержащих гидроксильную группу, непосредственно связанную с ароматическим ядром. В зависимости от количества гидроксильных групп различают фенолы:
1)одноатомные - фенол (карболовая кислота), крезолы (окситолуолы или метилфенолы), ксиленолы (диметилфенолы), этилфенолы, пропилфенолы и др.;
2)двуатомные - пирокатехин (1,2-диоксибензол), резорцин (1,3 -диок- сибензол), гидрохинон (1,4-диоксибензол);
3)трехатомные - пирогаллол (1,23-триоксибензол), флороглюции (1,3,5- триоксибензол), оксигидрохинон (1,2,4- триоксибензол).
К классу фенолов относятся и такие ароматические соединения, которые
