
3805
.pdf
используется оптические системы для монохроматизации излучения, падающего на образец. Фотоколориметры обычно снабжаются набором светофильтров, с помощью которых можно выделить определенный интервал длин волн. Светофильтр для работы выбирают так, чтобы длина волны, соответствующая максимуму коэффициента пропускания светофильтра, приходилась на участок спектра поглощения анализируемого раствора, где светопоглощение максимально и слабо зависит от λ.
В фотометрии обычно измеряется не абсолютное значение светопоглощения, а разность оптических плотностей исследуемого раствора и раствора, светопоглощение которого принято за нуль (раствор сравнения). Кювета, в которую помещают исследуемый раствор, называется рабочей, а кюветы для раствора сравнения – кюветой сравнения. Обе кюветы должны быть по возможности идентичны. Основное требование к кюветам – прозрачность в области спектра, в которой ведется измерение оптической плотности. Для работы в видимой области кюветы изготовляют из стекла. В ультрафиолетовой области стекло непригодно: кюветы делают из кварца. По форме кюветы бывают прямоугольными и цилиндрическими (рис.5). Относительная ошибка определения концентрации раствора различна при работе на разных участках шкалы фотоколориметра и достигает минимума при значении оптической плотности около 0,4343. Поэтому рекомендуется работать вблизи указанного значения оптической плотности, выбирая кюветы с подходящей длиной оптического пути.
Рисунок 5. Кюветы для фотометрических измерений
Применение различных светофильтров с узкими спектральными диапазонами пропускаемого света позволяет определить по отдельности концентрации разных компонентов одного и того же раствора (рис.6). Измерения для каждого из компонентов производятся при длинах волн того участка спектра, который наиболее сильно поглощается данным веществом в
11

растворе и слабо – другими компонентами раствора. Если анализируемое вещество не поглощает свет в рабочем диапазоне фотоколориметра, часто используют реагенты, образующие с таким веществом окрашенное соединение. Тогда концентрацию определяют, измеряя светопоглощение полученного соединения.
Рисунок 6. Светофильтры и дифракционная решетка.
Фотоэлектроколориметры имеют простую конструкцию и пригодны для измерений в видимой и ближней (до 300 нм) УФ – областях. Их используют чаще всего для проведения серийных определений концентрацией веществ. Оптические детали этих приборов изготовлены из стекла или просветленного стекла. Прибор предназначен для измерения коэффициентов пропускания Т и светопоглощения А растворов в отдельных участках диапазона длин волн 315-750 нм, а также для излучения дисперсных систем методов турбидиметрии. Колориметр позволяет определять коэффициенты пропускания в пределах от 100 до 5 % (оптическую плотность от 0 до 1,3) с погрешностью измерения не более 1 %.
Сигналы от фотоэлемента или фотодиода после усиления поступают на микроамперметр, шкала которого проградуирована в величинах коэффициента светопропускания и оптической плотности. Схема усилителя имеет дискретный переключатель типа фотоприемника и чувствительности. На переднюю панель также выведены ручка смены кюветы и рукоятка переключения светофильтров. Принцип измерения светопоглощения состоит в том, что на фотоприемник направляются поочередно различные световые потоки: полный и прошедший через исследуемую среду, и определяется отношение этих потоков.
В спектрофотометрии для измерения светопоглощения используются более сложные приборы – спектрофотометры. В отличие от фотоколориметров, для выделения излучения в узком интервале длин волн в
12
спектрофотометрах используются специальные монохроматоры, в конструкцию которых входят призмы или дифракционные решетки (рис.6). Современные спектрофотометры позволяют автоматически изменять длину волны в ходе измерения фотопоглощения, записывая спектр поглощения исследуемого образца в широком диапазоне значений λ. Спектр может регистрироваться с помощью самописца, печатающего устройства или записываться в цифровом виде, доступном для последующей компьютерной обработки. Стандартные спектрофотометры обычно работают в интервале 200 – 900 нм или 2,5 – 25 µм (400 – 4000 см-1). В первом случае рабочая область включает УФ и видимый диапазон. Оптические детали таких спектрофотометров и кюветы для них изготавливают из кварца, который прозрачен в УФ диапазону. Для исследования ИК спектров оптические окна спектрометров и кювет изготавливают из кристаллов неорганических солей (KBr, NaCl, LiF, CaF2), а также германия, кремния, полиэтилена. Для исследования ИК спектров часто образец в виде суспензии в специальном масле помещают между плоскими пластинками, изготовленными из KBr, или с помощью пресса готовят таблетки из смеси анализируемого образца и KBr.
Спектрофотометрия широко используется для получения и исследования электронных и ИК спектров, которые содержат информацию о составе, а также молекулярном и электронном строении химических соединений. С другой стороны, спектрофотометры позволяют измерять светопоглощение в очень узком диапазоне длин волн падающего излучения, причем не только в видимой, ни и в УФ и ИК областях, что недоступно при работе с фотоколориметрами. Это бывает необходимо при качественном и количественном анализе многокомпонентных смесей и соединений с полосами поглощения малой ширины. В частности, спектрофотометрия в УФ области применяется при определении содержания нитратов в питьевой и природной воде в соответствии с международным стандартом ISO 7890.
Методики определения веществ в природных, питьевых, сточных водах.
Фотометрические методы анализа благодаря низкому пределу обнаружения используются для определения концентраций компонентов природных, питьевых, сточных вод с низкими ПДК. Например, в питьевой воде фотометрическим методом определяют содержание алюминия, бора, кадмия, молибдена, мышьяка, никеля, нитритов, свинца, железа, марганца, меди, цинка, хрома (6), цианидов, поверхностно – активных веществ (ПАВ),
13
фенолов, нормируемых по их влиянию на токсикологические и органолептические свойства воды.
ЛАБОРАТОРНАЯ РАБОТА № 1
Определение содержания железа (III) в природных водах в виде роданидного комплекса
Предельно допустимая концентрация общего железа в воде водоемов и в питьевой воде 0,3 мг/л. Лимитирующий показатель вредности органолептический.
Сущность метода
Ионы железа (III) образуют с роданид – ионами в кислой среде ряд комплексных ионов, имеющих разный цвет: Fe3+ + n SCN- = [Fe(SCN)n]3-n, где n – число ионов роданида, связанных в железороданидный комплекс; n может меняться от 1 до 6.
Состав окрашенного железороданидного комплекса изменяется в зависимости от концентрации реактива. Поэтому при проведении реакции необходимо соблюдать строго определенные соотношения между концентрациями исследуемого раствора и реактива. С этой целью к раствору соли железа(III) добавляется постоянный избыток роданида аммония (или калия) в количестве 0,14 моль/л. Такому избытку роданид – ионов соответствует преимущественное образование комплексного тетрароданоферрат – иона [Fe(SCN)4]- , окрашенного в темно – красный цвет:
Fe3+ + 4NH4SCN = NH4[Fe(SCN)4] + 3NH4+
тетрароданоферрат (III) аммония
Концентрацию ионов железа (III) рассчитывают по величине светопоглощения раствора комплекса при длине волны 480 нм методом градуировочного графика.
Предел обнаружения железа (III) 0,05 мг/л. Диапазон измеряемых концентраций без разбавления пробы 0,05 – 2 мг/л. Проведению анализа мешают медь, кобальт, висмут в концентрациях более 5 мг/л, а также высокие концентрации хлоридов. Последние образуют с железом (III) бесцветный комплекс, ослабляющий окраску роданидного комплекса.
14
Влияние хлоридов значительно снижается при введении избытка роданид – ионов.
Приборы и реактивы
1.Фотометр.
2.Мерные колбы на 100 мл.
3.Пипетки, градуированные на 1, 5, 10, 25 мл.
4.Стандартный основной раствор соли железа (III): навеску 0,8636 г
железо – аммонийных квасцов (х.ч.) растворяют в воде, предварительно подкисленный 5 мл серной кислоты (ρ = 1,84 г/см3) и доводят объем раствора до 1 л. Концентрация железа (III) в основном стандартном растворе 0,1 мг/мл. Рабочий стандартный раствор готовят в день проведения анализа
разбавлением основного раствора в 10 раз (концентрация раствора 0,01 мг
Fe3+/мл).
5.Азотная кислота, разбавленная 1:1.
6.Роданид аммония или калия 10% - ный раствор.
Ход определения
Выбор светофильтра или длины волны для фотометрирования
Подходящую длину волны, или узкий интервал длин волн, выбирают на основании кривых светопоглощения. Для их построения готовят два раствора соли железа (III) различной концентрации: в две мерные колбы на 100 мл вливают 2 и 8 мл рабочего раствора соли железа, 2 мл раствора азотной кислоты(1:1) и 10 мл 10% - ного раствора роданида аммония. Объем растворов в колбах доводят до метки дистиллированной водой и перемешивают. Получают растворы, содержащие 0,002 мг и 0,008 мг железа в 1 мл. Измеряют светопоглощения полученных окрашенных растворов при разных светофильтрах или длинах волн в кюветах толщиной слоя 1 см через 10 минут. В качестве нулевого раствора применяют дистиллированную воду. На основании полученных данных строят график зависимости светопоглощения (А) от длины волны (рис. 2). По графику находят длину волны, соответствующую максимальному светопоглощения железороданидного комплекса (λmax). Независимо от концентрации ионов железа, максимум светопоглощения находится при λ = 480 нм. Поэтому измерение светопоглощения растворов тетрароданоферра нужно проводить при λ = 480 нм или близкой к этой величине, если используется фотометры со светофильтрами.
15

Построение градуировочного графика
В мерные колбы на 100 мл вливают 1, 2, 4, 6, 8, и 10 мл рабочего раствора соли железа. Добавляют все необходимые реактивы и измеряют светопоглощение окрашенных растворов в кювете на 1 см, используя выбранную длину волны. Строят график зависимости светопоглощения от концентрации ионов железа (III) в растворе (градуировочный график).
Определение концентрации железа (III) в пробе воды
Из тщательно перемешанной пробы отбирают 25 мл (или меньший объем, содержащий не более 1 мг/л железа), помещают в мерную колбу на 100 мл, добавляют 2 мл азотной кислоты (1:1) и 10 мл 10% - ного раствора роданида аммония. Доводят объем раствора до метки, закрывают пробкой и тщательно перемешивают. Измеряют светопоглощение раствора через 10 мин. При выбранной длине волны (λ = 480 нм) в кюветах с толщиной слоя 1 см. Содержание железа (III) находят по графику. Концентрацию рассчитывают по формуле:
,
где m – содержание железа (III) и колориметрируемом объеме, найденное по графику, мг; V – объем воды, взятой на анализ, см3.
ЛАБОРАТОРНАЯ РАБОТА № 2
Определение железа (II) и железа (III) в питьевой воде в виде сульфосалицилатов
В соответствие с ГОСТ 2874 – 82 концентрация железа общего в питьевой воде не должна превышать 0,3 мг/л. Лимитирующий показатель вредности органолептический.
Сущность метода
Сульфосалициловая кислота образует в аммиачном растворе окрашенные в желтый цвет комплексные соединения как с ионами Fe3+, так и с ионами Fe2+. Максимум светопоглощения комплексов в интервале рН 8 – 11,5 лежит при 430 нм.
16
В кислых растворах тот же реактив образует окрашенное в красный цвет комплексное соединение с ионами Fe3+. Максимуму светопоглощения этого комплекса при рН 1,5 соответствует длина волны 500 нм.
Сульфосалициловый метод можно применять для определения железа в присутствии многих анионов, даже таких, как фосфаты, хлориды, фториды и др., которые мешают определению железа роданидным методом. Катионы, образующие комплексные соединения с сульфосалициловой кислотой (Al3+, Cu2+, Pb2+) затрудняют определение железа. Присутствие в растворе окислителей и восстановителей нежелательно. Предел обнаружения железа
0,1 мг/л.
Реактивы и приборы
1.Сульфосалициловая кислота, ч.д.а., 20% - ный раствор.
2.Аммиак, ч.д.а., 10% - ный раствор.
3.Соляная кислота, ч.д.а., разбавленный (3:2) раствор.
4.Железо – аммонийные квасцы, стандартный раствор содержит 0,1 мг железа в 1 мл (приготовление на стр.)
5.Хлорид аммония, 2М раствор.
6.Фотометр.
7.Мерные колбы.
8.Пипетки на 5, 10, 25 мл.
Выполнение работы
Определение суммарного содержания ионов железа (III) и железа (II).
Построение градуировочного графика.
В мерные колбы на 100 мл вводят 1, 2, 4, 6, 10 мл рабочего стандартного раствора соли железа, доводят рН раствора до 6 – 8, добавляя по каплям 10% - ный раствор аммиака (контроль рН по универсальной индикаторной бумаге); приливают 2 мл 2М раствора хлорида аммония, 2 мл 20% - ного раствора сульфосалициловой кислоты, 2 мл 10% - ного раствора аммиака. После добавления каждого реактива содержимое колб перемешивают, доводят объем раствора до метки дистиллированной водой, перемешивают и через 15 мин. фотометрируют при λ = 400 – 430 нм в кюветах с толщиной оптического слоя 5 см. В качестве раствора сравнения используют дистиллированную воду, в которую в мерной колбе на 100 мл добавляют те же реактивы, что и в стандартные растворы. Градуировочный
17
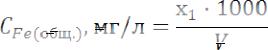
график строят в координатах светопоглощение (А) – содержание железа
(мг/100 мл).
Выполнение анализа
Из тщательно перемешанной пробы анализируемой воды отбирают 10
– 15 мл (содержание железа не более 1 мг/л). Если содержание железа выше, пробу необходимо разбавить. Отобранный аликвотный объем переносят в мерную колбу на 100 мл. Далее добавляют реактивы как написано при построении градуировочного графика.
По градуировочному графику находят содержание железа, соответствующее измеренному светопоглощению раствора. Концентрацию железа (общего) в исследуемом растворе рассчитывают по формулам:
где СFe(общ.) – концентрация железа в анализируемом растворе, мг/л x1 - содержание железа, найденного по графику, мг
V – объем раствора, взятый на фотометрирование, мл.
Определение содержание ионов железа (III)
В кислой среде (рН 1,8 - 2,5) только ионы железа (III) дают окрашенное соединение с сульфосалициловой кислотой. Используются реактивы и аппаратура метода определения суммарного содержания железа.
Построение градуировочного графика
В мерные колбы на 100 мл вводят 1, 2, 4, 6, 8, 10 мл рабочего стандартного раствора соли железа (III), добавляют по каплям 10% - ный раствор аммиака до рН 6 (контроль по универсальной индикаторной бумаге). Затем вводят 0,2 мл раствора хлористоводородной кислоты, 5 мл 20% - ного раствора сульфосалициловой кислоты, доводят объем раствора до метки дистиллированной водой, перемешивают содержимое колбы и через 10 мин измеряют оптическую плотность растворов при λ = 520 нм в кювете с толщиной слоя 3 см.
По полученным данным строят градуировочный график зависимости оптической плотности растворов от концентрации ионов железа (III).
18
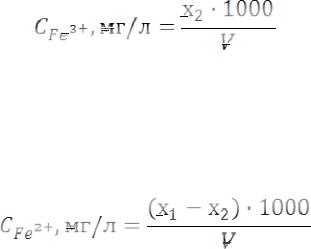
Выполнение анализа
Аликвотный объем анализируемой воды 25 – 50 мл помещают в мерную колбу на 100 мл (при содержании железа не более 1 мг/л). Если концентрация выше, пробу необходимо разбавить так, чтобы содержание железа укладывалось в градуировочный график.
К объему раствора в мерной колбе добавляют, если необходимо, раствор аммиака или соляной кислоты до рН 6 (контроль по универсальной индикаторной бумаге). Добавляют 0,2 мл раствора хлористоводородной кислоты, 5 мл 20% - ного раствора сульфосалициловой кислоты, доводят до метки дистиллированной водой, перемешивают и измеряют оптическую плотность при λ = 520 нм в кювете с толщиной слоя 3 см.
По градуировочному графику находят содержание железа (III) в фотометрируемом объеме (х2). Концентрацию железа (III) в пробе рассчитывают по формулам:
Обозначения величин в формулах те же, что и при определение железа общего.
Содержание железа (II) в фотометрируемом объеме равно (x1 - x2) мг, а концентрацию в анализируемой воде рассчитывают по формуле:
ЛАБОРАТОРНАЯ РАБОТА №3 Определение аммонийного азота в питьевой воде и источниках
водоснабжения
Предельно допустимая концентрация ионов аммония в воде водоемов хозяйственно-бытового водопользования 1,0 мг/л, лимитирующий показатель вредности органолептический. В рыбохозяйственных водоемах ПДК ионов аммония 0,5 мг/л. Лимитирующий показатель вредности токсикологический.
19
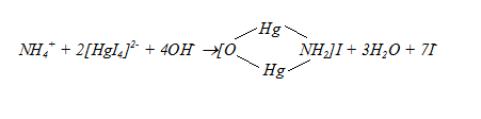
Сущность метода
Метод основан на способности аммиака и ионов аммония образовывать в щелочной среде с реактивом Несслера (K2[HgI4]) окрашенное в желтооранжевый цвет соединение йодида меркураммония:
При низких концентрациях аммонийного азота (< 3 мг/л) образуется коллоидный раствор, поглощающий свет в интервале длин волн 400-425 нм.
Предел обнаружения 0,05 мг NH4+/л. Диапазон измеряемых масс ионов аммония в пробе 0,005-0,150 мг. Проведению анализа мешают амины, хлорамины, ацетон, альдегид, спирты. В их присутствии аммиак обнаруживают после его предварительной отгонки. Мешающее влияние жесткости воды устраняют введением тартрата калия-натрия (сегнетовой соли). Большие количества железа, сульфатов, мутности удаляют осветлением пробы. Для этого в нее вносят или гидроксид алюминия, или сульфат цинка, доводят рН смеси до 10,5. Выпадающие осадки отфильтровывают.
Реактивы и аппаратура
1.Безаммиачная вода: дистиллированную воду кипятят в течение часа с 5%-ным раствором NaOH (на 1 литр воды вводят 25 мл раствора щелочи). После охлаждения проверяют на содержание ионов аммония с реактивом Несслера. Безаммиачную воду применяют для приготовления реактивов и разбавления пробы.
2.Реактив Несслера.
3.Тартрат калия-натрия (сегнетова соль), 50%-ный раствор. В безаммиачной воде при нагревании растворяют 50 г KNaС4Н4О2·Н2О, доводят объем до 100 мл и фильтруют. Прибавляют 6 мл реактива Несслера. После осветления и проверки на полноту осаждения аммиака реактив готов к употреблению.
4.Стандартные растворы соли аммония.
4.1. Основной раствор. Хлорид аммония NH4Cl(ч.д.а.) высушивают до постоянной массы при 90° С. Навеску соли 0,2965 г растворяют в дистиллированной безаммиачной воде в мерной колбе на 1л, доводят объем до метки той же водой. В 1мл раствора содержится 0,1 мг NH4+.
20
