
2767
.pdfОпределенный катализатор ускоряет только конкретные реакции, не влияя на другие, которые также могут проходить с участием тех же веществ. Это свойство катализаторов называется селективностью, или
избирательностью. Различают гомогенный и гетерогенный катализ.
При гомогенном катализе реагирующие вещества и катализатор находятся в одной фазе (обычно в растворе). Так, например, работают в организме ферменты, которые каталитически регулируют процессы жизнедеятельности в живой природе.
При гетерогенном катализе катализатор находится в другой фазе, и химическая реакция протекает на границе раздела фаз. Наибольшее практическое значение имеют каталитические реакции, когда катализатор находится в твердой фазе, а реагенты – в жидкой или газообразной.
Таким образом, катализ является важнейшим из изученных способов ускорения химических процессов, широко применяемым в химической индустрии.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В настоящей работе изучается кинетика каталитического разложения пероксида водорода Н2О2.
Выразим С0 и С через объем кислорода. Введем обозначения. Пусть Vt – текущий объем кислорода, т.е.
11

объем выделившийся через некоторое время t, отсчитываемое от начала реакции, V∞ – объем кислорода, который должен выделиться при полном разложении пероксида водорода, взятого для опыта. Эта величина определяется расчетным путем. Для этого используется объем и концентрация раствора пероксида водорода и уравнение реакции его разложения.
Очевидно, что начальная концентрация пероксида водорода С0 пропорциональна V∞, а текущая концентрация С пропорциональна разности V∞ – Vt. Тогда вместо уравнения (1) получим для данной реакции:
ln |
|
|
|
= kt или lg |
|
|
|
= kt |
(2) |
|
|
|
|
|
|
Из этого следует, что для разложения Н2О2 должна соблюдаться прямолинейная зависимость в координатах
ln 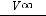 от времени, а тангенс угла наклона прямой есть
от времени, а тангенс угла наклона прямой есть
константа скорости реакции k.
Лабораторная работа
Влияние катализатора на скорость реакции
Цель работы: изучить влияние концентрации катализатора (K2Cr2O7) на скорость разложения пероксида водорода (Н2О2).
Чистый Н2О2 разлагается медленно, но реакция сильно ускоряется в присутствии солей металлов переменной валентности, таких как железо, хром, марганец и др.
12
Н2О2 (ж) = Н2О(ж) + ½ О2 (г)
Разложение при комнатной температуре описывается уравнением реакции первого порядка. Скорость реакции проще всего измерять по объему выделяющегося кислорода.
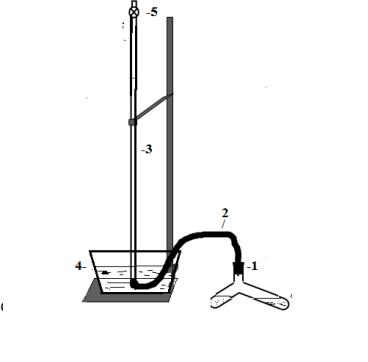
Исследования проводятся на установке, изображенной на рис.3. Установка состоит из реакционного сосуда (1), закрытого резиновой пробкой с газоотводной трубкой (2), бюретки для сбора газа (3), стеклянного кристаллизатора (4), заполненного водой.
Рис.3. Установка для изучения скорости разложения пероксида водорода.
13
Экспериментальная часть
1.При открытом кране (5) поднимаем жидкость в бюретке до нулевой отметки при помощи резиновой груши. Закрыть кран.
2.8 мл раствора пероксида водорода 0,75%, заливается в длинное колено сосуда, а в короткое колено сосуда заливается 6 мл 1%-го раствора катализатора K2Cr2O7, не допуская попадание раствора катализатора в колено с Н2О2. Сосуд осторожно закрываем резиновой пробкой, соединенной с газоотводным шлангом.
3.Смешать раствор катализатора и пероксида водорода и одновременно включить секундомер. Выделяющийся в результате реакции кислород будет вытеснять жидкость в бюретке, понижая еѐ уровень. Не прекращая перемешивание реакционной смеси, через каждые 30 секунд определяем объем выделившегося кислорода по уровню воды в бюретке. Результаты заносятся в таблицу. Измерения прекращают, после того как скорость выделения кислорода сильно замедлится и показания объема почти не меняются.
4.После окончания первого опыта провести еще три, уменьшая концентрацию катализатора. Для этого во втором опыте в короткое колено сосуда заливается 5 мл раствора катализатора и 1 мл воды. В третьем
14
опыте взять 4 мл катализатора и 2 мл воды. В четвертом – 3 мл катализатора и 3 мл воды. Таким образом, концентрации катализатора K2Cr2O7 в опытах будут соответственно 1%, 0,83%, 0,67% и 0,5%.
5.Полученные результаты занести в таблицу 1.
6.Результаты опытов представить в виде графиков в координатах V мл (ось y) от t мин. (ось х).
7.Построить графики зависимости в координатах ln
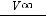 от t. Экспериментальные точки, кроме явно
от t. Экспериментальные точки, кроме явно
«выпавших», использовать для проведения прямых линий. Убедиться, что разложение подчиняется уравнению первого порядка.
8.Для каждой концентрации катализатора рассчитать константу скорости реакции. Для этого необходимо построить прямоугольный треугольник, в котором экспериментальная прямая будет гипотенузой. Определить в единицах соответствующей оси координат размер катетов и рассчитать тангенс угла наклона прямой к оси абсцисс. В соответствии с уравнением (16) тангенс равен константе скорости реакции в данных условиях.
15

9.Для каждой концентрации катализатора написать выражение закона действующих масс с соответствующей рассчитанной величиной константы скорости. Рассчитать по этому уравнению начальную скорость разложения Н2О2 для каждой концентрации катализатора.
|
|
|
Таблица 1 |
|
Объем |
|
|
|
выделившего |
|
|
Время |
ся кислорода |
ln |
Примечания |
|
|
||
реакции, |
Vt (мл) к |
|
|
t , мин |
моменту |
|
|
|
времени t |
|
|
|
(мин) |
|
|
1,0 |
|
|
С0= |
|
|
|
|
1,5 |
|
|
V = |
|
|
|
|
2,0 |
|
|
СК= |
|
|
|
|
… |
|
|
|
,где: |
|
|
|
С0 – начальная концентрация Н2О2 |
в смеси моль/л – |
||
рассчитывается с учетом разбавления используемой |
|||
концентрации раствором катализатора. |
|
||
16
V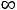 - объем кислорода, который должен выделиться при разложении всего взятого на опыт Н2О2.
- объем кислорода, который должен выделиться при разложении всего взятого на опыт Н2О2.
СК – концентрация катализатора в реакционной смеси. Учесть разбавление исходного раствора катализатора раствором Н2О2.
Вывод: в выводе отразите влияние уменьшения концентрации катализатора на скорость разложения пероксида водорода.
17
Литература
1.Яблоков В.А. Теория горения и взрывов. Учебное пособие. Н.Новгород, ННГАСУ, 2007
г. – 62 с.
2.Киреев В.А. Кpаткий куpс физической химии /
В. А. Киpеев. - М.: Химия, 1978. - 624 с.
3.Еремин Е.Н. Основы химической кинетики / Е.Н.Ерѐмин. - М.: Высш. шк., 1976.- 226с.
4.Рэмсден Э.Н. Начала современной химии /
Э.Н.Рэмсден. – Л.: Химия, 1989. – 783с.
5.Стромберг А.Г., Семченко Д.П. Физическая химия / А.Г.Стромберг, Д.П.Семченко. – М.:
Высш. шк., 2001. – 527с.
18
МИТРОФАНОВА СВЕТЛАНА ВАЛЕРЬЕВНА ЗАХАРОВА ОЛЬГА МИХАЙЛОВНА КОЧЕТКОВА МАРИНА АЛЕКСАНДРОВНА
КИНЕТИКА ГОМОГЕННЫХ ХИМИЧЕСКИХ РЕАКЦИЙ
Методические указания к лабораторным работам по дисциплине « Химия» для студентов направлений 270100.62 – Строительство
Подписано в печать_______________2012 г. Формат 60×90 1/16.
Бумага газетная. Печать офсетная.
Усл.печ.л. Уч.-изд.л.
Тираж 100 экз. Заказ ________
Нижегородский государственный архитектурно-строительный университет, 603950. Н.Новгород, ул.Ильинская, 65.
Полиграфический центр Нижегородского государственного архитектурно-строительного университета, 603950. Н.Новгород,
ул.Ильинская, 65.
19
