
книги / Энерготехнология химических производств
..pdfИз рис. 1.8 и уравнения (1.34) следует, что |
|
∂q = Tds |
(1.42) |
или |
|
2 |
|
q = T ds. |
(1.43) |
1 |
|
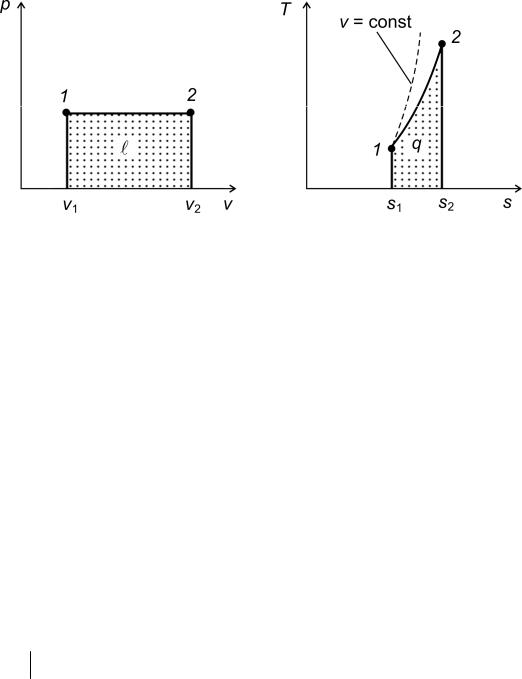
Таким образом, площадь, ограниченная линией процесса, крайними ординатами и осью абсцисс, эквивалентна теплоте процесса.
Как видно из формулы (1.42), при подводе к телу теплоты (∂q > 0) его энтропия возрастает (ds > 0), а при отводе теплоты (∂q < 0) энтропия уменьшается (ds < 0).
1.6. Теплоемкость
Отношение количества теплоты, полученного телом при бесконечно малом изменении его состояния (∂Q), к связанному с этим изменению температуры тела (dT) называется теплоемкостью тела в данном термодинамическом процессе (рис. 1.9):
C = ∂Q |
(1.44) |
dT |
|
или |
|
∂Q = CdT. |
(1.45) |
В интегральном виде |
|
T2 |
|
Q = CdT. |
(1.46) |
T1 |
|
Обычно теплоемкость относят к единице количества вещества.
Взависимости от этого различают:
–удельную массовую теплоемкость, отнесенную к 1 кг газа,
Дж/(кг К);
–удельную объемную теплоемкость, отнесенную к 1 м3 газа при нормальных термодинамических условиях, Дж/(нм3 К);
–удельную мольную теплоемкость, отнесенную к 1 молю газа,
Дж/(моль К).
Следует отметить, что при обозначении теплоемкости обяза-
тельно указывают тип процесса, которому она соответствует, так как
21

Рис. 1.9. Физический смысл теплоемкости
одно и то же рабочее тело в зависимости от процесса требует для своего нагревания на 1 К различное количество теплоты. Так, в зависимости от типа процесса и в соответствии с первым законом термодинамики подведенная к телу теплота не обязательно будет расходоваться на увеличение внутренней энергии тела, что вызовет повышение температуры, а может сразу превращаться в работу. Более того, количество совершаемой в термодинамическом процессе работы может быть больше, чем количество подведенной теплоты, т.е. работа частично будет совершаться за счет уменьшения внутренней энергии системы, что вызовет уменьшение температуры тела (рис. 1.10). Таким образом, величина теплоемкости (без указания процесса) может изменяться в пределах от –∞ до +∞.
dU = ∂Q − ∂ L,
dT = dU / ( 4155i ), C = ∂ Q / dT .
∂ Q > ∂ L, dU > 0, dT > 0, C > 0,
∂ Q < ∂ L, dU < 0, dT < 0, C < 0.
Рис. 1.10. Величина теплоемкости в различных термодинамических процессах
22
Наибольшее значение в термодинамических расчетах имеет изохорная теплоемкость (теплоемкость в процессах при постоянном объеме):
CV |
= |
∂qV |
, |
(1.47) |
|
||||
|
|
dT |
|
|
а также изобарная теплоемкость (теплоемкость в процессах при постоянном давлении):
CP |
= ∂qP . |
(1.48) |
|
dT |
|
Соотношение между изохорной и изобарной теплоемкостями определяется уравнением Майера:
СР = СV + R. |
(1.49) |
Для изобарных процессов соотношением, которое достаточно широко используется в инженерных расчетах, является связь теплоемкости с энтальпией системы. В дифференциальном виде соотношение записывается так:
dh = du + d(pv) = cVdT + RdT = (cV + R)dT = cPdT. (1.50)
В интегральном виде –
t2 |
|
h = h2 − h1 = cP dT. |
(1.51) |
t1 |
|
Для реальных газов СР – СV > R, так как при их изобарном расширении совершается работа не только против внешних сил, но и против межмолекулярных сил притяжения, что вызывает дополнительный расход теплоты. По данной причине величина теплоемкости обычно определяется экспериментально. Тем не менее теплоемкость газов, свойства которых приближаются к свойствам идеального газа, можно рассчитать методами статистической физики:
CV |
= |
dU |
или CV |
= |
i |
R, |
(1.52) |
dT |
|
||||||
|
|
|
2 |
|
|
||
где CV – изобарная теплоемкость, кДж/(кмоль К); i – число степеней свободы молекулы (dU = f (i)).
23
Таблица 1 . 1
Применение молекулярно-кинетической теории к реальным газам
Вещество |
i |
C эксп |
C расч |
|
|
V |
V |
He |
3 |
12,6 |
12,5 |
N2 |
5 |
20,8 |
20,8 |
CH4 |
6 |
26,4 |
24,9 |
Результаты расчетов, показывающие допустимость применения молекулярно-кинетической теории к некоторым реальным газам, приведены в табл. 1.1.
1.7. Термодинамические процессы в идеальном газе
Основными процессами, имеющими большое значение в теоретическом и прикладном значениях, являются:
–изохорный, протекающий при постоянном объеме;
–изобарный, протекающий при постоянном давлении;
–изотермический, протекающий при постоянной температуре;
–адиабатный, при котором отсутствует теплообмен с окружающей средой;
–политропный.
Изохорный процесс. При данном процессе выполняется условие dv = 0, так как v = const, поэтому уравнение процесса следующее:
p2 |
= |
T2 |
, |
(1.53) |
|
p1 |
T1 |
||||
|
|
|
т.е. давление газа пропорционально его температуре, так как все подведенное тепло расходуется на увеличение его внутренней энергии.
Как видно из графиков процесса (рис. 1.11), работа расширения в этом процессе, изображенная на P,V-диаграмме (рис. 1.11, а), равна нулю, так как dv = 0.
Количество теплоты, подведенной к рабочему телу в процессе 1–2 при cV = const (рис. 1.11, б) (теплоемкость идеальных газов не зависит от температуры), будет определяться соотношением
T2 |
|
q = cV dT = cV (T2 −T1 ) . |
(1.54) |
T1 |
|
24

а |
б |
Рис. 1.11. Изохорный процесс
При переменной теплоемкости вместо cV необходимо использовать среднюю массовую изохорную теплоемкость в интервале тем-
ператур от Т1 до Т2: cv = cv T2 .
ср T1
Так как в изохорном процессе = 0, то в соответствии с первым
законом термодинамики u = q, поэтому
u = сV (T2 – T1) при сV = const. |
(1.55) |
Изменение энтропии в изохорном процессе можно определить по формуле
s2 |
− s1 |
= cV ln |
p2 |
= cV ln |
T2 |
, |
(1.56) |
|
p1 |
T1 |
|||||||
|
|
|
|
|
|
т.е. зависимость энтропии от температуры имеет логарифмический характер.
Изобарный процесс. При данном процессе выполняется условие dр = 0, так как р = const (рис. 1.12, а, б). В связи с этим уравнение процесса следующее:
v2 |
= |
T2 |
, |
(1.57) |
|
v1 |
T1 |
||||
|
|
|
т.е. объем газа пропорционален его абсолютной температуре (закон Гей–Люссака).
Работа расширения в процессе может быть рассчитана по формуле
25
а |
б |
Рис. 1.12. Изобарный процесс |
|
V2 |
|
= pdv = p(v2 − v1 ), |
(1.58) |
V1 |
|
так как pv1 = RT1 и pv2 = RT2, то |
|
= R (T2 – T1). |
(1.59) |
Количество теплоты, подведенной к рабочему телу в процессе 1–2 при cР = const, будет определяться соотношением
T2 |
|
q = cтdT = cт (T2 − T1 ). |
(1.60) |
T1 |
|
При переменной теплоемкости необходимо использовать среднюю массовую теплоемкость в интервале температур от Т1 до Т2:
T2 cm = cpср T1 .
Изменение энтропии в изобарном процессе можно определить по формуле
s2 |
− s1 |
= cт ln |
T2 |
, |
(1.61) |
|
T |
||||||
|
|
|
|
|
||
|
|
1 |
|
|
||
т.е. зависимость энтропии от температуры также имеет логарифмический характер; однако так как cP > cV, то зависимость идет более полого, чем в изохорном процессе.
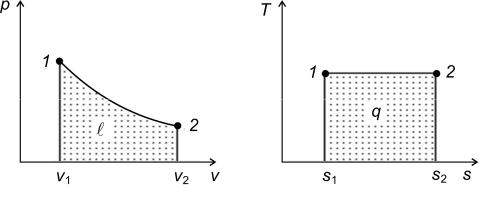
Изотермический процесс. При данном процессе выполняется условие dТ = 0, так как Т = const (рис. 1.13, а, б).
26
а |
б |
Рис. 1.13. Изотермический процесс
Таким образом, уравнение процесса будет имеет вид
v1 |
= |
р2 |
, |
(1.62) |
|
v2 |
р1 |
||||
|
|
|
т.е. давление и объем газа обратно пропорциональны друг другу; при изотермическом сжатии давление газа возрастает, а при расширении падает (закон Бойля–Мариотта).
Работа расширения в процессе может быть рассчитана по уравнению
V |
V |
|
dv |
|
v2 |
|
p1 |
|
|
|
= 2 |
pdv = 2 |
RT |
= RT ln |
= RT ln |
. |
(1.63) |
||||
|
|
|
||||||||
V1 |
V1 |
|
v |
|
v1 |
|
p2 |
|
||
Так как температура не изменяется, то внутренняя энергия системы в данном процессе останется постоянной ( u = 0), и вся подводимая энергия превращается в работу, а при изотермическом сжатии от газа отводится теплота в количестве, равном затраченной на сжатие работе:
q = . |
(1.64) |
Изменение энтропии в процессе можно определить по уравнению
2 |
∂q |
|
q |
|
p1 |
v2 |
|
|
||
s2 − s1 = |
|
= |
|
= R ln |
|
= R ln |
|
|
. |
(1.65) |
T |
T |
p |
v |
1 |
||||||
1 |
|
|
|
2 |
|
|
|
|
||
Адиабатный процесс. Процесс, происходящий без теплообмена с окружающей средой (∂q = 0), называется адиабатным (рис. 1.14, а, б).
27

а |
б |
Рис. 1.14. Адиабатный процесс
Уравнение адиабатного процесса имеет вид
p1v1k = p2v2k , |
(1.66) |
где k – коэффициент адиабаты или Пуассона,
k = |
c |
= 1+ |
R |
|
|
P |
|
. |
(1.67) |
||
c |
c |
||||
|
V |
|
V |
|
|
Известно, что теплоемкость идеальных газов зависит не от температуры, а только от природы газа, поэтому величина k также должна являться функцией числа степеней свободы газа:
Количество атомов в газе |
1 |
2 |
3 |
Коэффициент адиабаты |
1,66 |
1,40 |
1,33 |
Так как k > 1, то при адиабатном расширении давление понижается быстрее, чем при изотермическом, поскольку в процессе расширения еще уменьшается и температура газа.
Для определения зависимостей температуры от удельного объема или давления можно использовать соотношения:
T |
|
v |
1 |
k −1 |
|
|
|||||
2 |
|
= |
|
|
|
|
, |
(1.68) |
|||
T1 |
|
|
|
|
|||||||
|
v2 |
|
|
|
|
|
|||||
T |
|
p |
|
k −1 |
|
|
|||||
|
k |
|
|
|
|||||||
2 |
|
= |
|
2 |
|
|
|
. |
(1.69) |
||
|
T1 |
|
|
|
|
|
|||||
|
|
p1 |
|
|
|
|
|
||||
28
Работа расширения при адиабатном процессе, согласно первому закону термодинамики, совершается за счет уменьшения внутренней энергии и может быть вычислена по формуле
= − u = cV (T1 |
−T2 ) = |
R |
|
(T1 −T2 ). |
(1.70) |
|
k − 1 |
||||||
|
|
|
|
|||
Так как p1v1 = RT1 и p2v2 = RT2, то
= |
1 |
|
( p1v1 − p2v2 ). |
(1.71) |
|
k − 1 |
|||||
|
|
|
|||
При проведении адиабатного процесса ∂q = 0, поэтому теплоемкость процесса c = ∂q dT также будет равна нулю. Энтропия системы в адиабатном процессе не изменяется, поэтому адиабатный процесс иногда называют изоэнтропийным.
dT также будет равна нулю. Энтропия системы в адиабатном процессе не изменяется, поэтому адиабатный процесс иногда называют изоэнтропийным.
Политропный процесс. Данный процесс является обобщающим процессом. С помощью уравнения политропного процесса можно в P,V-координатах описать любой произвольный процесс (по крайней мере на небольшом участке изменения термодинамических параметров) уравнением
pvn = const, |
(1.72) |
где n – показатель политропы, который может принимать значения от –∞ до +∞, однако для заданного процесса он является величиной постоянной.
Постоянство показателя политропы связано с тем, что политропный процесс характеризуется заданным постоянным коэффициентом распределения теплоты процесса между изменением внутренней энергии
α = u = const |
(1.73) |
q |
|
и работы
β = 1− α = |
|
= const. |
(1.74) |
|
|||
|
q |
|
|
Исходя из уравнения процесса, с помощью уравнения Клапейрона можно выразить взаимное влияние основных параметров состояния системы:
29

p |
v |
1 |
n |
|
||
2 |
= |
|
|
, |
(1.75) |
|
p1 |
|
|
||||
v2 |
|
|
|
|||
T |
v |
|
n−1 |
|
|
||||||
2 |
= |
1 |
|
|
, |
|
(1.76) |
||||
|
T1 |
|
|
||||||||
|
v2 |
|
|
|
|
|
|
||||
T |
p |
|
|
n−1 |
|
|
|||||
|
n |
|
|
|
|||||||
2 |
|
= |
2 |
|
|
|
|
. |
(1.77) |
||
T1 |
|
|
|
|
|||||||
p1 |
|
|
|
|
|
|
|||||
Работа расширения газа в политропном процессе имеет вид
|
v2 |
dv |
|
p1v1 |
|
|
v1 |
|
n−1 |
|
p1v1 |
|
||||
= p v n |
|
= |
1 |
− |
|
= |
1− |
|||||||||
|
|
|
|
|
|
|
|
|||||||||
|
|
v |
|
|
n − 1 |
|||||||||||
1 1 |
v n |
|
n − 1 |
|
2 |
|
|
|
||||||||
|
v1 |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Уравнение (1.78) можно преобразовать к виду
p2p1
n−1 |
|
|
|
|
|
n |
(1.78) |
|
|
. |
|
|
|
|
|
|
|
= |
R |
|
(T1 |
− T2 ) = |
p1v1 |
|
1− |
T2 |
|
= |
1 |
|
( p1v1 − p2v2 ). |
|
|
|
|
|
(1.79) |
||||||||||
n − 1 |
|
|
n − 1 |
|||||||||||
|
|
|
n − 1 |
|
T1 |
|
|
|
||||||
Количество подведенной или отведенной в процессе теплоты можно определить по уравнению, выведенному из первого закона термодинамики:
q = c |
n − k |
(T |
− T ) = c |
(T |
− T ), |
(1.80) |
|
|
|||||||
V |
n − 1 |
2 |
1 |
П |
2 |
1 |
|
|
|
|
|
|
|
|
|
где сП – теплоемкость идеального газа в политропном процессе, которую можно рассчитать по уравнению
cП = cV |
n − k |
. |
(1.81) |
||
|
|
||||
|
|
n − 1 |
|
||
Так как теплоемкость политропного процесса |
|
||||
cП = |
∂q |
, |
(1.82) |
||
|
|||||
|
dT |
|
|||
а подведенная или отведенная в процессе теплота может расходоваться как на совершение работы, так и на изменение внутренней энергии в соответствии с коэффициентом распределения теплоты,
30
