
книги / Химия. Классы неорганических соединений
.pdfсколько степеней окисления, то в скобках римской цифрой указывают степень окисления элемента, например: Zn(OН)2 – гидроксид цинка, Fe(OH)2 – гидроксид железа (II), Fe(OH)3 – гидроксид желе-
за (III).
2.3. Кислоты
Кислоты – химические соединения, молекулы которых состоят из ионов водорода и анионов кислотного остатка.
Количество ионов водорода в кислоте определяет ее основность. Различают кислоты одноосновные и многоосновные. Например, азотная кислота HNO3 является одноосновной, а фосфорная кислота H3PO4 будет трехосновной. Основность, как правило, не превышает трех.
По химическому составу кислоты бывают кислородсодержащие и бескислородные. Кислородсодержащие кислоты, например
H2SO4, содержат в своем составе кислород. В составе бескислородных кислот, например H2S, кислород отсутствует.
Кислоты взаимодействуют со следующими веществами:
– с основными и амфотерными оксидами: ZnO + H2SO4 = ZnSO4 + H2O,
– с гидроксидами:
2KOH + H2SO4 = K2SO4 + 2H2O,
– с солями:
BaCl2 + H2SO4 = BaSO4↓ + 2HCl,
– с металлами:
Cu + 2H2SO4 (конц.) = CuSO4 + SO2↑ + 2H2O.
Получение кислот
Кислоты получают взаимодействием кислотных оксидов с водой:
11
CrO3 + H2O = H2CrO4,
а также по реакции обмена:
Na2SiO3 + 2HCl = H2SiO3↓ + 2NaCl,
2NaCl (т) + H2SO4 (конц.) = 2HCl↑ + Na2SO4.
Однако следует помнить, что реакция обмена происходит необратимо только в том случае, когда получаются летучие или малорастворимые продукты реакции.
Бескислородные кислоты можно получить синтезом из простых веществ:
H2 + Cl2 = 2HCl.
Номенклатура кислот
Названия бескислородных кислот образуются от названия кислотообразующего элемента с добавлением «водородная» и слова «кислота», например: HCl – хлороводородная кислота; H2Se – селеноводородная кислота.
Названия кислородсодержащих кислот образуются от названия кислотообразующего элемента с добавлением суффиксов «-н-», «-ов-», «-ев-» (если степень окисления кислотообразующего элемента высшая) и «-ист-», «-нист-», «-оват-», «-новат-», «-новатист-» (если пониженная степень окисления кислотообразующего элемента), например: HClO4 – хлорная кислота, H2CrO4 – хромовая кислота, H2SiO3 – кремниевая кислота, HClO3 – хлорноватая кислота, HClO2 – хлористая кислота, HClO – хлорноватистая кислота.
Иногда кислотообразующий элемент в одной и той же степени окисления способен образовать несколько кислот, отличающихся числом атомов водорода и кислорода (содержанием молекул воды) или числом атомов кислотообразующего элемента. Так, для бора, имеющего степень окисления +3, известны кислоты HBO2 – мета- борная кислота, H3BO3 – ортоборная кислота, H2B4O7 – тетраборная кислота. В названии кислоты добавляют приставки «мета-» при меньшем числе атомов водорода и «орто-» при большем числе ато-
12
мов водорода. Число атомов кислотообразующего элемента также указывают соответствующей приставкой. В приведенном примере используется приставка «тетра-».
Традиционные названия наиболее распространенных кислот и их анионов приведены в таблице. Для некоторых кислот в скобках приводятся также тривиальные названия, которые часто используются.
Названия кислот и их анионов
Формула |
Название кислоты (тривиальное) |
Название аниона |
|
|
|
HF |
Фтороводородная (плавиковая) |
Фторид |
HCl |
Хлороводородная (соляная) |
Хлорид |
HBr |
Бромоводородная |
Бромид |
HI |
Йодоводородная |
Йодид |
H2S |
Сероводородная |
Сульфид |
HCN |
Циановодородная (синильная) |
Цианид |
HNO2 |
Азотистая |
Нитрит |
HNO3 |
Азотная |
Нитрат |
HBO2 |
Метаборная |
Метаборат |
H3BO3 |
Ортоборная |
Ортоборат |
HBrO3 |
Бромноватая |
Бромат |
H3VO4 |
Ортованадиевая |
Ортованадат |
HIO3 |
Йодноватая |
Йодат |
H2SiO3 |
Метакремниевая |
Метасиликат |
H4SiO4 |
Ортокремниевая |
Ортосиликат |
HMnO4 |
Марганцовая |
Перманганат |
H2MoO4 |
Молибденовая |
Молибдат |
HAsO2 |
Метамышьяковистая |
Метаарсенит |
H3AsO3 |
Ортомышьяковистая |
Ортоарсенит |
H3AsO4 |
Мышьяковая |
Арсенат |
H2SeO4 |
Селеновая |
Селенат |
H2SO3 |
Сернистая |
Сульфит |
H2SO4 |
Серная |
Сульфат |
H2CO3 |
Угольная |
Карбонат |
|
|
|
13
|
|
Окончание табл. |
|
|
|
Формула |
Название кислоты (тривиальное) |
Название аниона |
|
|
|
HPO3 |
Метафосфорная |
Метафосфат |
H3PO4 |
Ортофосфорная |
Ортофосфат |
HClO |
Хлорноватистая |
Гипохлорит |
HClO2 |
Хлористая |
Хлорит |
HClO3 |
Хлорноватая |
Хлорат |
HClO4 |
Хлорная |
Перхлорат |
H2CrO4 |
Хромовая |
Хромат |
H2Cr2O7 |
Дихромовая |
Дихромат |
|
|
|
Составление формул кислот
Составление формулы кислоты по ее названию производится из условия электронейтральности молекулы. При этом степени окисления водорода и кислорода равны соответственно +1 и –2.
В качестве примера составим формулу метаванадиевой кислоты. В названии кислоты использован суффикс «-ев-». Это означает, что ванадий имеет максимальную степень окисления +5, равную номеру группы в периодической системе. Обозначим степени окисления всех элементов, входящих в кислоту:
+1 +5 –2
HVO.
Далее определяем минимальное количество атомов кислорода, которое позволит скомпенсировать положительный заряд ванадия +5:
(–2) 3 = –6.
Таким образом, необходимо три атома кислорода:
+1 +5 –2
HVO3.
Количество ионов водорода должно быть таким, чтобы можно было компенсировать избыточный отрицательный заряд кислотного остатка, который составляет –6 +5 = –1. Для его компенсации нужен
14
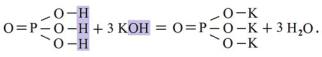
один ион водорода. Отсюда формула метаванадиевой кислоты будет HVO3. Условие электронейтральности молекулы выполняется:
(+1) 1 + (+5) 1 + (–2) 3 = 0.
2.4. Соли
Соли являются продуктом частичной или полной нейтрализации кислоты и основания, поэтому их можно рассматривать как химические соединения, молекулы которых состоят из кислотного остатка и остатка основания, например:
Cu(OH)2 + H2SO4 = CuSO4 + 2H2O.
Образовавшаяся соль CuSO4 состоит из иона Cu2+ (остатка ос-
нования) и сульфат-иона SO42 |
(остатка кислоты). |
|
||
По химическому |
составу |
соли могут |
быть средние, |
кислые |
и основные. |
|
|
|
|
Средние соли являются продуктом полной нейтрализации кис- |
||||
лоты гидроксидами. |
При взаимодействии |
фосфорной |
кислоты |
|
с гидроксидом калия происходит замещение всех ионов водорода в кислоте на ионы калия и образуется средняя соль фосфат калия
K3PO4:
H3PO4 + 3KOH = K3PO4 + 3H2O,
Кислые соли являются продуктом неполной нейтрализации кислоты гидроксидами, поэтому кислые соли образуются при недостаточном количестве гидроксида. Так, при недостатке гидроксида калия в результате неполной нейтрализации фосфорной кислоты образуются кислые соли гидрофосфат калия K2HPO4 и дигидрофосфат калия KH2PO4:
H3PO4 + 2KOH = K2HPO4 + 2H2O,
15

;
H3PO4 + KOH = KH2PO4 + H2O,
Признаком кислой соли является наличие в ее составе ионов водорода. Кислые соли образуют только двух- и трехосновные кислоты. Для превращения кислой соли в среднюю соль нужно подействовать на нее избыточным количеством гидроксида:
KH2PO4 + 2KOH = K3PO4 + 2H2O.
Кислая соль может быть получена взаимодействием малорастворимой средней соли с избыточным количеством кислоты:
Mg3(PO4)2↓ + 4H3PO4 = 3Mg(H2PO4)2.
При этом средняя соль Mg3(PO4)2 растворяется.
Основные соли являются продуктом неполной нейтрализации гидроксида кислотами, они образуются при недостаточном количестве кислоты. При недостаточном количестве хлороводородной кислоты в результате неполной нейтрализации гидроксида алюминия образуются основные соли гидроксохлорид алюминия AlOHCl2 и дигидроксохлорид алюминия Al(OH)2Cl:
Al(OH)3 + 2HCl = AlOHCl2 + 2H2O,
Al(OH)3 + HCl = Al(OH)2Cl + H2O,
16
Признаком основной соли является наличие в ее составе гид- роксид-ионов. Основные соли образуют гидроксиды, содержащие в своем составе несколько гидроксильных групп. Для превращения основной соли в среднюю соль нужно подействовать на нее избыточным количеством кислоты:
Al(OH)2Cl + 2HCl = AlCl3 + 2H2O.
Основная соль может быть получена из средней соли при взаимодействии с недостаточным для осаждения гидроксида количеством щелочи:
AlCl3 + NaOH = Al(OH)Cl2 + NaCl.
При увеличении количества щелочи осаждается гидроксид: AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl.
Соли взаимодействуют также с кислотами, например: CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O.
При взаимодействии растворов солей между собой образуются малорастворимые соединения:
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl.
Реакции растворов солей с металлами протекают в соответствии с правилами ряда напряжений металлов (более химически активный металл вытесняет менее активный из растворов его солей):
CuSO4 + Fe = FeSO4 + Cu.
Номенклатура солей
Традиционные названия средних солей составляют из двух слов: сначала называют анион кислоты в именительном падеже,
азатем катион металла в родительном падеже.
Вназвании аниона бескислородной кислоты используют суффикс «-ид». Если кислота кислородсодержащая, а степень окисления кислотообразующего элемента высшая, то используют суффикс
17
«-ат», при пониженной степени окисления кислотообразующего элемента используют суффикс «-ит». Если кислотообразующим является элемент VII группы периодической системы в высшей степени окисления, то в названии аниона добавляют приставку «пер-», в случае низшей степени окисления добавляют приставку «гипо-». Названия наиболее распространенных анионов приведены в таблице.
Если металл имеет несколько степеней окисления, то после названия катиона металла римской цифрой в скобках указывают степень его окисления. В соответствии с приведенными правилами составлены названия средних солей: Na2SO4 – сульфат натрия, CuCl
– хлорид меди (I), CuCl2 – хлорид меди (II), KMnO4 – перманганат калия, NaOCl – гипохлорит натрия.
Если в названии кислот, образующих соль, использовались приставки, то они могут сохраняться в названии солей: Mg3(PO4)2 – ортофосфат магния (допустимо фосфат магния), (NH4)2Cr2O7 – дихромат аммония.
Названия кислых и основных солей происходят от названия средних солей с добавлением начальных элементов «гидро-» для кислой соли и «гидроксо-» для основной соли. Так, кислые и основные соли правильно называть следующим образом: NH4HCO3 – гидрокарбонат аммония, NaH2BO3 – дигидроборат натрия, [Fe(OH)2]2SO4 – дигидроксосульфат железа (III).
Для некоторых солей используются тривиальные названия, например: K2Cr2O7 – хромпик, NaHCO3 – питьевая сода, Na2B4O7 10H2O – бура и другие.
Составление формул солей
Формулу соли составляют по ее названию из условия электронейтральности молекулы: алгебраическая сумма зарядов ионов в молекуле с учетом их количества равна нулю. Рассмотрим примеры составления формул следующих солей: хромата железа (III), гидроксосульфата магния, дигидрофосфата бария.
18
Соль хромат железа (III) образована хромовой кислотой H2CrO4 и гидроксидом железа (III) Fe(OH)3 . Соль должна быть средней. Заряд иона железа 3+, а кислотного остатка 2–. Положительный заряд двух ионов железа ((+3) 2 = +6) можно компенсировать отрицательным зарядом трех кислотных остатков ((–2) 3 = –6), отсюда формула соли будет Fe2(CrO4)3.
Соль дигидрофосфат бария образована фосфорной кислотой H3PO4 и гидроксидом бария Ba(OH)2. Соль должна быть кислой.
Кислотный остаток H2PO4 должен содержать два иона водорода.
Заряд ионов бария 2+ можно компенсировать зарядом двух дигид- рофосфат-ионов ((–1) 2 = –2), т.е. формула соли будет Ba(H2PO4)2.
Соль гидроксосульфат магния образована серной кислотой H2SO4 и гидроксидом магния Mg(OH)2. Соль должна быть основной. Остаток гидроксида MgOH+ должен содержать один гидроксид-ион,
а кислотный остаток будет SO24 . Отрицательный заряд кислотного
остатка 2– можно компенсировать положительным зарядом двух ионов MgOH+ ((+1) 2 = +2), т.е. формула соли будет (MgOH)2SO4.
В формуле соли условие электронейтральности молекулы выполняется как по балансу зарядов ионов, так и по балансу степеней окисления. Так, сумма положительных и отрицательных степеней окисления в молекуле (MgOH)2SO4 равна нулю:
(+2) 2 + (–2) 2 + (+1) 2 + (+6) 1 + (–2) 4 = 0.
3. РЕШЕНИЕ ТИПОВЫХ ЗАДАЧ
Пример 1.
Определите степень окисления атомов азота в веществах: N2, NO2, NH4NO2.
Решение.
Азот является простым веществом, поэтому степень окисления атомов азота в N2 равна нулю.
19
Воксиде NO2 степень окисления кислорода равна –2. Отрицательный заряд двух атомов кислорода ((–2) 2 = –4) можно компенсировать положительным зарядом атома азота +4, т.е. степень окисления атома азота в NO2 равна +4.
Внитрите аммония NH4NO2 атомы азота имеют разные степени окисления. Однозарядный анион NO2– является кислотным остатком азотистой кислоты, его заряд 1– получается при степени окисления
атома азота +3 ((+3) 1 + (–2) 2 = –1). В катионе аммония NH4
степень окисления атома азота x можно определить из условия электронейтральности молекулы:
x 1 + (+1) 4 + (+3) 1 + (–2) 2 = 0.
Из уравнения получим: х = –3. Таким образом, степени окисления атомов азота в веществах можно записать так:
0+4 –2 –3 +1 +3 –2
N2, NO2, NH4NO2.
Пример 2.
Составьте названия соединений железа: Fe2O3, Fe(OH)2, FeOH(NO3)2, FeHPO4.
Решение.
Железо проявляет в соединениях разные устойчивые степени окисления (+2 и +3), которые нужно указывать в названиях. Поэтому первые два соединения следует называть так: Fe2O3 – оксид железа
(III), Fe(OH)2 – гидроксид железа (II).
Последующие два соединения относятся к солям. Основная соль FeOH(NO3)2 содержит в составе гидроксильные группы OH–, поэтому в названии будет приставка «гидроксо-». Кислая соль содержит в составе ионы водорода H+, а в названии будет приставка «гидро-». Соли следует называть так: FeOH(NO3)2 – гидроксонитрат железа (III), FeHPO4 – гидрофосфат железа (II).
Пример 3.
Составьте формулы соединений: оксида мышьяка (V), ортомышьяковистой кислоты, дигидроарсенита натрия, арсената никеля.
20
