
книги / Механизмы органических реакций
..pdf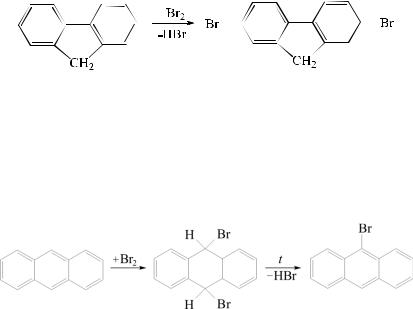
ярко выражено, скорость реакции электрофильного замещения резко возрастает. Замещение, как правило, протекает во второе положение:
Электрофильное замещение в конденсированных системах (нафталин, антрацен) может протекать как по классическому механизму SE(Ar) с образованием σ-комплекса, так и по механизму присоединения – отщепления. Доказано, что галогенирование и нитрование антрацена в мягких условиях протекает через промежуточное образование продуктов 9,10-присоединения, которые при нагревании легко превращаются в 9-производные антрацена:
При избытке электрофильного реагента образуются 9,10-диза- мещенные производные антрацена.
121

10.НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ
ВАРОМАТИЧЕСКОМ РЯДУ
Атака нуклеофилом электрононасыщенного ароматического цикла в общем случае нехарактерна. Однако известны примеры взаимодействия нуклеофильных реагентов с ароматическими системами, в частности с бензольным кольцом.
В этих реакциях в основном реализуется бимолекулярный механизм вследствие того, что в случае протекания реакции по мономолекулярному механизму в результате ионизации должен образовываться неустойчивый фенильный катион. Неустойчивость фенильного катиона объясняется тем, что вакантная sp2-гибридизированная орбиталь находится в плоскости σ-связей молекулы, в результате чего положительный заряд не может быть эффективно делокализован:
Реакции SN1 в ароматическом ряду. Ввиду трудности обра-
зования неустойчивого фенильного карбокатиона механизм SN1 в ароматическом ряду может быть реализован только в случае очень «хороших» уходящих групп. Наиболее типичным примером такого взаимодействия могут являться нуклеофильные превращения солей диазония. Диазотирование анилина приводит к образованию солей фенилдиазония:
122
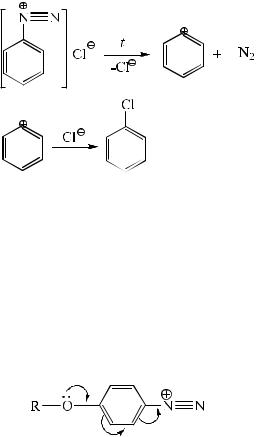
При термическом разложении хлорида фенилдиазония происходит образование хлорбензола через двухстадийный механизм SN1:
1)
2)
Стадия ионизации с образованием фенильного карбокатиона является лимитирующей, поэтому кинетическое уравнение имеет вид:
v = k[Ph–N2].
Протекание SN1-рекции ускоряют донорные заместители, находящиеся в мета-положении. Если донорные группы расположены в орто- или пара-положениях бензольного кольца, то они стабилизируют исходную молекулу и, как следствие, препятствуют ионизации, например:
Реакции SN2 в ароматическом ряду. Наиболее распростра-
ненным механизмом нуклеофильного замещения в ароматическом ряду является SN2. Как уже рассматривалось выше, бимолекулярный механизм в идеальном варианте предполагает одностадийность и синхронность процесса. Но в случае SN2 в ароматическом ряду выделяют два типа этого механизма, которые являются асинхронными и двустадийными и отличаются
123
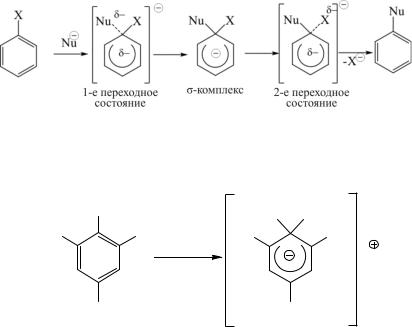
последовательностью стадий. Это механизмы присоединенияотщепления и отщепления-присоединения.
Механизм SN2 присоединения-отщепления (AdN–EN) реализу-
ется для субстратов, активированных акцепторными заместителями, которые стабилизируют σ-комплекс, образующийся в результате присоединения нуклеофильного реагента:
Доказательством существования такого механизма могут являться выделенные из реакционной смеси σ-комплексы, которые получили название комплексов Мейзенгеймера:
|
OMe |
MeO |
OEt |
|
|
||
O2N |
NO2 |
O2N |
NO2 |
|
|
EtOK |
K |
|
|
|
|
|
NO2 |
|
NO2 |
Если в субстрате отсутствуют сильные акцепторные заместители, то нуклеофильное замещение у атома углерода бензольного кольца возможно только в случае использования очень сильных нуклеофильных реагентов, являющихся при этом и сильными основными реагентами. В этом случае реализуется двухстадийный
механизм SN2 отщепления-присоединения (EN– AdN).
Примером такого сильного нуклеофила может быть амид калия в жидком аммиаке.
124
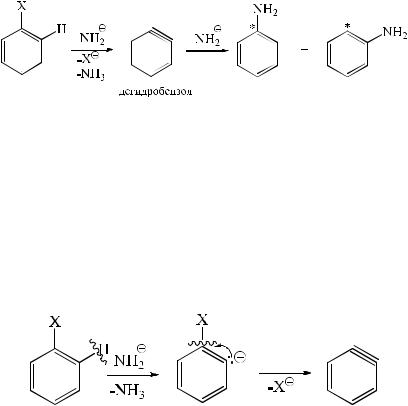
В 1953 г. было установлено, что при действии амида калия на хлорбензол, меченный радиоуглеродом С14 (на схеме эти атомы помечены *), образуются в приблизительно равных количествах анилины, меченные в положении 1 и 2:
Таким образом, было высказано предположение, что реакция идет через образование дегидробензола, и был предложен следующий механизм.
Стадия элиминирования с образованием дегидробензола протекает в два этапа:
1)отщепление протона, находящегося в орто-положении, под действием амид-аниона;
2)отщепление аниона уходящей группы с образованием дегидробензола.
Эту стадию можно представить схемой:
Образующийся дегидробензол является очень реакционноспособной частицей за счет того, что π-связь лежит перпендикулярно р-электронному облаку (боковое перекрывание). Дегидробензол является невыделяемым интермедиатом, но его существование было доказано путем перехвата его в реакционной среде антраценом с образованием триптицена:
125

Стадия присоединения нуклеофила также протекает в два этапа:
1)присоединение амид-аниона к дегидробензолу;
2)отщепление протона образующимся карбанионом от молекулы аммиака с образованием молекулы анилина.
Схема этой стадии имеет следующий вид:
126
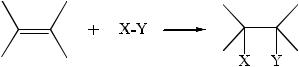
11. РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ПРИСОЕДИНЕНИЯ К ДВОЙНЫМ УГЛЕРОД-УГЛЕРОДНЫМ СВЯЗЯМ
Реакции алкенов и диенов обусловлены характером двойной связи, которая обладает электронодонорными свойствами. Во всех реакциях присоединения к алкенам двойная связь разрывается и две группы присоединяются, образуя две новые σ-связи, суммарная энергия которых намного превышает энергию π-связи. Многие реакции присоединения по двойной связи протекают под действием полярных или легко поляризуемых реагентов. Все эти реакции объединяет механизм их протекания. Исследованию этой группы реакций было посвящено значительное число научных работ, результатом которых стал детально разработанный механизм реакций электрофильного присоединения AdE.
11.1. Реакции электрофильного присоединения к алкенам
В общем виде реакции присоединения можно представить следующей схемой:
Механизм электрофильного присоединения. Присоедине-
ние к алкенам протекает в две стадии. На первой стадии катион или положительно заряженный конец поляризованной молекулы атакует π-электроны двойной связи, образуя π-комплекс. За счет электронов π-связи возникает новая σ-связь, при этом происходит образование карбокатиона. На второй стадии карбокатион взаимодействует с анионом:
127

Первая стадия является скоростьопределяющей и заключается в атаке электрофильным реагентом, поэтому реакцию и называют электрофильным присоединением. Электрофилом может быть любая электронодефицитная молекула.
Вторая стадия протекает быстро. В этой реакции электронодефицитный углерод получает пару электронов, присоединяя образующийся в результате гетеролиза реагента анион.
Первой стадией во многих реакциях AdE является присоединение протона к алкену (кислотная гидратация, присоединение галогеноводородов). В случае атаки кислотой скорость реакции зависит от силы применяемой кислоты. Наблюдается следующая последовательность в легкости протекания реакции: HClO4 > H2SO4 > HX >> CH3COOH. Легкость присоединения галогеноводородов также коррелируется с их кислотными свойствами.
Факт образования карбокатиона подтверждается добавлением в реакционную смесь, помимо реагента, нуклеофила, например спирта. В результате помимо основного продукта реакции образуется продукт атаки карбокатиона нуклеофилом:
128
Стереохимия реакций электрофильного присоединения
калкенам. Реакции электрофильного присоединения галогенов
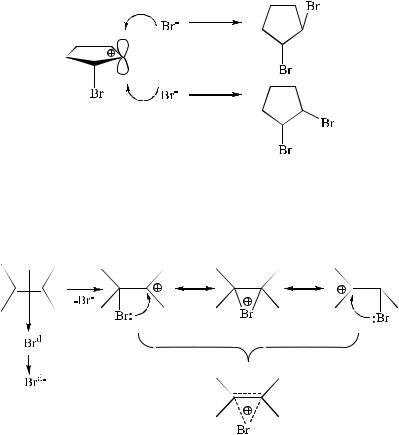
калкенам стереоспецифичны. Например, взаимодействие брома с циклопентеном приводит к образованию исключительно транс- 1,2-дибромциклопентана.
Образование свободного карбокатиона в данном случае не согласуется со стереохимией присоединения, так как вакантная p-орбиталь должна была бы стать объектом равновероятной атаки с обеих сторон. В результате этой атаки должны были бы образоваться и цис-, и транс-изомеры:
Исключительно анти-присоединение (образование транс- изомера) согласуется только с образованием промежуточной циклической структуры, которая, по-видимому, возникает в результате взаимодействия неподеленной пары электронов присоединившегося брома с карбокатионным центром:
129
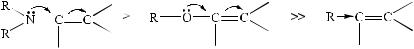
Такой катион получил название бромониевого иона. Последующая нуклеофильная атака бромониевого катиона бромиданионом может происходить только с тыльной стороны, что приводит к образованию продукта анти-присоединения.
Кинетические данные свидетельствуют о том, что скорость всего процесса в целом лимитируется образованием карбокатиона или ониевого катиона, а атака бромом происходит очень быстро.
Реакционная способность двойной связи и направление электрофильного присоединения. Скоростьопределяющей ста-
дией реакции электрофильного присоединения является образование положительно заряженной частицы (бромониевый ион или карбокатион). Из этого следует, что электронодонорные заместители, стабилизирующие ее, будут стабилизировать переходное состояние, предшествующее образованию этих катионов, что приведет к уменьшению энергии активации реакции и, следовательно, к увеличению скорости реакции. Этому будут способствовать положительные индуктивные и мезомерные эффекты заместителей при двойной связи.
Наличие рядом с двойной связью гетероатома, имеющего неподеленную пару электронов (+М-эффект), повышает чувствительность непредельного субстрата к электрофильной атаке:
Противоположный эффект будет наблюдаться при наличии электроноакцепторных заместителей, проявляющих отрицательный индуктивный и мезомерный эффекты. Такие заместители дестабилизируют переходное состояние, предшествующее образованию катионов, повышают энергию активации реакции и, следовательно, снижают ее скорость.
Для несимметричных алкенов направление присоединения электрофильной частицы зависит от устойчивости образующегося карбокатиона.
130
