
книги / Физическая и коллоидная химия. Поверхностные явления
.pdfМинистерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Пермский национальный исследовательский политехнический университет»
Г.А. Козлова, Е.А. Тиньгаева
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ
Утверждено Редакционно-издательским советом университета в качестве учебно-методического пособия
Издательство Пермского национального исследовательского
политехнического университета
2012
УДК 544.77 К59
Рецензенты:
канд. хим. наук, доцент М.М. Соколова (Пермский национальный исследовательский политехнический университет);
начальник отдела теории и методов оценки экологического состояния территорий, д-р хим. наук М.В. Зильберман (УралНИИ «Экология», г. Пермь)
Козлова, Г.А.
К59 Физическая и коллоидная химия. Поверхностные явления: учеб.-метод. пособие / Г.А. Козлова, Е.А. Тиньгаева. – Пермь: Изд-воПерм. нац. исслед. политехн. ун-та, 2012. – 80 с.
ISBN 978-5-398-00869-2
Рассматриваются поверхностные явления: смачивание, адгезия, когезия, капиллярность, адсорбция.
Содержатся теоретические основы дисциплины, контрольные вопросы и методические указания к выполнению лабораторных работ по разделу «Поверхностные явления».
Предназначено для студентов дневного и заочного обучения горно-нефтяного факультета, изучающих дисциплину «Физическая и коллоидная химия».
УДК 544.77
ISBN 978-5-398-00869-2 |
© ПНИПУ, 2012 |
2
|
СОДЕРЖАНИЕ |
|
Введение................................................................................................. |
4 |
|
1. |
Поверхностная энергия.................................................................. |
5 |
2. |
Поверхностное натяжение............................................................. |
8 |
3. |
Смачивание ................................................................................... |
13 |
4. |
Адгезия и когезия ......................................................................... |
16 |
5. |
Капиллярные явления................................................................... |
20 |
6. |
Адсорбция ..................................................................................... |
24 |
7. |
Лабораторная работа № 1. Изучение адсорбции ПАВ |
|
|
на границе раздела жидкость – газ............................................... |
54 |
8. |
Лабораторная работа № 2. Изучение адсорбции на границе |
|
|
твердое тело – жидкость............................................................... |
60 |
9. |
Лабораторная работа № 3. Адсорбция ПАВ на границе |
|
|
твердое тело – жидкость............................................................... |
64 |
10. Лабораторная работа № 4. Изучение явлений смачивания |
|
|
|
и адгезии......................................................................................... |
68 |
Список рекомендуемой литературы................................................... |
72 |
|
Приложение 1....................................................................................... |
73 |
|
Приложение 2....................................................................................... |
75 |
|
3
ВВЕДЕНИЕ
Горные породы, пластовые воды, нефть, газ, отложения минеральных солей, буровые растворы являются дисперсными системами с огромными площадями поверхности раздела между сопряженными фазами, поэтому важную роль в процессах добычи нефти и газа играют поверхностные явления. Одной из задач изучения дисциплины «Физическая и коллоидная химия» является приобретение знаний в области поверхностных явлений, их оценки и использования. Это создает необходимую основу для дальнейшего изучения дисциплин специализации.
Данное издание предназначено в первую очередь для облегчения усвоения студентами содержания дисциплины, приведения изучаемого материала в систему, выделения наиболее нужной и важнойинформации длядальнейшего ее использованияна практике.
Каждый раздел содержит краткое изложение теоретических основ курса, необходимых для выполнения экспериментальной части, вопросы к коллоквиуму по данной теме и лабораторные работы. Кроме того, методическая часть содержит материал, необходимый для правильного оформления лабораторных работ.
4
1. ПОВЕРХНОСТНАЯ ЭНЕРГИЯ
Поверхностные явления
Поверхностный слой вещества представляет собой область постепенного изменения свойств и состава при переходе от одной фазы к другой. Его образование является результатом взаимодействия граничащих фаз. Эффективная толщина поверхностного слоя (δ) лежит в пределах от нескольких единиц до десятков молекулярных размеров.
Все поверхности раздела в зависимости от агрегатного состояния граничащих фаз делят на два типа:
1)подвижные поверхности раздела: между жидкостью и газом (ж– г) и двумя несмешивающимися жидкостями (ж– ж);
2)неподвижные поверхности раздела: между твердым телом
и газом (т– г), твердым телом и жидкостью (т– ж), твердым телом и твердым телом (т– т).
Поверхностными явлениями называют процессы, происходящие на границе раздела фаз. Их причиной служит особое состояние частиц (молекул, атомов, ионов) в слоях жидкостей и твердых тел, непосредственно прилегающих к поверхностям раздела. Эти слои резко отличаются по многим физико-химическим свойствам (удельной энергии, плотности, вязкости, электрической проводимости и др.) от слоев в глубине объема фаз. Отличия обусловлены определенной ориентацией частиц в поверхностных слоях и особым энергетическим состоянием их по сравнению с частицами в объеме.
Рассмотрим поверхностные явления на примере раздела фаз жидкость – газ, например вода – воздух (рис. 1.1).
Межмолекулярные силы, действующие на молекулу воды, располагающуюся в глубине жидкости и окруженную со всех сторон подобными молекулами, проявляются равномерно со стороны соседних молекул. Равнодействующая этих сил равна нулю. На молекулу, находящуюся на поверхности раздела, со стороны граничащих фаз действуют силы разной величины, так как суммарные силы
5
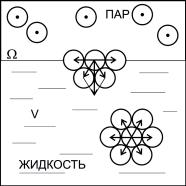
притяжения единицы объема жидкости много больше, чем единицы объема газа из-за его разреженности. Поэтому для поверхностных молекул равнодействующая молекулярных сил не равна нулю. Таким образом, молекулы поверхностного слоя имеют нескомпенсированные силы притяжения и поэтому обладают избыточной поверхностной энергией.
Рис. 1.1. Межмолекулярные силы, действующие на молекулы
вповерхностном слое и в объеме жидкости
Стермодинамической точки зрения такое состояние энергетически невыгодно, поэтому молекулы поверхностного слоя стремятся уйти внутрь жидкой фазы, что приводит к уменьшению площади поверхности раздела фаз. Этим объясняется шарообразная форма мелких капелек и идеально гладкая поверхность жидкости в широком сосуде. Процесс перехода молекул из глубины жидкости на поверхность требует затраты энергии для преодоления сил межмолекулярного взаимодействия. Работа, направленная на увеличение поверхности, переходит в потенциальную энергию молекул поверхностного слоя – в поверхностную энергию.
Классификация поверхностных явлений
Наиболее распространенная классификация поверхностных явлений основана на объединенном уравнении первого и второго на-
6
чал термодинамики, которое для любой гетерогенной системы имеет вид
|
dG = −SdT + Vdp + σ ds+ ∑µ dn+ ϕ |
dq, |
(1.1) |
||||
|
(1) |
(2) |
(3) |
(4) |
(5) |
(6) |
|
где G – |
энергия Гиббса; |
|
|
|
|
|
|
S – |
энтропия; |
|
|
|
|
|
|
T – |
температура; |
|
|
|
|
|
|
V – |
объем; |
|
|
|
|
|
|
p – |
давление; |
|
|
|
|
|
|
σ – |
поверхностное натяжение; |
|
|
|
|
||
s – |
площадь поверхности; |
|
|
|
|
||
µ – |
химический потенциал компонента i; |
|
|
||||
n – |
число молей компонента i; |
|
|
|
|
||
φ – |
электрический потенциал; |
|
|
|
|
||
q – |
количество электричества. |
|
|
|
|
||
В |
уравнении |
(1.1) приращение |
свободной |
энергии |
Гиббса |
||
представлено как алгебраическая сумма приращений различных видов энергии: тепловой, механической, поверхностной, химической и электрической.
Поверхностная энергия σds способна переходить в другие виды энергии, что приводит к возникновению различных поверхностных явлений. Например, превращение поверхностной энергии в энергию Гиббса (4) ↔ (1) сопровождает образование или разрушение межфазной поверхности, что количественно описывается уравнением Кельвина (Томсона). В результате превращения в теплоту (4) ↔ (2) происходит смачивание и адгезия, что количественно оценивается уравнением Дюпре.
Превращение в механическую энергию (4) ↔ (3) связывается с капиллярными явлениями. Основой теории капиллярных явлений служит уравнение Лапласа. Поверхностное явление, называемое адсорбцией, сопровождает превращение поверхностной энергии в химическую (4) ↔ (5) и оценивается уравнением Гиббса.
И, наконец, превращение в электрическую энергию (4) ↔ (6) приводит к электрическим явлениям.
7
2. ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ
Термодинамическое определение поверхностного натяжения вытекает из уравнения (1.1). При постоянных Т, p, n, q имеем
σ = |
|
∂ G |
|
|
|
|
. |
(2.1) |
|
|
||||
|
|
∂ s |
|
|
Поверхностное натяжение есть частная производная от энергии Гиббса по величине поверхности раздела фаз при постоянных значениях температуры, давления, числа молей компонентов и заряда.
Поверхностному натяжению можно дать и другие характеристики – силовую и энергетическую.
1. Энергетический смысл: поверхностное натяжение σ – это поверхностная энергия Гиббса единицы поверхности (удельная энергия Гиббса, удельная поверхностная энергия):
σ = |
Gs |
. |
(2.2) |
|
|||
|
s |
|
|
Она численно равна работе, затраченной на образование единицы поверхности.
2. Силовой смысл: поверхностное натяжение – это сила, действующая по касательной к поверхности и стремящаяся сократить свободную поверхность до минимума при данном объеме.
Применительно к легкоподвижным поверхностям оба определения равнозначны, но первое предпочтительнее, так как имеет более ясный физический смысл. Поверхностное натяжение на границе двух конденсированных фаз обычно называется межфазным натяжением.
Энергетическому и силовому определению поверхностного натяжения соответствует энергетическая и силовая единица измерения σ.
Энергетической единицей является Дж/м2, силовой – Н/м (эрг/см2 или дин/см). Энергетическое и силовое выражения σ эквиваленты, и численная величина совпадает в обеих размерностях.
8

Чем сильнее взаимодействие молекул в данном теле, тем больше его поверхностное натяжение награнице сгазовой фазой (воздухом).
Наименьшим значением σ обладают сжиженные газы, затем идут жидкости, причем, чем выше полярность жидкости, тем выше ее поверхностное натяжение. Еще больше σ у твердых тел.
Поверхностное натяжение у разных жидкостей различно и зависит от природы жидкости, природы граничащей фазы, температуры, давления (если граничащая фаза газ), а также природы и концентрации растворенных веществ.
Таблица 2.1
Поверхностное натяжение индивидуальных веществ на границе с воздухом
|
Поверхностное |
|
Жидкость |
натяжение |
|
|
σ , мДж/м2 |
|
Азот (–193 º С) |
8,27 |
|
Гексан (20 ºС) |
18,41 |
|
Этанол (25 ºС) |
22,3 |
|
Метанол (25 ºС) |
22,6 |
|
Уксусная |
27,6 |
|
кислота(25 ºС) |
||
|
||
Бензол (25 ºС) |
29,4 |
|
Поверхностное |
Жидкость |
натяжение |
|
σ , мДж/м2 |
Глицерин (25 ºС) |
64,7 |
Вода (20 ºС) |
71,9 |
Вода (25 ºС) |
72,8 |
Ртуть (25 ºС) |
473,5 |
Платина (2000 ºС) |
1819,0 |
|
|
Алмаз (20 ºС) |
11400 |
Как видно из табл. 2.1, поверхностное натяжение на границе жидкость – воздух (неполярная газообразная среда) зависит от полярности жидкости. Например, у малополярных жидкостей (бензол) поверхностное натяжение меньше, а у полярных жидкостей (вода) – больше.
Поверхностное натяжение на границе жидкость – жидкость также зависит от природы соприкасающихся фаз: чем больше разность полярностей фаз, тем больше поверхностное натяжение на границе их раздела.
При повышении давления увеличивается взаимодействие поверхностных молекул жидкости с молекулами газовой фазы и уменьшается избыток энергии молекул на поверхности, поэтому
9
с повышением давления в системе жидкость – газ поверхностное натяжение уменьшается.
Поверхностное натяжение жидкостей индивидуальных веществ на границе с газом уменьшается с ростом температуры. При критической температуре граница раздела между фазами исчезает, σ становится равным нулю и система газ – жидкость из гетерогенной превращается в гомогенную, поэтому величина поверхностного натяжения является мерой гетерогенности системы, причем не только газ – жидкость, но и жидкость – жидкость.
На поверхности двух несмешивающихся жидкостей также существует межфазное натяжение σ12, которое в большинстве случаев значительно меньше σ на границе с воздухом, так как наблюдается значительное притяжение со стороны противоположной фазы.
Межфазное натяжение может быть приближенно рассчитано по правилу Г.Н. Антонова. Согласно этому правилу σ12 равно разности между поверхностными натяжениями взаимно насыщенных жидкостей на границе их с воздухом (σ1(2) и σ2(1)):
σ12 = σ1(2) – σ2(1).
Для большинства неполярных жидкостей температурная зависимость σ линейная и может быть представлена соотношением
σТ = σ0 – а∆Т, |
(2.3) |
где σT и σ0 – поверхностное натяжение соответственно при температуре Т и при стандартной температуре;
∆T – разность между данной и стандартной температурами;
a – постоянная, равная температурному коэффициенту α, взятому с обратным знаком.
Методы измерения поверхностного натяжения
Поверхностное натяжение измерено для многих чистых веществ и смесей (растворов, расплавов) в широком интервале температур и составов. Поскольку поверхностное натяжение весьма чувствительно к наличию примесей, измерения разными методиками не всегда дают совпадающие значения. Экспериментально поверхностное натяжение можно определять только в условиях обратимого изменения площади поверхности раздела фаз, т.е. при достаточ-
10
