
книги / Основы биохимии и молекулярной биологии
..pdf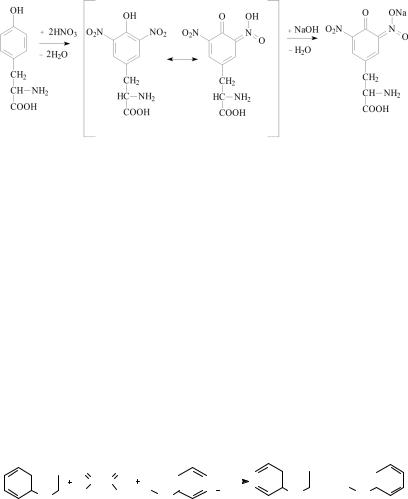
появляется осадок свернувшегося под влиянием кислоты белка, который при нагревании окрашивается в желтый цвет. После охлаждения в пробирку наливают по каплям 10%-ный раствор NaOH до оранжевого окрашивания. Схема процесса имеет вид:
тирозин |
динитротирозин желтого цвета |
натриевая соль динитроти- |
|
|
розина хиноидной структу- |
|
|
ры оранжевого цвета |
Ксантропротеиновая реакция положительна со многими ароматическими соединениями (бензол, фенол и др.). Ксантопротеиновая реакция обеспечивает появление желтого окрашивания при попадании концентрированной азотной кислоты на кожу и ногти.
4. Реакция Адамкевича на триптофан
Метод основан на способности триптофана в кислой среде реагировать с глиоксиловой кислотой с образованием соединения, окрашенного в красно-фиолетовый цвет. При нагревании две молекулы триптофана взаимодействуют с глиоксиловой кислотой с образованием окрашенного соединения:
|
|
|
|
COOH |
|
|
COOH |
|
|
|
|
|
|
COOH |
COOH |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H2N |
|
|
|
|
|
|
|
|
|
NH2 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
CH |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
H2N |
CH |
|
|
|
|
CH NH2 |
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
CH2 |
O |
|
O |
|
CH2 |
|
|
|
|
|
|
|
CH2 |
|
CH2 |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
C |
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
NH |
H |
|
OH |
|
HN |
|
|
|
NH |
|
|
|
|
|
|
HN |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
COOH |
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
триптофан |
глиоксилат |
|
триптофан |
|
|
|
|
продукт конденсации |
||||||||||||||||||||||
51
Для проведения реакции используют ледяную уксусную кислоту, в которой как примесь содержится глиоксиловая кислота. В качестве водоотнимающего средства в реакции используется концентрированная серная кислота.
К 2 каплям исследуемого раствора добавляют 10 капель ледяной уксусной кислоты и осторожно нагревают до растворения выпавшего осадка белка, после чего содержимое охлаждают. Очень осторожно по стенке, наклонив пробирку, подслаивают из пипетки около 1 мл концентрированной серной кислоты, следя за тем, чтобы жидкости не смешивались. На границе двух слоев возникает характерное окрашенное кольцо, которое постепенно распространяется на весь раствор.
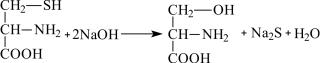
5. Реакция Фоля на аминокислоты, содержащие слабосвязанную серу
Метод основан на способности белков, в состав которых входят цистеин и цистин, в щелочной среде при нагревании образовывать сульфид натрия, который с плюмбитом натрия дает черный или бурый осадок сульфида свинца. Происходят следующие реакции:
Pb(CH3COO)2 + 2NaOH → Pb (OH)2 + 2CH3COONa
Pb(OH)2 + 2NaOH → Na2PbO2 + 2H2O
Na2S + Na2PbO2 + 2H2O → PbS↓ + 4NaOH
В пробирку наливают 10 капель 5%-ного раствора ацетата свинца и по каплям 10%-ный раствор гидроксида натрия до растворения первоначально образующегося осадка. Добавляют 5 капель исследуемого раствора, кипятят и дают постоять
52
1–2 мин. При стоянии появляется бурый или черный осадок сульфида свинца.
Метионин тоже является аминокислотой, содержащей серу, но этой реакции не дает, поскольку сера в нем связана прочно.
Указания к составлению отчета В отчете отразить результаты всех цветных реакций, пока-
зать химизм каждой цветной реакции, сделать вывод о присутствии функциональных групп в исследуемом растворе белка.
Лабораторная работа № 9 Хроматографический метод качественного определения аминокислот
Цель работы – овладеть методом разделения и идентификации аминокислот с помощью радиальной распределительной хроматографии на бумаге.
Теоретические сведения Для изучения аминокислотного состава гидролизатов очи-
щенных белков широко применяют распределительную хроматографию на бумаге – простой, доступный и весьма эффективный метод определения аминокислот.
Метод основан на разной скорости передвижения аминокислот по бумаге в зависимости от коэффициента распределения их между неподвижной (бумага) и подвижной (водноорганический растворитель) фазами хроматографической системы. Водно-органический растворитель, передвигаясь под действием капиллярных сил, одновременно увлекает за собой нанесенные на бумагу аминокислоты, перемещающиеся с различной скоростью. Скорость перемещения зависит от химического строения аминокислот, которое определяет их способность распределяться между подвижной и неподвижной фазами. Если фазовое равновесие для аминокислоты сдвинуто в сторону жидкой фазы, то она будет перемещаться со скоростью, близкой к
53
скорости движения элюента (растворителя). Если, наоборот, аминокислота находится преимущественно в адсорбированном на неподвижной фазе состоянии, то ее скорость будет много меньше скорости движения элюента.
Расположение отдельных аминокислот обнаруживают путем проявления хроматограммы. Для этого высушенную бумагу обрабатывают раствором нингидрина и затем нагревают ее в сушильном шкафу до 100 °С, т.е. проводят качественную нингидриновую реакцию на аминокислоты, находящиеся на бумаге. Положение аминокислоты на хроматограмме характеризуется коэффициентом Rf, который определяют по формуле
Rf = a/b,
где a – расстояние, пройденное аминокислотой от места старта до середины пятна; b – расстояние, пройденное фронтом растворителя от места старта до финиша.
Чем меньше способность аминокислот адсорбироваться на бумаге (неподвижной фазе) и чем больше их растворимость в водно-органическом растворителе, тем быстрее они движутся вслед за фронтом растворителя и тем больше величина Rf, и, наоборот, чем больше способность аминокислот адсорбироваться на бумаге и меньше растворимость в подвижной фазе, тем медленнее аминокислота будет передвигаться и тем меньше Rf. Поскольку отдельные аминокислоты в смеси обладают различной скоростью движения, происходит постепенное их разделение.
Величина Rf, кроме химического строения аминокислот и применяемого растворителя, зависит от сорта хроматографической бумаги, ее плотности и окружающей температуры. Коэффициент Rf является характерной величиной для каждой аминокислоты и постоянен при данных условиях опыта. Сравнивая величины Rf известных стандартных аминокислот со значениями Rf аминокислот, полученными для исследуемой смеси, можно качественно определить состав смеси. Подвергая пятна аминокислот элюированию (растворению) и колориметрированию,
54
можно определить даже крайне незначительные количества аминокислот (до 0,1 мкг).
Исследуемый материал: стандартные водные растворы аминокислот (в 10 мл воды растворяют 40–60 мг аминокислоты): глутаминовой (или аспарагиновой) кислоты, лейцина, аланина; раствор смеси этих аминокислот.
Реактивы:
1)растворитель – смесь н-бутилового спирта, уксусной кислоты и воды в соотношении 15:15:10;
2)0,1%-ный спиртовый или 0,2%-ный ацетоновый раствор нингидрина.
Оборудование:
1)хроматографическая бумага;
2)карандаш;
3)линейка;
4)микропипетка или капилляр;
5)чашка Петри;
6)сушильный шкаф, нагретый до 100–105 °С;
7)пульверизатор.
Ход работы Из хроматографической бумаги вырезают квадрат со сто-
ронами 12 см (больше, чем диаметр чашки Петри) и делят карандашом по диагонали на 4 сектора. В центре карандашом делают круг с радиусом около 1 см – линию старта. В центре делают небольшой вырез. На линию старта в трех секторах микропипеткой наносят капли трех стандартных растворов аминокислот, а в четвертом секторе наносят каплю исследуемой смеси аминокислот. Сектора подписывают карандашом. Квадрат подсушивают на воздухе. В центр квадрата вставляют бумажный фитилек высотой 2 см.
На дно чашки Петри аккуратно наливают 10 мл растворителя, бумажный квадрат накладывают на края чашки Петри так,
55
чтобы фитилек касался растворителя. Чашку Петри закрывают крышкой, желательно равной по диаметру, и оставляют при комнатной температуре до тех пор, пока фронт растворителя не дойдет до краев чашки. Затем снимают крышку чашки Петри, отмечают карандашом фронт растворителя во всех четырех секторах и хроматограмму сушат в сухожаровом шкафу 5–10 мин для фиксации аминокислот и испарения растворителя. Растворитель из чашки Петри сливают в отведенную для этого склянку.
Далее хроматограмму осторожно опрыскивают из пульверизатора раствором нингидрина в вытяжном шкафу. Снова сушат в сухожаровом шкафу для прохождения нингидриновой реакции и проявления отдельных пятен аминокислот в каждом секторе. В секторе с нанесенной смесью аминокислот наблюдается несколько пятен.
Указания к составлению отчета Нарисовать или приклеить в тетрадь хроматограмму. Про-
вести расчеты коэффициента Rf для всех полос на хроматограмме. На основании значений коэффициента Rf сделать вывод о качественном составе исследованной смеси аминокислот.
Лабораторная работа № 10 Количественное определение белка
Цель работы – освоить метод количественного определения белка в биологическом материале и научиться использовать стандартные тест-системы.
Теоретические сведения Для количественного определения белков в биологическом
материале чаще всего используются азотометрия, фотоколориметрия и спектрофотометрия.
Азотометрия основана на определении содержания азота белка после минерализации исследуемого образца. К азотометрии относится классический метод Кьельдаля и его модифика-
56
ции. Эти методы очень трудоемки и не всегда надежны, так как содержание азота в разных белках колеблется от 14 до 19 %.
Фотоколориметрические методы основаны на цветных реакциях на функциональные группы белков. Среди них наиболее широкое применение нашли биуретовая реакция на пептидные группы и реакция Фолина на ароматические радикалы аминокислот. Биуретовый метод является более специфичным, так как ему не мешают примеси – свободные аминокислоты и фенольные соединения. После проведения цветной реакции на белок по светопоглощению окрашенного раствора в монохроматическом свете определяют содержание белка.
Также существует прямой спектрофотометрический ме-
тод определения содержания белка, который состоит в измерении светопоглощения раствора белка в УФ области спектра при длине волны 200–220 нм (пептидные группы белка) и 280 нм (ароматические радикалы аминокислот). Этот метод весьма удобен и не требует предварительного образования окрашенных комплексов, но требуетспециальногооборудования(УФ спектрофотометр).
Для рутинных исследований в биологических и медицинских лабораториях часто пользуются стандартизированными наборами реагентов, так как работа с ними значительно сокращает время анализа (за счет сокращения времени на подготовку реактивов), существенно повышает правильность определения концентраций и упрощает расчетную часть за счет использования метода стандарта. Применительно к нашей задаче существуют наборы для определения концентрации общего белка в сыворотке и плазме крови биуретовым методом (например, Total Protein FL-E отечественного производителя«ВиталДиагностиксСПб»).
Метод основан на способности белка образовывать с ионами меди в щелочной среде окрашенный комплекс, интенсивность окраски которого пропорциональна содержанию белка в исследуемом материале.
Исследуемый материал: водный раствор белка.
57
Реактивы: набор для определения концентрации общего белка в сыворотке и плазме крови биуретовым методом (Total Protein FL-E «Витал Диагностикс СПб» или аналогичный), в который входят:
1.Концентрат биуретового реактива, содержащий гидроксид натрия 0,5 моль/л; калий-натрий виннокислый 80 ммоль/л; калий йодистый 75 ммоль/л; сульфат меди 30 ммоль/л. Концентрат стабилен в темноте при комнатной температуре. Перед проведением анализа необходимое количество концентрата разводят в 5 раз (1 частьконцентрата+ 4 частидистиллированнойводы).
2.Стандарт, содержащий альбумин сывороточный 70 г/л, натрий хлористый 154 ммоль/л. Стабилен не менее года при комнатной температуре.
Оборудование:
1)фотоэлектроколориметр;
2)штатив с пробирками;
3)пипетки на 5 мл и 100 мкл.
Ход работы Берут три пробирки. В первую пробирку (опыт) помещают
5 мл биуретового реактива и 100 мкл исследуемого раствора белка. Во вторую пробирку (стандарт) помещают 5 мл биуретового реактива и 100 мкл стандарта. В третью пробирку (контроль) помещают 5 мл биуретового реактива и 100 мкл дистиллированной воды. Содержимое пробирок перемешивают, выдерживают при комнатной температуре 30 мин.
Содержимое опытной и стандартной пробирки фотометрируют против контроля при длине волны 540 нм в кювете с толщиной поглощающего слоя 1 см.
Указания к составлению отчета Концентрациюобщего белка(г/л) рассчитатьпоформуле
С = (Еопыт/Естандарт) · 70,
58
где Еопыт, Естандарт – соответственно оптические плотности исследуемого (опыт) и стандартного (стандарт) растворов белка после
проведения биуретовой реакции; 70 – концентрация белка в стандартном растворе, г/л.
Лабораторная работа № 11 Осаждение и высаливание белков
Цель работы – овладеть навыками осаждения белков из водных растворов органическими растворителями и выделения белков из водных растворов методом высаливания.
Теоретические сведения Реакции осаждения являются первой стадией процесса
выделения, очистки, качественного и количественного определения отдельных белков. В зависимости от применяемого осадителя реакции осаждения могут быть обратимыми и необратимыми. В случае обратимых реакций белки не подвергаются глубоким изменениям, и получаемые осадки могут быть вновь растворены в первоначальном растворителе, обычно в воде. Белки при этом сохраняют свои нативные свойства. При необратимых реакциях осажденные белки подвергаются глубоким изменениям (денатурации), утрачивают свои биологические и фи- зико-химические свойства, становятся менее гидрофильными и теряют способность растворяться в воде.
Высаливание – процесс осаждения белков солями аммония, щелочных и щелочно-земельных металлов ((NH4)2SO4, Na2SO4, NaCl, KCl, MgSO4, MgCl2 и др.). Все вещества этого ти-
па нейтрализуют заряд белковых молекул и вызывают их дегидратацию, что ведет к коагуляции белковых молекул и их осаждению. Осаждение белков при высаливании является обратимым, при растворении осажденного белка в воде происходит восстановление его исходных физико-химических и биологических свойств.
59
Белки отличаются друг от друга зарядом и гидрофильностью, поэтому можно разделить белки, используя для их осаждения разные концентрации солей в среде. Метод высаливания используют для разделения смесей белков на фракции и определения их соотношения. Осажденную фракцию белка можно отделить центрифугированием или фильтрованием. После этого можно растворить выделенную фракцию и количественно определить ее содержание в исходной смеси с помощью различных методов.
Высаливание применяют также для очистки и получения кристаллических препаратов белков.
Метод высаливания используют как в лабораторной практике, так и в промышленной биотехнологии.
Исследуемый материал: 1%-ный водный раствор яичного белка (белок одного куриного яйца отделяют от желтка и растворяют в 230 мл дистиллированной воды, к которой прибавляют 100 мл насыщенного раствора хлорида натрия; раствор фильтруют через марлю, сложенную в несколько слоев).
Реактивы:
1)этиловый спирт (96 %);
2)10%-ный раствор трихлоруксусной кислоты;
3)насыщенный раствор хлорида натрия;
4)хлорид натрия кристаллический (тонко растертый поро-
шок);
5)сульфат аммония кристаллический (тонко растертый порошок);
6)сульфат аммония (насыщенный водный раствор);
7)сульфат магния кристаллический (тонко растертый порошок);
8)10%-ный водный раствор гидроксида натрия;
9)1%-ный водный раствор сульфата меди;
10)1%-ный водный раствор уксусной кислоты.
60
