
- •Индивидуальные задания к лабораторным работам для студентов химических специальностей Вариант 1
- •Индивидуальные задания к лабораторным работам для студентов химических специальностей Вариант 2
- •Произведите расчеты по уравнению реакции (н.У.):
- •1. Подберите коэффициенты методом электронного баланса в уравнениях реакций:
- •2. Составьте уравнение реакции и подберите коэффициенты методом электронного баланса:
- •Индивидуальные задания к лабораторным работам для студентов химических специальностей Вариант 3
- •Произведите расчеты по уравнению реакции (н.У.):
- •1. Подберите коэффициенты методом электронного баланса в уравнениях реакций:
- •2. Составьте уравнение реакции и подберите коэффициенты методом электронного баланса:
- •Индивидуальные задания к лабораторным работам для студентов химических специальностей Вариант 4
- •Произведите расчеты по уравнению реакции (н.У.):
- •1. Подберите коэффициенты методом электронного баланса в уравнениях реакций:
- •2. Составьте уравнение реакции и подберите коэффициенты методом электронного баланса:
- •Индивидуальные задания к лабораторным работам для студентов химических специальностей Вариант 5
- •Произведите расчеты по уравнению реакции (н.У.):
- •1. Подберите коэффициенты методом электронного баланса в уравнениях реакций:
- •2. Составьте уравнение реакции и подберите коэффициенты методом электронного баланса:
- •Индивидуальные задания к лабораторным работам для студентов химических специальностей Вариант 6
- •Произведите расчеты по уравнению реакции (н.У.):
- •1. Подберите коэффициенты методом электронного баланса в уравнениях реакций:
- •2. Составьте уравнение реакции и подберите коэффициенты методом электронного баланса:
- •Индивидуальные задания к лабораторным работам для студентов химических специальностей Вариант 7
- •Произведите расчеты по уравнению реакции (н.У.):
- •1. Подберите коэффициенты методом электронного баланса в уравнениях реакций:
- •2. Составьте уравнение реакции и подберите коэффициенты методом электронного баланса:
- •Индивидуальные задания к лабораторным работам для студентов химических специальностей Вариант 8
- •Произведите расчеты по уравнению реакции (н.У.):
- •1. Подберите коэффициенты методом электронного баланса в уравнениях реакций:
- •2. Составьте уравнение реакции и подберите коэффициенты методом электронного баланса:
- •Индивидуальные задания к лабораторным работам для студентов химических специальностей Вариант 9
- •Произведите расчеты по уравнению реакции (н.У.):
- •1. Подберите коэффициенты методом электронного баланса в уравнениях реакций:
- •2. Составьте уравнение реакции и подберите коэффициенты методом электронного баланса:
- •Индивидуальные задания к лабораторным работам для студентов химических специальностей Вариант 10
- •Произведите расчеты по уравнению реакции (н.У.):
- •1. Подберите коэффициенты методом электронного баланса в уравнениях реакций:
- •2. Составьте уравнение реакции и подберите коэффициенты методом электронного баланса:
- •Индивидуальные задания к лабораторным работам для студентов химических специальностей Вариант 11
- •Произведите расчеты по уравнению реакции (н.У.):
- •1. Подберите коэффициенты методом электронного баланса в уравнениях реакций:
- •2. Составьте уравнение реакции и подберите коэффициенты методом электронного баланса:
- •Индивидуальные задания к лабораторным работам для студентов химических специальностей Вариант 12
- •Произведите расчеты по уравнению реакции (н.У.):
- •1. Подберите коэффициенты методом электронного баланса в уравнениях реакций:
- •2. Составьте уравнение реакции и подберите коэффициенты методом электронного баланса:
- •Индивидуальные задания к лабораторным работам для студентов химических специальностей Вариант 13
- •Произведите расчеты по уравнению реакции (н.У.):
- •1. Подберите коэффициенты методом электронного баланса в уравнениях реакций:
- •2. Составьте уравнение реакции и подберите коэффициенты методом электронного баланса:
- •Индивидуальные задания к лабораторным работам для студентов химических специальностей Вариант 14
- •Произведите расчеты по уравнению реакции (н.У.):
- •1. Подберите коэффициенты методом электронного баланса в уравнениях реакций:
- •2. Составьте уравнение реакции и подберите коэффициенты методом электронного баланса:
- •Индивидуальные задания к лабораторным работам для студентов химических специальностей Вариант 15
- •Произведите расчеты по уравнению реакции (н.У.):
- •1. Подберите коэффициенты методом электронного баланса в уравнениях реакций:
- •2. Составьте уравнение реакции и подберите коэффициенты методом электронного баланса:
- •Индивидуальные задания к лабораторным работам для студентов химических специальностей Вариант 16
- •Произведите расчеты по уравнению реакции (н.У.):
- •1. Подберите коэффициенты методом электронного баланса в уравнениях реакций:
- •2. Составьте уравнение реакции и подберите коэффициенты методом электронного баланса:
- •Индивидуальные задания к лабораторным работам для студентов химических специальностей Вариант 17
- •Произведите расчеты по уравнению реакции (н.У.):
- •1. Подберите коэффициенты методом электронного баланса в уравнениях реакций:
- •2. Составьте уравнение реакции и подберите коэффициенты методом электронного баланса:
- •Индивидуальные задания к лабораторным работам для студентов химических специальностей Вариант 18
- •Произведите расчеты по уравнению реакции (н.У.):
- •1. Подберите коэффициенты методом электронного баланса в уравнениях реакций:
- •2. Составьте уравнение реакции и подберите коэффициенты методом электронного баланса:
- •Индивидуальные задания к лабораторным работам для студентов химических специальностей Вариант 19
- •Произведите расчеты по уравнению реакции (н.У.):
- •1. Подберите коэффициенты методом электронного баланса в уравнениях реакций:
- •2. Составьте уравнение реакции и подберите коэффициенты методом электронного баланса:
- •Индивидуальные задания к лабораторным работам для студентов химических специальностей Вариант 20
- •Произведите расчеты по уравнению реакции (н.У.):
- •1. Подберите коэффициенты методом электронного баланса в уравнениях реакций:
- •2. Составьте уравнение реакции и подберите коэффициенты методом электронного баланса:
- •Индивидуальные задания к лабораторным работам для студентов химических специальностей Вариант 21
- •1. Подберите коэффициенты методом электронного баланса в уравнениях реакций:
- •2. Составьте уравнение реакции и подберите коэффициенты методом электронного баланса:
- •Индивидуальные задания к лабораторным работам для студентов химических специальностей Вариант 22
- •Произведите расчеты по уравнению реакции (н.У.):
- •1. Подберите коэффициенты методом электронного баланса в уравнениях реакций:
- •2. Составьте уравнение реакции и подберите коэффициенты методом электронного баланса:
- •Индивидуальные задания к лабораторным работам для студентов химических специальностей Вариант 23
- •Произведите расчеты по уравнению реакции (н.У.):
- •1. Подберите коэффициенты методом электронного баланса в уравнениях реакций:
- •2. Составьте уравнение реакции и подберите коэффициенты методом электронного баланса:
- •Индивидуальные задания к лабораторным работам для студентов химических специальностей Вариант 24
- •Произведите расчеты по уравнению реакции (н.У.):
- •1. Подберите коэффициенты методом электронного баланса в уравнениях реакций:
- •2. Составьте уравнение реакции и подберите коэффициенты методом электронного баланса:
- •Индивидуальные задания к лабораторным работам для студентов химических специальностей Вариант 25
- •Произведите расчеты по уравнению реакции (н.У.):
- •1. Подберите коэффициенты методом электронного баланса в уравнениях реакций:
- •2. Составьте уравнение реакции и подберите коэффициенты методом электронного баланса:
- •Индивидуальные задания к лабораторным работам для студентов химических специальностей Вариант 26
- •Произведите расчеты по уравнению реакции (н.У.):
- •Определите химический эквивалент фосфора в следующих соединениях: р2о5, р2о3.
- •1. Подберите коэффициенты методом электронного баланса в уравнениях реакций:
- •2. Составьте уравнение реакции и подберите коэффициенты методом электронного баланса:
- •Индивидуальные задания к лабораторным работам для студентов химических специальностей Вариант 27
- •Произведите расчеты по уравнению реакции (н.У.):
- •1. Подберите коэффициенты методом электронного баланса в уравнениях реакций:
- •2. Составьте уравнение реакции и подберите коэффициенты методом электронного баланса:
- •Индивидуальные задания к лабораторным работам для студентов химических специальностей Вариант 28
- •Произведите расчеты по уравнению реакции (н.У.):
- •1. Подберите коэффициенты методом электронного баланса в уравнениях реакций:
- •2. Составьте уравнение реакции и подберите коэффициенты методом электронного баланса:
- •Индивидуальные задания к лабораторным работам для студентов химических специальностей Вариант 29
- •Произведите расчеты по уравнению реакции (н.У.):
- •1. Подберите коэффициенты методом электронного баланса в уравнениях реакций:
- •2. Составьте уравнение реакции и подберите коэффициенты методом электронного баланса:
- •Индивидуальные задания к лабораторным работам для студентов химических специальностей Вариант 30
- •Произведите расчеты по уравнению реакции (н.У.):
- •1. Подберите коэффициенты методом электронного баланса в уравнениях реакций:
- •2. Составьте уравнение реакции и подберите коэффициенты методом электронного баланса:
Индивидуальные задания к лабораторным работам для студентов химических специальностей Вариант 1
Лаб. раб. 1. Определение чистоты вещества
Какие соединения называют оксидами? Перечислите типы оксидов, укажите их отличительные признаки. Из приведенного перечня соединений выберите оксиды и укажите тип каждого: Na2O2, K2O, Fe3O4, CO, Cl2O, Cs2O, BeO, MnO, KO2, SeO3.
Опишите характерные химические свойства кислотных оксидов. Напишите уравнения реакций следующих превращений: Al2O3 → Al(NO3)3 → NaAlO2 → Al(OH)3 → AlOHCl2 → AlCl3.
Руководствуясь положением элементов в Периодической системе, составьте формулы соединений водорода с хлором, серой, натрием, кальцием, алюминием, кремнием. Приведите названия. К какому классу соединений они относятся?
Лаб. раб. 2. Определение молярной массы эквивалента металла
Произведите расчеты по уравнению реакции (н.у.):
7 г 12 г х, г у, л
Zn(к) + HCl(р-р) → ZnCl2(р-р) + H2(г).
Определите объем 40 г метана СН4 при температуре 180С и давлении 1,2 атм.
Определите химический эквивалент фосфора в следующих соединениях: Р2О5, Р2О3.
Определите химические эквиваленты и молярные массы эквивалентов следующих веществ: Fe2O3, Cu(OH)2, H3PO4, Al2(SO4)3.
Определите число молей и число эквивалентов в 280 г серной кислоты H2SO4.
Лаб. раб. 3. Определение энтальпии реакции
Вычислите ΔH
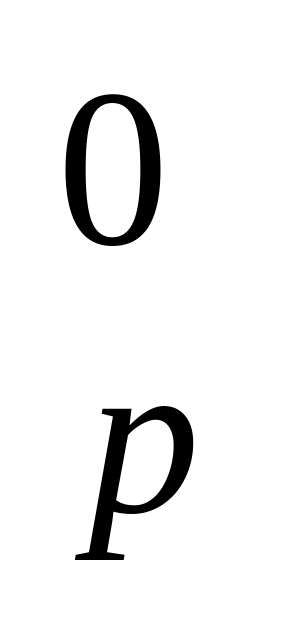 в реакции: PbS(к)
+ O2(г)
↔ PbO(к)
+ SO2(г),
если
в реакции: PbS(к)
+ O2(г)
↔ PbO(к)
+ SO2(г),
если
ΔH0обр, кДж/моль -220 0 -102 -297
Рассчитайте энтальпию образования (ΔH
 )
NH3,
если при образовании 34 г выделилось 92
кДж тепла.
)
NH3,
если при образовании 34 г выделилось 92
кДж тепла.Укажите знак ΔH в процессах: а) горение бензола; б) расщепление углеводородов; в) нейтрализация серной кислоты гидроксидом натрия.
Лаб. раб. 4. Скорость химических реакций. Химическое равновесие
Выразите математически скорости прямой и обратной реакций, протекающих в гомогенной системе: NO + O2 ↔ NO2.
Выразите математически скорости прямой и обратной реакций, протекающих в гетерогенной системе: H2O(г) + Al(к) ↔ Al2O3(к) + H2(г).
Напишите формулу для вычисления константы равновесия реакции: N2(г) + H2(г) ↔ NH3(г).
В каком направлении будет смещаться равновесие обратимой реакции: CaCO3 ↔ CaO + CO2 при повышении температуры?
Лаб. раб. 5. Приготовление растворов заданной концентрации
Какие объемы 8%-го (ρ = 1,055 г/мл) и 70%-го (ρ = 1,617 г/мл) растворов серной кислоты необходимо взять для приготовления 600 мл 33%-го раствора?
Определите молярную концентрацию соли в растворе, полученном смешением 200 мл 0,02 М НСl и 152 мл 0,05 М Ва(ОН)2.
Какой объем воды необходимо прилить к 1 л 0,4 М раствора серной кислоты, чтобы получить 0,03 М раствор?
Лаб. раб. 6. Растворы электролитов
Укажите, какие из солей SnCl2, Na2SO4, Al(CH3COO)3 гидролизуются? Напишите для них молекулярные и ионные уравнения гидролиза. Укажите характер (рН) среды в растворе каждой из солей.
Рассчитайте степень диссоциации борной кислоты HBO3, в 0,01 М растворе, если Кд = 5,8 ∙ 10-10.
Определите рН водных растворов НСl (Кд = 1 · 107) и НСN (Кд = 7,9 · 10-10), если их концентрация равна 0,05 моль/л.
Рассчитайте растворимость AgBr (моль/л) при комнатной температуре, если ПР = 4,4 ∙ 10-13.
Лаб. раб. 7. Окислительно-восстановительные реакции
1. Подберите коэффициенты методом электронного баланса в уравнениях реакций:
Fe(NO3)2 + O2 + H2O → Fe(NO3)2OH
H5IO6 → I2O5 + O2 + H2O
K2Se + NaNO3 → K2SeO4 + NaNO2
2. Составьте уравнение реакции и подберите коэффициенты методом электронного баланса:
монооксид углерода + хлорид палладия (II) + вода → палладий + диоксид углерода + …
Лаб. раб. 8. Электролиз
Напишите уравнения электродных процессов, протекающих в расплаве смеси солей: NaI, MgS. Рассчитайте количества образующихся продуктов на электродах, если пропустили 17 A∙ч электричества.
Составьте схему электролиза водного раствора, содержащего одновременно электролиты MgSO4, CrCl3 с медными электродами, учитывая перенапряжение по водороду и по кислороду. Рассчитайте количества образующихся на электродах веществ, если пропустили 20000 Кл электричества.
