
РЗМ билет 6
.docx1. Спонтанное и вынужденное излучение
Усиленное спонтанное излучение
При переходе атома из возбужденного состояния в основное состояние возможны следующие явления:
• захват излучения;
• сверхизлучение и суперлюминесценции;
• усиленное спонтанное излучение.
Захват излучения: если активная среда является оптически однородной и доля атомов, находящаяся на верхнем уровне мала, то спонтанно испущенный фотон может быть поглощен другим атомом, который, в свою очередь, переходит в возбужденное состояние. Этот процесс уменьшает вероятность спонтанного излучения.
Если в активной среде создана инверсия населенностей, то излучение одного атома может влиять на излучение других атомов. Данный процесс, при определенных условиях, приводит к явлениям сверхизлучения и суперлюминесценции.
Если инверсия населенностей в активной среде достигается критического значения, то в пределах телесного угла вокруг оси активной среды наблюдается интенсивное излучение, называемое усиленное спонтанное излучение

Работа лазера основана на трех фундаментальных процессах, происходящих при взаимодей ствии электромагнитных волн с веществом: их спонтанном и вынужденном излучении и поглощении с преобразованием энергии электромагнитного поля в другие виды.
1. Спонтанное излучение.
Представим себе, что в некоторой среде имеются два энергетических уровня Е1 и Е2 (Е1 < Е2). Это могут быть любые два уровня из неограниченного набора, свойственного некоторой атомной или молекулярной системе. Естественно, что возбужденный атом (или молекула), находящийся на уровне Е2, будет стремиться рано или поздно перейти на более низкий уровень Е1 с выделением избытка энергии. Это может быть электромагнитное излучение с частотой f, определяемой формулой Планка f = (Е2 - Е1)/h, где h - постоянная Планка. В таком единичном акте происходит испускание фотона с энергией Е2 - Е1.
Однако существует и другой, безизлучательный, путь. В этом случае избыток энергии Е2 - Е1 выделяется в какой-либо иной форме (например, разность энергий может перейти в кинетическую энергию окружающих молекул, то есть в тепло).
Скорость перехода частиц с верхнего уровня W, очевидно, прямо пропорциональна (с некоторым коэффициентом А) числу возбужденных частиц N2 на уровне E2, то есть W = AN2. Вот этот множитель А представляет собой вероятность спонтанного перехода и обычно называется коэффициентом Эйнштейна. Выражение для А впервые было получено Эйнштейном теоретически из термодинамических соображений при рассмотрении равновесного состояния системы излучение - вещество.
2. Вынужденное излучение.
Рассмотрим возбужденную систему (случай 1), но когда на систему падает электромагнитная волна с той же частотой f = (E2 - E1)/h. При этом есть определенная вероятность, что падающая волна вызовет переход частицы с верхнего уровня на нижний с излучением волны той же частоты f, которая складывается с падающей волной. Это и есть явление вынужденного излучения. Между процессами спонтанного и вынужденного излучения имеется существенное отличие.
В случае спонтанного излучения атом испускает волну, фаза которой не имеет связи с фазой волны, испущенной каким-либо другим атомом системы. При этом направление волны может быть любым. В случае же вынужденного излучения, поскольку процесс инициируется падающей волной, излучение любой частицы добавляется к этой волне в той же фазе. Падающая волна определяет также и направление распространения испущенной волны.
Вероятность перехода под воздействием излучения, очевидно, не будет константой, поскольку более интенсивная волна вызовет переход большего числа частиц на нижний уровень. Соответственно можно записать Wвын = s(2 - 1)F, где F - плотность потока фотонов, а s(2 - 1) - величина, имеющая размерность площади (она называется сечением вынужденного излучения и зависит от характеристик данного перехода).
3. Поглощение.
Если частица находится на нижнем уровне Е1 и на нее падает электромагнитная волна, то существует конечная вероятность того, что частица перейдет на верхний уровень, поглотив энергию Е2 - Е1. Так же как и в предыдущем случае, можно по аналогии записать вероятность Wпогл = s(1 - 2)F. В этой формуле s - сечение поглощения, которое также зависит только от свойств конкретного перехода. Еще в начале ХХ века Эйнштейн показал, что s(1 - 2) = s(2 - 1), то есть вероятности вынужденных излучения и поглощения равны.
2. Извлечение РЗЭ при переработке лопарита хлорным методом. Какие еще методы? Сравнение.
Хлорный метод переработки лопарита
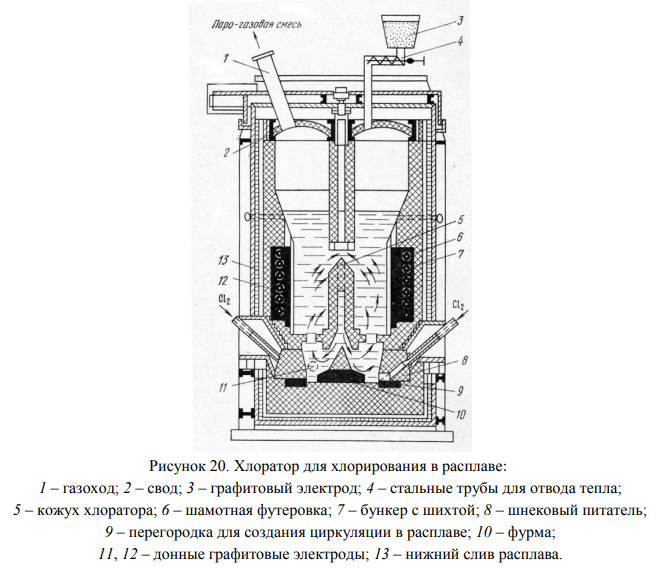
Хлорирование лопаритового концентрата проводят в расплаве (рис. 20). При запуске процесса в качестве расплава используют отработанный электролит магниевых электролизеров. В дальнейшем по мере протекания хлорирования помимо хлоридов натрия, калия и кальция в расплав переходят и хлориды РЗЭ. Примерный состав такого расплава (%): LnCl3 – 55, CaCl2 – 20, NaCl – 15, хлориды других элементов – остальное.
Тонкоизмельченный лопаритовый концентрат и нефтяной кокс (в соотношении 5:1÷7:1) подают на зеркало расплава, через который барботируют хлор. Температура хлорирования составляет 900–1000°С. Проходя через слой расплавленных хлоридов, хлор нагревается и вступает во взаимодействие с диспергированным в расплаве лопаритовом концентратом. Суммарную реакцию хлорирования можно представить следующим образом:

Нефтяной кокс вводят в процесс хлорирования для уменьшения величины ΔGТ 0 (сумма ΔGТ 0 реакций взаимодействия оксидов индивидуальных компонентов лопарита), благодаря чему взаимодействие становится термодинамически вероятным.
Хлориды, образующиеся в процессе взаимодействия лопаритового концентрата с хлором TaCl5,TiCl4, NbCl5, NbOCl3, LnCl3, CaCl2, SiCl4, FeCl3, FeCl2, AlCl3 и т.д., различаются по своей летучести, что позволяет разделить основные ценные составляющие концентрата.
Хлориды тантала, ниобия и титана и др., имеющие сравнительно низкие температуры кипения (табл. 13), в процессе хлорирования переходят в парогазовую смесь (ПГС), которая в дальнейшем поступает в систему конденсации. Как видно из данных табл. 13, к таким хлоридам относятся NbCl5, NbOCl3, AlCl3, TaCl5, TiCl4, FeCl3. Высококипящие хлориды РЗЭ, натрия и кальция остаются в хлораторе в плаве хлоридов. Плав разливают в изложницы, затаривают герметичные контейнеры и направляют на дальнейшую обработку.

Далее парогазовую смесь направляют в конденсатор для улавливания твердых хлоридов ниобия и тантала, которые в дальнейшем поступают на дальнейшую переработку. Тетрахлорид титана и тетрахлорид кремния улавливают в оросительном конденсаторе и после их разделения дистилляцией направляют на производство титановой губки или пигментного диоксида титана.
Плав хлоридов, содержащий хлориды РЗЭ, имеет приблизительный состав, %: Ln2O3 37–45; CaO 7,7–9,2; SrO 1–2; Na2O 7,5–9,2; K2O 0,14–0,24; MgO 0,9–1,0; FeO 0,3–0,5; Th 0,15–0,25; U 0,02. Перед переработкой этот плав необходимо очистить от примесей радиоактивных элементов и железа (рис. 21). Для этого плав растворяют в воде при 60–70°С до получения раствора с суммарной концентрацией оксидов РЗЭ 150–200 г/л.

Отделение тория основано на том, что торий проявляет более кислые свойства, чем РЗЭ. Гидроксид тория выделяется из раствора практически полностью при pH 3,5–4,5, а гидроксиды РЗЭ (+3) осаждаются при pH 6,2–8,2. Вместе с торием осаждаются уран и железо (+3). Нейтрализацию проводят раствором 5 % NaOH до pH 4,0–4,5 при 70–80°С.
Из дезактивированного раствора хлоридов РЗЭ осаждают карбонаты РЗЭ раствором Na2CO3 при 70°С. После чего полученные карбонаты РЗЭ промывают водой. Карбонаты РЗЭ могут быть товарным продуктом или могут быть использованы для получения индивидуальных соединений РЗЭ. Из раствора после осаждения карбонатов РЗЭ доосаждают карбонаты кальция и стронция, используя сухую соду.
Метод хлорирования лопаритового концентрата в расплаве обладает рядом преимуществ по сравнению с сернокислотным способом: высокая степень вскрытия концентрата (>99 %); высокое извлечение ценных компонентов (94– 96 %).
В качестве недостатка следует отметить безвозвратные потери хлора с плавом хлоридов и хлорсодержащими растворами газоочистки.

4.5.2. Сернокислотный метод переработки лопарита
При использовании сернокислотного метода (рис. 22) лопаритовый концентрат разлагают 95 % серной кислотой при температуре 150–250С, расход кислоты составляет 2,78 т на 1 тонну концентрата. Введение на стадию сульфатизации сульфата аммония (0,2 т на 1 тонну концентрата) предотвращает спекание и увеличивает степень извлечения тантала, ниобия и титана в раствор на стадии выщелачивания. При сульфатизации протекают следующие реакции:
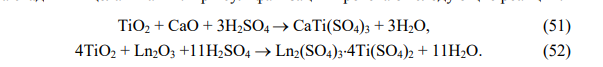
Продукт сульфатизации выщелачивают водой. В результате чего РЗЭ в виде двойных сульфатов (Ln2(SO4)3Na2SO4) и их изоморфной смеси с CaSO4 остаются в твердой фазе, которую отправляют на дальнейшую переработку для извлечения и разделения РЗЭ. Сульфаты титана, тантала и ниобия переходят в раствор. Для отделения титана в сернокислый раствор вводят сульфат аммония, так, чтобы суммарная концентрация серной кислоты и сульфата аммония стала 600 г/л, при этих условиях 70 % титана в виде (NH4)2TiO(SO4)2H2O выпадает в осадок, а сернокислые растворы тантала и ниобия поступают на их экстракционное разделение. Таким образом, сернокислотным способом удается разделить лопаритовый концентрат на отдельные (РЗЭ, титановый, тантал-ниобиевый) продукты. Извлечение тантала, ниобия и РЗЭ при этом не ниже, чем при хлорировании. Несколько снижается извлечение титана, но это снижение можно компенсировать на стадии экстракционного разделения тантала и ниобия. Дальше их можно перерабатывать традиционными способами.


