
колок литий
.docx№1
Сульфатная схема. Достаточно близким по физико-химическим основам к сернокислотному является способ переработки сподумена, заключающийся во взаимодействии его с сульфатом калия. При 1050-1150 ºС сподумен взаимодействует с сульфатом калия, при этом продуктами реакции являются сульфат лития и алюмосиликат калия (искусственный лейцит). Очевидно, что при температуре реакции (выше 1000 ºС) осуществляется α-β переход сподумена и с сульфатом калия фактически взаимодействует β-сподумен.
β-Li(Na)[AlSi2O6]+K2SO4→(Li,Na)2SO4+α-K[AlSi2O6] (32)
α-K[AlSi2O6]↔β-K[AlSi2O6]
При реакции образуются растворимые сульфаты лития и натрия и кубический α-лейцит, который при охлаждении переходит в тетрагональный β-лейцит. Внешняя аналогия формул сподумена и лейцита позволяла рассматривать реакцию как ионообменную. Однако, из-за большого различия в величине ионных радиусов лития (0,09 нм) и калия (0,152 нм) простой обмен ионами невозможен. В данном случае происходят молекулярные преобразования, в результате которых образуется алюмосиликат новой структуры K[AlSi2O6].
Для приготовления шихты концентрат сподумена (4-6 % Li2O) смешивают с техническим K2SO4 в отношении 1:(0,6-1,0) и измельчают в шаровых мельницах, затем шихта поступает на спекание во вращающихся печах. Температура спекания 1050-1100 ºС, продолжительность – 0,5-2 часа, вскрытие сподумена – 92-95 %. После гашения спека он поступает на выщелачивание. Выщелачивание проводят в шаровых мельницах при Т:Ж = 1:2. Раствор выщелачивания содержит 110-150 г/л Li2SO4 и 150-200 г/л K2SO4, а также Na2SO4 и небольшое количество сульфатов магния, алюминия и железа. Очистка раствора состоит в осаждении Mg(OH)2, Al(OH)3 и Fe(OH)3 с помощью NaOH или K2CO3. Далее очищенный раствор упаривают до начала кристаллизации сульфатов калия и натрия в виде глазерита - 3K2SO4∙Na2SO4.
После отделения глазерит используют для приготовления шихты в качестве добавки K2SO4. Из раствора нагретого до 90 ºС осаждают Li2CO3. Для осаждения используют или насыщенный раствор Na2CO3 или кристаллическую соду. Полученный карбонат лития сушат при 130-150ºС до влажности 0,5-1,0 %. Известно, что растворимость карбоната лития в растворе сульфатов щелочных элементов при 90 ºС составляет 15-19 г/л, поэтому его не бывает полным. В связи с этим маточный раствор должен быть использован одним из путей – выделением мирабилита Na2SO4∙10H2O или досаждения лития в виде фосфата Li3PO4 (рис. 14).
Достоинства сульфатного метода – селективность, высокая степень вскрытия и практически полный переход сульфата лития в раствор при выщелачивании. На всех стадиях процесс безвреден. К недостаткам метода следует отнести значительный расход сульфата калия. Попытки замены сульфата калия на сульфат натрия не дает положительных результатов из-за образования в результате реакции стеклообразной массы, или сподуменового стекла. Следует отметить, что вскрытие сподумена сульфатом калия всегда лучше вскрытия любыми смесями, имеющими температуру плавления ниже, чем у K2SO4.

№2
Электрохимическое получение лития. Металлический литий можно получить только электролизом расплавов, электролиз водных растворов невозможен, так как в водных растворах нормальный электродный потенциал лития имеет очень высокое отрицательное значение, вследствие чего на электроде будет выделяться водород (см. табл. 1). Обычно для электролиза используют расплавы галогенидов, однако индивидуальные галогениды лития непригодны из-за высоких температур плавления, при которых давление паров металлического лития становится довольно большим (см. табл. 1). Для снижения температуры плавления электролита используют смесь LiCl и KCl в соотношении 1:1, этот состав близок по составу к эвтектике в системе LiCl – KCl (58,5 мол. % LiCl, Т пл. = 361ºC). Электролиз проводят при 400 - 430 ºC. Напряжение разложения хлоридов магния, кальция и натрия в расплавах меньше напряжения разложения хлорида лития при 700 ºC, В:
MgCl2 CaCl2 NaCl LiCl KCl
2,60 3,38 3,39 3,41 3,53
Эти элементы будут восстанавливаться на катоде раньше лития, и поэтому будут полностью переходить в металл. Напряжение разложения хлорида калия лишь немного больше напряжения разложения хлорида лития (ΔΕ = 0,11 В). Эта небольшая разница сохраняется в широком интер-вале температур, при 405 ºC значения напряжений разложения LiCl и KCl 3,78 и 3,89 В соответственно. Выделение калия на катоде увеличивается при обеднении расплава электролита хлоридом лития, поэтому состав электролита нужно корректировать, не допуская снижения концентрации LiCl ниже 55-57%. Для уменьшения загрязнения металлического лития магнием, кальцием и натрием необходимо использовать исходный хлорид лития высокой степени чистоты.
Для электролиза используют электролизеры с разделенным анодным и катодным пространствами (рис. 17).
Рис.
17.
Электролизер
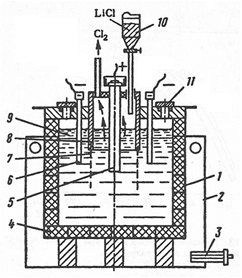
Корпус электролизера стальной, футерован графитом, который устойчив к расплавленному хлориду лития. Графитная футеровка служит около трех месяцев, так как постепенно разрушается из-за образования карбида лития. Более чистый металл получают в электролизерах со стальными водоохлаждаемыми стенками, на которых образуется гарниссаж из затвердевших солей электролита. Аноды графитовые, катоды – из малоуглеродистой стали, но можно использовать и более стойкие материалы (ниобий, тантал). Катодное и анодное пространство разделено диафрагмой из железной сетки. При электролизе литий вследствие меньшей плотности, чем расплав солей (см. табл. 1 и 3) собирается на поверхности расплава электролита в катодном пространстве. Расплавленный литий защищен от соприкосновения с воздухом пленкой расплавленных солей. По мере накопления расплавленного лития он удаляется вручную. Хлор из анодного пространства отсасывается вентиляторами и отправляется на нейтрализацию известковым молоком.
Электролиз характеризуется следующими показателями: выход по току 90-93 %, расход электроэнергии на 1 кг лития до 14 кВт∙ч, извлечение лития до 95 %, напряжение на ванне 6,0-6,6 В. Содержание примесей в электролитическом литии, %: 0,3 – 2,5 Na; 0,02 – 1,50K; 0,02 – 0,12 Al; 0,003 Mg; 0,001 – 0,04 Ca; 0,004 – 0,85 Si; 0,01 Cl.
Электрохимический метод можно использовать для получения сплавов лития с магнием, алюминием, кальцием, свинцом и др. При получении сплавов с легкоплавкими металлами с невысокой плотностью возможны два варианта проведения процесса электролиза. По первому – хлорид соответствующего металла вводится в состав электролита; по второму – из этого металла изготовляется катод, который по мере выделения лития растворяется в нем. Образующийся жидкий сплав собирается на поверхности расплава электролита. Электрохимический метод достаточно эффективен и применяется в промышленных масштабах.
Недостаток метода – необходимый для электролиза хлорид лития – дорогой продукт, получающийся металлический литий загрязнен примесями, главным образом натрием, выде-ляющийся хлор нужно обезвреживать.
