
- •Влияние побочных реакций на свойства осадка и общую эффективность процесса.
- •Преимущества и недостатки процесса электролиза. Промышленная значимость процесса.
- •Электрохимическая поляризация катода – природа, характер зависимости плотности тока от величины поляризации при замедленной электрохимической поляризации.
- •Поляризационная кривая катода.
- •Факторы, влияющие на свойства получаемого порошка.
Схема электролизной ванны.
Схема электролитической ячейки, на которой показаны все рассмотренные элементы устройства и направления движения электронов и ионов, представлена на рис. 1.
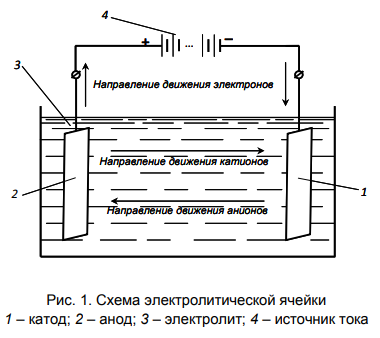
К проводникам какого рода относят электролит, электроды?
В электрохимии электродом называют гетерогенную систему, представляющую собой электронно-проводящую фазу (проводник первого рода), контактирующую с ионным проводником (проводником второго рода) – электролитом.
Какие процессы происходят на электродах при рафинировании меди электролизом (основные и побочные реакции)?
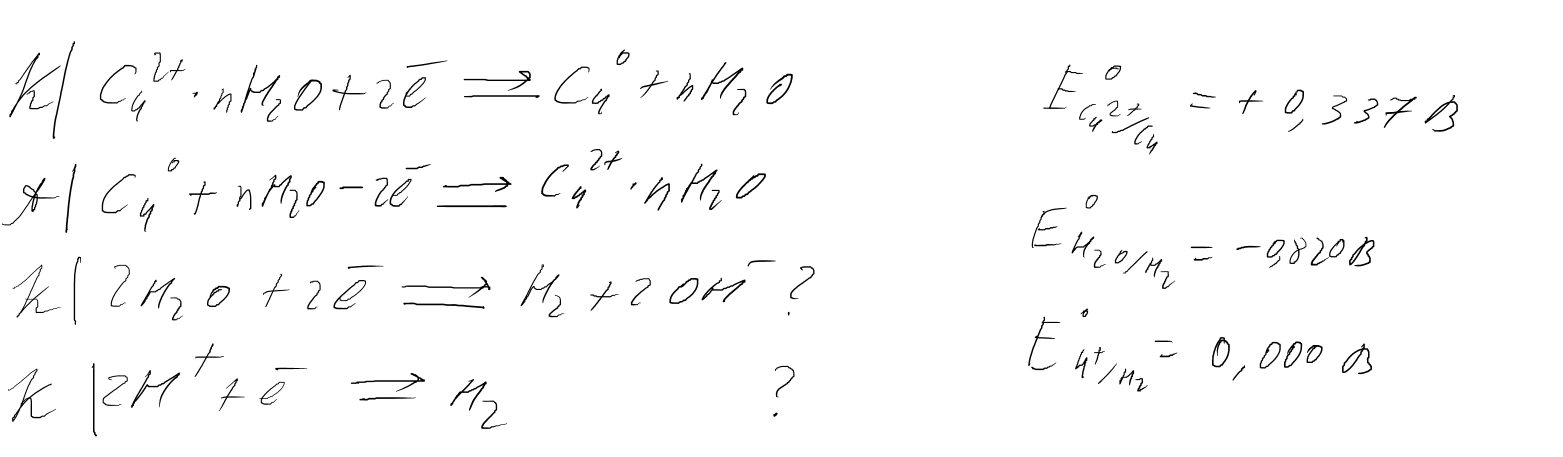
Процесс перехода металла, содержащегося в растворе в виде гидратированных катионов, в металлический катодный осадок включает ряд стадий:
1) подвод гидратированных катионов из объема раствора к поверхности катода (стадия транспорта);
2) адсорбция катионов на поверхности катода, потеря ими гидратной оболочки, присоединение электронов с превращением в атомы металла (стадия разряда);
3) образование атомами металла нового центра кристаллизации или их присоединение к кристаллической решетке уже существующего кристалла (стадия электрокристаллизации).
Выход по току и энергии.
При параллельном протекании на катоде нескольких электродных процессов на осаждение целевого металла расходуется лишь часть тока, проходящего через электролитическую ячейку. Доля тока (обычно выражаемая в процентах), потребляемая целевым процессом, называется выходом по току; величина выхода по току характеризует эффективность использования электрической энергии и может служить критерием при оценке и выборе оптимального варианта электролиза. Выход по току т определяют по формуле:
![]()
Массу меди, которая теоретически должна была бы выделиться за время электролиза, рассчитывают по уравнению (3); электрохимический эквивалент меди равен 1,186 г/(А·ч).
Выход по току определяют отдельно для катодов и анодов. Катодный выход по току т(к) рассчитывают по формуле (9), принимая gпр равным массе медного порошка, полученного при электролизе. При определении анодного выхода по току т(а) в качестве gпр используют массу растворенного на аноде металла.
Выход по энергии W рассчитывают по формуле:
W = (I·t·V)/gпр, (12) где I – сила тока, проходящего через действующий электрод (А); t – продолжительность электролиза (ч); V – напряжение на электролизной ванне (В); gпр – масса медного порошка, полученного при электролизе.
Влияние побочных реакций на свойства осадка и общую эффективность процесса.
При электролизе водных растворов, кроме катиона и аниона растворенной соли, в системе всегда присутствуют ионы, образующиеся при диссоциации растворителя – воды. Поэтому возможны, по крайней мере, два различных катодных процесса – выделение металла и водорода и при растворимом аноде два различных анодных процесса – растворение металла и выделение кислорода, образующегося при окислении молекул воды или ионов ОН– . Если в растворе присутствуют и другие соли, число возможных вариантов электродных процессов дополнительно возрастает.
Электролиз начинается при напряжении, обеспечивающем протекание на катоде реакции, которой соответствует в данных условиях наиболее положительный, а на аноде – наиболее отрицательный электродный потенциал. По мере увеличения тока электролиза потенциал анода все сильнее смещается в сторону положительных, а потенциал катода в сторону отрицательных значений, причем приближение к предельной плотности тока для протекающего катодного процесса приводит к быстрому увеличению поляризации катода. В результате могут возникнуть условия для протекания и других электродных процессов. Тогда наряду с током, обусловленным протеканием первого процесса, через ячейку будет проходить ток, соответствующий скорости второго процесса, и суммарный ток может превысить предельный ток первого процесса.
Преимущества и недостатки процесса электролиза. Промышленная значимость процесса.
Основные достоинства электролиза – высокая селективность, универсальность и простота осуществления, позволяющие получать металлы высокой чистоты, а также покрытия из них, при этом расходуется практически только электроэнергия.
В качестве недостатков, сдерживающих, распространение производства порошков электролизом, следует отметить энергоемкость и невысокую производительность метода.
Основные уравнения для расчета количества получаемого металла и оценки эффективности процесса получения порошка электролизом.
![]()
где gMe – масса выделившегося или перешедшего в раствор металла, кг; MMe – молярная масса металла, кг/моль; kMe = MMe/(zF), кг/Кл, – электрохимический эквивалент данного металла, т.е. масса металла, которая должна выделиться на электроде или перейти в раствор при прохождении через электролитическую ячейку единицы количества электричества.
Выход по току (анодный/катодный):
![]()
где gпр – масса целевого металла, полученная практически, gтеор – масса целевого металла, которая теоретически должна была бы выделиться за то же время.
Выход по энергии W:
![]()
где I – сила тока, проходящего через действующий электрод (А); t – продолжительность электролиза (ч); V – напряжение на электролизной ванне (В); gпр – масса медного порошка, полученного при электролизе.
Электрохимическая поляризация катода – природа, характер зависимости плотности тока от величины поляризации при замедленной электрохимической поляризации.
Подключение к электродам электролитической ячейки Ue > E приводит к смещению потенциалов (поляризации) электродов по отношению к равновесным (отвечающим I = 0) – потенциал анода повышается, а катода понижается.
Поляризация катода способствует преодолению энергетических барьеров, т.е. понижению энергии активации протекающих процессов.
Поляризация катода является движущей силой стадий разряда и электрокристаллизации, и для прохождения через электролизер тока большей плотности необходимо большее понижение потенциала катода.
Удельные скорости разряда и электрокристаллизации по-разному зависят от величины катодной поляризации, т.е. при одной и той же величине поляризации скорость одной из стадий может быть больше, чем другой (соответственно «быстрая» и «медленная» стадии). Для того, чтобы обеспечить требуемую скорость электролиза (заданную величину плотности катодного тока), нужно, чтобы эту скорость обеспечивала не только «быстрая», но и «медленная» стадия, т.е. сдвиг потенциала должен соответствовать движущей силе, необходимой для «медленной» стадии. Очевидно, что эта движущая сила заведомо обеспечит требуемую скорость протекания процесса на «быстрой» стадии. Таким образом, характер влияния величины катодной поляризации на плотность катодного тока отвечает закономерностям «медленной» стадии, и поэтому различают поляризацию при замедленном разряде и поляризацию при замедленной электрокристаллизации.
Фазовая поляризация катода – природа, характер зависимости плотности тока от величины поляризации при замедленной электрокристаллизации.
Электродную поляризацию, связанную с преобладанием процессов разряда (на катоде) или ионизации (на аноде), называют электрохимической, а электродную поляризацию, связанную с электрокристаллизацией – фазовой. При этом поляризацию, относящуюся к процессам, протекающим непосредственно на поверхности электрода, часто называют перенапряжением (электрохимическим или фазовым).
Концентрационная поляризация катода, ее природа, факторы, влияющие на величину. Предельный ток.
Концентрационная катодная поляризация — это снижение потенциала катода чаще всего в связи с недостатком в приэлектродном пространстве того вещества, которое должно восстанавливаться
Смещение потенциала, создающее движущую силу, необходимую для протекания с требуемой скоростью процессов на поверхности электрода, составляет лишь часть электродной поляризации. Дело в том, что при равновесии в ячейке (скорости электролиза, равной нулю) вблизи поверхности электродов концентрация катионов металла такая же, как в объему раствора, а при электролизе восстановление катионов металла на катоде и окисление металла на аноде приводят соответственно к понижению и повышению концентрации (и активности) катионов вблизи поверхности электрода по сравнению с их концентрацией в объеме раствора. А это, согласно уравнению Нернста (1), вызывает дополнительное смещение потенциалов электродов от их равновесного значения. Это смещение, обусловленное отклонением концентрации ионов, определяющих потенциал электрода, вблизи поверхности последнего от их концентрации в объеме раствора, называют концентрационной поляризацией.
Предельный ток — ток электролиза в условиях, когда скорость замедленной (лимитирующей) стадии процесса на электроде достигает предельной величины. На поляризационной кривой предельному току соответствует участок, почти параллельный оси потенциала, то есть ток здесь слабо зависит от потенциала
