
Катализ и катализаторы
.docx-
Катализ и катализаторы- определение, сущность катализа, классификация. Примеры каталитических реакций. Роль катализа в современной промышленности.
Катализ- явление возбуждения хим.реакций веществами- катализаторами.
Катализатор многократно вступает в промежуточное хим. взаимодействие с участниками реакции и восстанавливает свой состав после каждого цикла промежуточного взаимодействия.
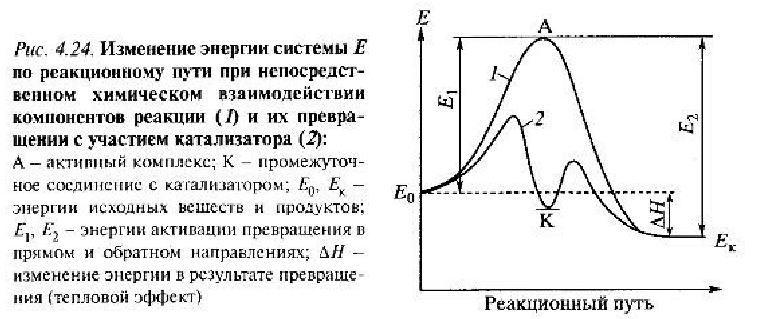


2.Основные понятия кинетики- элементарная стадия, механизм, маршрут, брутто-реакция, скорости реакции и превращения, кинетическая модель.
Стадия гетерогенного катализа - Сложная гетерогенно-каталитич. р-ция протекает через последовательность стадий, традиционно считавшихся элементарными: подвод реагентов из объемной фазы к пов-сти катализатора (диффузия), адсорбция, хим. превращение на пов-сти (собственно катализ), десорбция продуктов, их отвод от пов-сти катализатора (диффузия). Исходными в-вами, реагирующими в элементарных р-циях, по определению, являются промежут. в-ва, к-рые образуются в предшествующих стадиях и не м. б. выделены вместе с реагирующими в-вами или продуктами р-ции.
Путь химической реакции называют механизмом. Это понятие подразумеваетзнание всех этапов превращения из исходных соединений в конечные, природы всехпромежуточных соединений, распределения энергии для всех участников реакции,влияния условий проведения превращения, а в гетерогенной кинетике и свойствповерхности, характера адсорбции реагентов и продуктов, процессов тепло – и массопереноса.
Но чащепользуются понятием скорость химической реакции, определяемой как число частиц,превращающихся или образующихся в реакции, в единицу времени в единице объемареакционного пространства, V.
Скорость превращения: изменение степени полноты реакции или химической переменной во времени: dξ /dt {моль/с}.
3.Основы теории мтационарных скоростей реакции.Пример её исполь3ования при построении кинетической модели каталитической реакции.
В теории стационарных реакций (и основанном на ней методе маршрутов, развитом Темкиным и Хориути) существенно понятие «скорость по базисному маршруту». Вначале определяется число пробегов как число элементарных актов в прямом (и обратном) направлении. Если число пробегов каждой стадии равно ее стехиометрическому числу для данного базисного маршрута, то пробег реакции осуществляется по этому маршруту, в результате чего число молекул — участников реакции — меняется в соответствии с итоговым уравнением маршрута. Скорость реакции по базисному маршруту равна числу пробегов по нему в единице реакционного пространства и составляет лишь часть скорости элементарной стадии, «обслуживающей» этот маршрут. В итоге скорость каждой стадии представляется как линейная комбинация скоростей по базисным маршрутам.
4. Вывод и анали3 кин. моделей каталитических реакций в общем случае(бе3 лимитирующей стадии) и протекающей по ленгмюровскому механи3му,с необратимыми и обратимыми стадиями.
5.Кинетические модели каталитич. Р-ций,протекающих по ударному и ассоциативному механи3мам. Вывод и анали3.
Согласно О.В. Крылову «Гетерогенный катализ», М., ИКЦ «Академкнига», 2004, с.83-84 Д.Или и Э. Ридил показали, что, наряду с адсорбционным, существует также ударный механизм (механизм Или-Ридила) реакции, при котором молекула, не адсорбируясь, вступает во взаимодействие с адсорбированной молекулой или атомом прямо из газовой фазы. Было показано экспериментально, что окисление CO на Pt при высоком давлении кислорода протекает путем удара молекулы СО о слой адсорбированного кислорода, заполняющего поверхность Pt. СО СO2 + + O O O O O O → O O O O O Pt Pt Pt Pt Pt Pt Pt Pt Pt Pt Pt Pt В соответствии с таким ударным механизмом в уравнение скорости реакции войдет давление оксида углерода в первой степени r = kp.
Согласно О.В. Крылову "Гетерогенный катализ", М., "Академкнига", 2004, с.62-63 «Слитные» или «ассоциативные» каталитические процессы протекают в одну стадию по схеме A + B + K → (ABK)* → C + D + K, где (ABK)* – промежуточный, или «активированный», комплекс, находящийся на вершине потенциального барьера. В этом случае реакция протекает через один потенциальный барьер, как и без катализатора, но с пониженным значением Е. Снижение энергии активации при катализе является основной причиной ускорения каталитических реакций по сравнению с некаталитическими.
6.Неодно3начность скорости превращения компонента в кинетич. Режиме.
Это кинетическая область, область, где химические превращения лимитируются внутренней диффузией, область множественности стационарных состояний и, наконец, область внешней диффузии. В кинетической области модуль Тиле мал, наблюдаемая скорость превращений определяется скоростью химической реакции, и фактор эффективности приблизительно равен единице. В этой области реакция ограничивается наружной частью практически изотермической гранулы. Основная доля общего перепада температуры сосредоточена в пограничном слое вблизи частицы катализатора. Дальнейшее увеличение модуля Тиле переводит процесс в область D, где определяющим является массоперенос через пограничный слой. Большое сопротивление межфазному переносу затрудняет достаточно быстрый отвод тепла от поверхности катализатора.
Предположение о том, что скорость всего превращения лимитируется наиболее медленным этапом, вводится, как указывалось выше, для упрощения. Часто более чем один фактор оказывает влияние на наблюдаемую скорость превращения.
Найденные из условий процесса условия реакции позволяют получить наблюдаемую скорость превращения WH - зависимость скорости превращения от условий процесса. Установление этих зависимостей является задачей исследования гетерогенного химического процесса.
7.Де3активация катали3аторов-причины и кинетические модели.
Причины дезактивации катализатора ( или так называемого отравления), наступающей даже при самом строгом соблюдении условий технологического режима, разнообразны и зависят от свойств катализатора, а также от состава и свойств реагирующей смеси.
К причинам дезактивации катализаторов относятся также изменение структуры его поверхности, спекание и другие процессы, которые приводят к уменьшению поверхности или числа активных центров и могут быть вызваны условиями данного технологического процесса, главным-образом температурой.
К причинам дезактивации катализаторов относятся также из - - менение структуры его поверхности, спекание и другие процессы, которые приводят к уменьшению поверхности или числа активных центров и могут быть вызваны условиями данного технологического процесса, главным образом температурой.
Второй причиной дезактивации катализатора является его отравление различными компонентами, содержащимися в сырье крекинга, и, прежде всего, металлоорганическими соединениями, под воздействием которых активность катализатора медленно и необратимо падает. Активность катализатора, утраченная в результате отравления металлами, в процессе регенерации не восстанавливается.
Имеются две причины дезактивации катализатора, которые играют важную роль при газификации: взаимодействие с серой и с минеральными веществами. Совершенно очевидно, что ни один из переходных металлов не способен сохраняться в металлическом состоянии в этих условиях.
Однако чаще причиной дезактивации катализатора служит необратимое отравление его примесями в исходных веществах или продуктами реакции.
Анализ характера протекания процесса во времени позволил предположить, что причины дезактивации катализатора в основном определяются испарением и уносом части активных компонентов соли.
8.Активность катализатора- способы её представления(мера активности). Методы измерения скорости реакции, их применение и организация в кинетических установках.
АКТИВНОСТЬ катализатора, св-во катализатора ускорять хим. р-цию. Количественно активность определяют как скорость р-ции в данных условиях за вычетом скорости той же р-ции в отсутствие катализатора. Значение активности используют в технол. расчетах, для сравнит. оценки катализаторов при их подборе, для характеристики кач-ва катализатора. В технол. расчетах активность обычно выражают через скорость р-ции, отнесенную к единице объема или массы катализатора.
Скорость химической реакции, величина, характеризующая интенсивность реакции химической. Скоростью образования продукта реакции называется количество этого продукта, возникающее в результате реакции за единицу времени в единице объёма (если реакция гомогенна) или на единице площади поверхности (если реакция гетерогенна).
Для измерения скорости химической реакции служат разнообразные методы. Выбор метода определяется характером реакции и её скоростью. Не затрагивая реакций специальных типов (электродные, фотохимические, радиационно-химические), охарактеризуем основные методы измерения скоростей обычных реакций, обусловленных энергией теплового движения. При использовании статического метода реакцию проводят в замкнутом сосуде. О её скорости судят по изменению состава реагирующей смеси на основании анализа проб или по какому-либо свойству реагирующей смеси, зависящему от состава. В случае газовых реакций, сопровождаемых изменением числа молекул, часто следят за реакцией по изменению давления. Проточный метод заключается в том. что реагирующую смесь пропускают с постоянной скоростью сквозь зону реакции: для гетерогенной реакции — это обычно объём, заполненный гранулами катализатора; в случае гомогенной реакции — область повышенной температуры. Степень превращения исходных веществ в продукты определяют по составу смеси, выходящей из зоны реакции.
9.Каталитическая активность и её мера. Определение наилучших условий функционирования катализаторов.
