
лаб9
.docxМИНОБРНАУКИ РОССИИ
Санкт-Петербургский государственный
электротехнический университет
«ЛЭТИ» им. В.И. Ульянова (Ленина)
Кафедра ФКТИ
отчет
по лабораторной работе №9
по дисциплине «Физика»
Тема: исследование термодинамических циклов
Студентка гр. |
|
|
Преподаватель |
|
|
Санкт-Петербург
2021
Цель работы: исследование политропно-изохорно-изотермического (nVT) и адиабатно-изохорно-изотермического(SVT)циклов.
Приборы и принадлежности: баллон с воздухом, манометр, микрокомпрессор, лабораторные термометр и барометр.
Формулы и определения: Cообщённое системе количество теплоты Q расходуется на увеличение внутренней энергии dU системы и совершение системой работы А:
![]()
где CV–теплоёмкость газа в изохорном процессе.

nVT-цикл. Процесс расширения воздуха на участке 12 является политропным, в котором теплоёмкость газа С остаётся постоянной. Первое начало термодинамики для политропного процесса имеет вид:
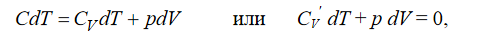
SVT-цикл. Предположим, что процесс расширения воздуха на участке 12 является адиабатным. Адиабатный процесс является одним из видов политропных процессов, он происходит без теплообмена с окружающей средой: Q= 0 и теплоемкость газа в этом процессе С=0. Поэтому показатель политропы в этом процессе равен n cp/cv и называется показателем адиабаты.
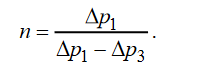
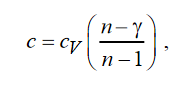
Расчет изменения внутренней энергии и работы газа на участках цикла.
![]()
Работа расширения (сжатия) газа в политропическом A12 и изотермическом A13 процессах может быть рассчитана по формулам:

Расчёт холодильного коэфициента
Для SVT-цикла с учетом Q120 и Q23 A12 холодильный коэффициент равен

а для nVT-цикла в предположении Q120

Расчет изменения энтропии. Функция состояния, дифференциалом которой является отношение Q / T, называется энтропией:
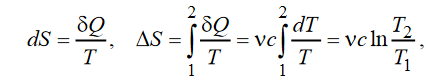
В политропном процессе с учетом уравнения Пуассона:
![]()
В изохорном процессе изменение энтропии с учетом T3 T1 и i5, а также уравнения Пуассона равно:
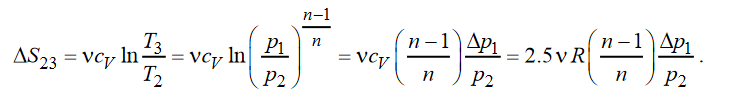
Для SVT-цикла изменение энтропии в адиабатном процессе равно нулю.
Протокол:
p2, Па |
V1, л |
t1, |
T, K |
|
|
|
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
1.
xi |
600 |
580 |
590 |
570 |
590 |
560 |
570 |
580 |
600 |
610 |
ui |
560 |
570 |
570 |
580 |
580 |
590 |
590 |
600 |
600 |
610 |
x ↑ i |
|
10 |
0 |
10 |
0 |
10 |
0 |
10 |
0 |
10 |
Δ xi |
-25 |
-15 |
-15 |
-5 |
-5 |
5 |
5 |
15 |
15 |
25 |
(Δ xi)2 |
625 |
225 |
225 |
25 |
25 |
25 |
25 |
225 |
225 |
625 |
S=5 Δ x=11.3 Δ xср= 23 (p1)=585±23Па
xi |
80 |
100 |
90 |
60 |
70 |
80 |
100 |
110 |
70 |
80 |
ui |
60 |
70 |
70 |
80 |
80 |
80 |
90 |
100 |
100 |
110 |
x ↑ i |
|
10 |
0 |
10 |
0 |
0 |
10 |
10 |
0 |
10 |
Δ xi |
-24 |
-14 |
-14 |
-4 |
-4 |
-4 |
6 |
16 |
16 |
26 |
(Δ xi)2 |
576 |
196 |
196 |
16 |
16 |
16 |
36 |
256 |
256 |
676 |
S= 4,99 Δ x=0.08 Δ xср=0. (p3)=84±23Па
2.

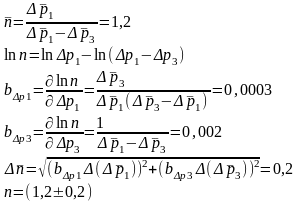
3.
p1=
p2+ 1=102,2*103+585=102785Па
1=102,2*103+585=102785Па
p3= p2+ 3=102,2*103+84=102284Па
4. Определение параметров состояния (p, V, T) в точках 1, 2, 3, 1*, 2*, 3*.
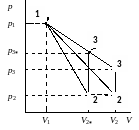
Cостояние 1 (совпадает с 1*):
p1 = p2 + Δp1 = 102785Па
V1 = 22,4 л = 22,4∙10-3 м3
T1 =300,2 K
Состояние 2*: p2*
= p2 = 102200 Па Уравнение
адиабаты: Газ
двухатомный, i
= 5. Уравнение
состояния:
Cостояние
3*: T3*
= T1 = 300,15 K Из уравнения
изотермического процесса 1-3: Процесс
2-3 изохорический, значит V3*
= V2*. Тогда имеем Уравнение
состояния:




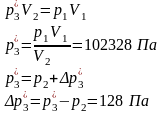
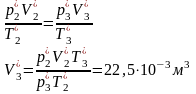
Состояние 2:
p2 = 102200 Па
Уравнение политропы:
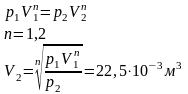
Уравнение состояния:
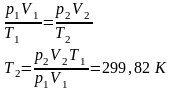
Cостояние 3:
p3 = p2 + Δp3 = 102284 Па
T3 = T1 = 300,2 K
Уравнение состояния:
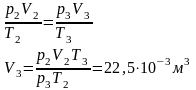
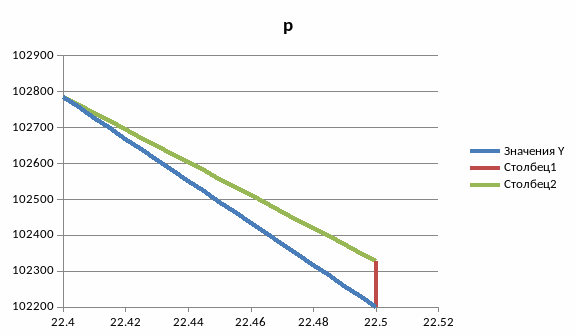
sVT-цикл
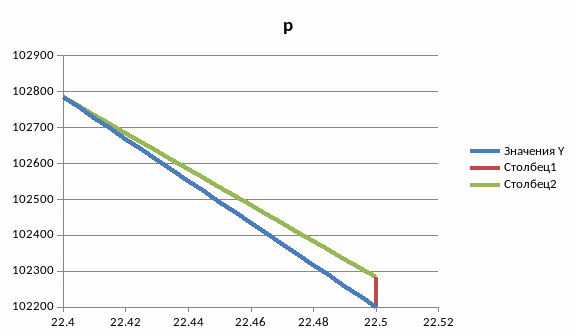
nVT-цикл
6.
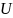 12=
12=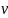 cv(T2-T1)=-7,479
cv(T2-T1)=-7,479
21=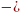 cv(T2-T1))=7,479
cv(T2-T1))=7,479
31=0
A12=(p1V1-p2V2)/(n-1)=14,42
A13=RT1 *ln(V3/V1)=-10
7. Расчет холодильных коэффициентов ε .
Цикл nVT (1-2-3-1):
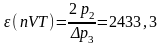
Цикл SVT (1-2*-3*-1):

Так
как Δp3*
> Δp3,
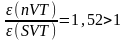 .
.
Обратный цикл Карно (идеальная холодильная машина):
Для
T1, T2: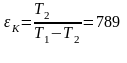
Для
T1, T2*: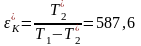
Так
как T2*
< T2,
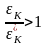 .
.
Холодильные коэффициенты циклов Карно меньше, чем холодильные коэффициенты рассматриваемых циклов в силу идеальности холодильной машины Карно.
8. Определение числа молей воздуха ν в сосуде
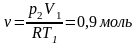
9. cv=(i*R)/2=20,775
cp=((i+2)*R)/2=29,085
c= cv*((n-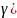 /(n-1))=-20,8
/(n-1))=-20,8
10. Изменение энтропии ΔS в циклах 1-2-3-1, 1-2*-3*-1 (вывод формул – стр. 4).
Цикл nVT (1-2-3-1):
Политропа
1-2 
Изохора
2-3 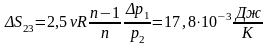
Изотерма
3-1 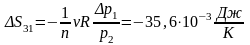
Изменение
энтропии за цикл
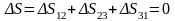
Цикл SVT (1-2*-3*-1):
Адиабата 1-2* ΔS12 = 0
Изохора
2*-3* 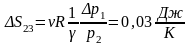
Изотерма
2*-3* 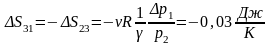
Изменение
энтропии за цикл
Вывод: в ходе работы были рассмотрены политропно-изохорно-изотермический цикл и адиабатно-изохорно-изотермический цикл. Измерены избыточные давления, рассчитаны показатель политропы, давления p1, p3, построены графики nVT и sVT циклов, рассчитаны холодильные коэффициенты, найдено число молей, рассчитана мольная теплоёмкость, изменение внутренней энергии, величина работы газа, изменение энтропии.

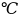
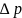 1
1