
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
.pdf
Комплексон II |
HOOCH2C |
|
CH2COOH |
|
N CH2 |
CH2 |
N |
|
HOOCH2C |
|
CH2COOH |
|
1,2-бис[ди(карбоксиметил)амин] |
||
|
или этилендиаминтетрауксусная кислота (ЭДТА) |
||
Комплексон III |
NaOOCH2C |
|
CH2COONa |
|
N CH2 |
CH2 |
N |
|
HOOCH2C |
|
CH2COOH |
|
динатриевая соль ЭДТА или трилон Б |
||
На практике чаще используется трилон Б, так как эта динатриевая соль лучше растворима в воде по сравнению с ЭДТА. Трилон Б образует прочные растворимые в воде комплексы с катионами металлов, так как кроме двух ковалентных связей (при замещении ионов водорода в СООН группах) образуются две дополнительные координационные связи с участием неподеленных пар электронов атомов азота:
OOCH2C |
CH2COO |
|
Na2 O |
N CH2 CH2 N |
O |
C |
CH2 |
CH2 C |
O  Me
Me
 O
O
где Me Mg2+, Ca2+, Sr2+, Ba2+, Mn2+ Fe2+, Cu2+, Zn2+, Pb2+ и др.
Вслучае трехвалентных комплексообразователей (Al3+, Ga3+, Ce3+ и др.) комплексы имеют более сложное октаэдрическое строение.
Внутрикомплексные соединения четырехвалентных металлов отличаются тем, что не имеют внешней сферы, т.е. не являются электролитами.
Если в системе несколько лигандов с одним ионом металла или несколько ионов металла с одним лигандом, способных к образованию комплексных соединений, то наблюдаются конкурирующие процессы: в первом случае лигандообменное равновесие - конкуренция между лигандами за ион металла, во втором случае металлообменное равновесие - конкуренция между ионами металла за лиганд. Преобладающим будет процесс образования наиболее прочного комплекса. Например, в растворе имеются ионы: магния, цинка, железа (III), меди, хрома (II), железа (II) и марганца (II). При введении в этот раствор небольшого количества этилендиаминтетрауксусной кислоты (ЭДТА) происходят конкуренция между ионами металлов и связывание в комплекс железа (III), так как он образует с ЭДТА наиболее прочный комплекс.
Ворганизме постоянно происходят взаимодействие биометаллов (Мб) и биолигандов (Lб), образование и разрушение жизненно необходимых биокомплексов (МбLб):
Мб + Lб ↔МбLб
В организме человека, животных и растений имеются различные механизмы защиты и поддержки данного равновесия от различных ксенобиотиков (чужеродных веществ), и в том числе от ионов тяжелых металлов. Ионы тяжелых металлов, не связанные в комплекс, и их гидроксокомплексы являются токсичными частицами (Мт). В этих случаях, наряду с естественным металлолигандным равновесием, может возникнуть новое равновесие, с образованием более прочных чужеродных комплексов, содержащих металлы токсиканта (МтLб) или лиганды-токсиканты (МбLт), которые не выполняют необходимые биологические функции. При попадании в организм экзогенных токсичных частиц возникают совмещенные равновесия и как следствие - конкуренция процессов. Преобладающим будет тот процесс, который приводит к образованию наиболее прочного комплексного соединения:
МбLб + Мт = МтLб + Мб МтLб + Lт = МбLт + Lб
Нарушения металлолигандного гомеостаза вызывают нарушения процесса обмена веществ, ингибируют активность ферментов, разрушают важные метаболиты, такие, как АТФ, клеточные мембраны, нарушают градиент концентрации ионов в клетках. Поэтому создаются искусственные системы защиты. Должное место в этом методе занимает хелатотерапия (комплексонотерапия).
Хелатотерапия - это выведение токсичных частиц из организма, основанное на хелатировании их комплексонатами s-элементов. Препараты, применяемые для выведения инкорпорированных в организме токсичных частиц, называют детоксикантами (Lg). Хелатирование токсичных частиц комплексонатами металлов (Lg) преобразует токсичные ионы металлов (Мт) в нетоксичные (МтLg) связанные формы, подходящие для изоляции и проникновения через мембраны, транспорта и выведения из организма. Они сохраняют в организме хелатообразующий эффект как по лиганду (комплексону), так и по иону металла. Это обеспечивает металлолигандный гомеостаз организма. Поэтому применение комплексонатов в медицине, животноводстве, растениеводстве обеспечивает детоксикацию организма.
Основные термодинамические принципы хелатотерапии можно сформулировать в двух положениях.
I. Детоксикант (Lg) должен эффективно связывать ионы-токсиканты (Мт, Lт), вновь образующиеся соединения (МтLg) должны быть прочнее, чем те, которые существовали в организме:
Ку(МтLg) > Ку(МбLт); |
Ку(МбLg) > Ку(МбLт) |
II. Детоксикант не должен разрушать жизненно необходимые комплексные соединения (МбLб); соединения, которые могут образовываться при взаимодействии детоксиканта и ионов биометаллов (MбLg), должны быть менее прочными, чем существующие в организме:
Ку(МбLg) < Ку(МбLб)
6. Классы комплексных соединений:внутрикомплексные, макроциклические, многоядерные, сэндвичевые.
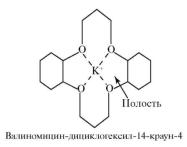
Среди природных комплексных соединений особое место занимают макрокомплексы на основе циклических полипептидов, содержащих внутренние полости определенных размеров, в которых находится несколько кислородсодержащих групп, способных связывать катионы тех металлов, в том числе натрия и калия, размеры которых соответствуют размерам полости.
Рис. 3. Комплекс валиномицина с ионом K+
Такие вещества, находясь в биологических материалах, обеспечивают транспорт ионов через мембраны и поэтому называются ионофорами. Например, валиномицин транспортирует ион калия через мембрану (рис. 3).
С помощью другого полипептидграмицидина А осуществляется транспорт катионов натрия по эстафетному механизму. Этот полипептид свернут в «трубочку», внутренняя поверхность которой выстлана кислородсодержащими группами. В результате получается достаточно большой длины гидрофильный канал с определенным сечением, соответствующим размеру иона натрия. Ион натрия, входя в гидрофильный канал с одной стороны, передается от одной к другой кислородным группировкам, подобно эстафете по ионопроводящему каналу.
Итак, циклическая молекула полипептида имеет внутримолекулярную полость, в которую может войти субстрат определенного размера, геометрии по принципу ключа и замка. Полость таких внутренних рецепторов окаймлена активными центрами (эндорецепторами). В зависимости от природы иона металла может происходить нековалентное взаимодействие (электростатическое, образование водородных связей, ван-
дер-ваальсовы силы) со щелочными металлами и ковалентное со щелочноземельными металлами. В результате этого образуются супрамолекулы - сложные ассоциаты, состоящие из двух частиц или более, удерживаемых вместе межмолекулярными силами.
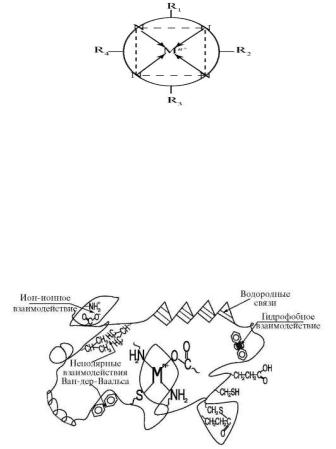
Наиболее распространены в живой природе тетрадентатные макроциклы - порфины и близкие им по структуре корриноиды. Схематически тетрадентный цикл может быть представлен в следующем виде (рис. 4), где дуги означают однотипные углеродные цепи, соединяющие донорные атомы азота в замкнутый цикл; R1, R2, R3, Р4-углеводородные радикалы; Мn+- ион металла: в хлорофилле ион Mg2+, в гемоглобине ион Fe2+, в гемоцианине ион Cu2+, в витамине В12 (кобаламин) ион Со3+.
Донорные атомы азота расположены по углам квадрата (обозначены пунктиром). Они жестко скоординированы в пространстве. Поэтому порфирины и корриноиды образуют прочные комплексы с катионами различных элементов и даже щелочноземельных металлов. Существенно, что независимо от дентатности лиганда химическая связь и строение комплекса определяются донорными атомами. Так, например, комплексы меди с NH3, этилендиамином и порфирином имеют одинаковое квадратное строение и сходную электронную конфигурацию.
Рис. 4. Тетрадентатный макроцикл
Но полидентатные лиганды связываются с ионами металлов гораздо сильнее, чем монодентатные лиганды с теми же донорными атомами. Прочность этилендиаминовых комплексов на 8-10 порядков больше, чем прочность тех же металлов с аммиаком.
Бионеорганические комплексы ионов металлов с белками называют биокластерами - комплексами ионов металлов с макроциклическими соединениями (рис. 5).
Рис. 5. Схематическое изображение структуры биокластеров определенных размеров белковых комплексов с ионами d-элементов. Типы взаимодействий белковой молекулы. Мn+ - ион металла
активного центра
Внутри биокластера имеется полость. В нее входит металл, который взаимодействует с донорными атомами связывающих групп: ОН-, SH-, COO-, -NH2, белков, аминокислот. Наиболее известные металлоферменты (карбоангидраза, ксантиноксидаза, цитохромы) представляют собой биокластеры, полости которых образуют центры ферментов, содержащие Zn, Mo, Fe соответственно.
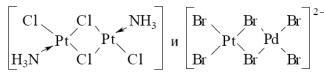
Если комплекс содержит два или более атомов центрального металла, то он называется многоядерным или полиядерным (биядерным, триядерным и т.д.). Так, например, комплекс палладия(II) [PdCl4]2−, имеющий только один центральный атом – атом палладия(II), является одноядерным, а комплекс платины(II) [Pt2(NH3)2Cl2], содержащий два атома платины(II), – биядерным. Если полиядерные комплексы содержат атомы металла одинаковой химической природы, то они называются гомометаллическими; если же в полиядерном комплексе имеются атомы металла-комплексообразователя разной химической природы, то такие комплексы называются гетерометаллическими.
Так, из двух биядерных комплексов первый является гомометаллическим (оба центральных атома – атомы платины(II), а второй – гетерометаллическим (содержит один атом платины и один атом палладия). Если лиганд связан в полиядерном комплексе одновременно с двумя или даже с тремя атомами металла, то такой лиганд называется мостиковым лигандом, как, например, два хлоролиганда и два бромолиганда в вышеуказанных биядерных комплексах. В многоядерных комплексах могут осуществляться также связи металл–металл. Если связей металл–металл достаточно много (обычно – больше трех), то такие комплексы называют «кластерными соединениями» или просто «кластерами» (слово «кластер» в переводе на русский язык означает «рой», «скопление»).
Металлоценами называют дициклопентадиенильные соединения металлов общей формулы M(η5-С5Н5)2. Получены для большинства d-элементов. Имеют структуру "сэндвича"
– металл в степени окисления +2 располагается между двумя лежащими в параллельных плоскостях циклопентадиенильными кольцами на равном расстоянии от всех атомов углерода. В большинстве соединений связь металла с лигандами ковалентна; исключение – манганоцен, где связь обусловлена электростатическим взаимодействием катиона Мn2+ с анионами (С5Н5)-. Частично ионный характер имеют также хромоцен и ванадоцен. В

кристаллическом состоянии ферроцен находится в заторможенной анти-призматической конформации; рутеноцен и осмоцен – в призматической:
Химия металлоценов и их производных и в настоящее время бурно развивается. Металлоцeны нашли широкое применение как катализаторы и сокатализаторы в гомогенных каталитических реакциях, лекарственные препараты, присадки к топливам и маслам, промежуточные продукты в органическом синтезе.
Сами координационные соединения могут выступать в качестве лигандов, если в их структуре есть некоординированные гетероатомы, способные давать координационную связь с другим вступающим в молекулу металлом. В этом случае получают так называемые би- и полиметаллические соединения. Если металлы одинаковы, то их называют гомополиядерными, если разные, то гетерополиядерным. Такие соединения называют еще сверхкоординационными или комплексами комплексов.
7. Устойчивость комплексных соединений в растворах. Константа нестойкости комплекса.
В водных растворах комплексные соединения диссоциируют ступенчато. Различают
первичную и вторичную диссоциацию.
Первичная диссоциация это диссоциация комплексного соединения на комплексный ион и внешнюю сферу:
K4[Fe(CN)6]  4K+ + [Fe(CN)6]4 .
4K+ + [Fe(CN)6]4 .
Первичная диссоциация протекает полностью, это диссоциация сильного электролита. Вторичная диссоциация протекает в очень малой степени из-за высокой прочности
комплексного иона:
[Fe(CN)6]4 Fe2+ + 6CN
Константа химического равновесия для реакции вторичной диссоциации называется
константой нестойкости комплексного иона:
K |
нест |
|
[Fe2 ] [CN ]6 |
|
[[Fe(CN) ]4 ] |
||||
|
|
|||
|
|
|
6 |
Величина, обратная константе нестойкости, называется константой устойчивости комплексного иона:
Kуст K 1 нест
Величины констант нестойкости и устойчивости могут являться мерой термодинамической прочности комплексного иона. Действительно, оценить возможность самопроизвольного протекания процесса диссоциации комплексного иона можно по
величине изменения энергии Гиббса, которая связана с Kнест и Kуст соотношением:
ΔGдисс0 2,303 R T lgKнест 2,303 R T lgK уст
Видно, что чем меньше величина Kнест и чем больше величина Kуст , тем более положительной является изменение энергии Гиббса, и, соответственно, меньшей степень диссоциации комплекса.
Таким образом:
Комплексный ион тем прочнее, чем меньше величина константы нестойкости и чем больше величина константы устойчивости.
Обе константы являются индивидуальными характеристиками комплексных ионов и приведены в справочниках.
8. Представления о строении металлоферментов и других биокомплексных соединений (гемоглобин, цитохромы, кобаламины).
К металлопротеинам относят биополимеры, которые, помимо белка, содержат простетическую группу (компонент небелкового характера), включающую ионы металлов.
Отдельную группу металлопротеинов составляют гемопротеины, содержащие в качестве простетической группы соединения железа. Одним из важнейших гемопротеинов является гемоглобин. Он состоит из белка (глобина) и комплекса железа с порфирином (гема). В геме ион Fe2+ (комплексообразователь), связан с двумя атомами азота, принадлежащими порфириновому кольцу, ковалентной связью, а еще с двумя координационной. Координационное число Fe2+ равно шести: в порфириновом комплексе пятое координационное место занимает гистидиновая группа белка, образуя координационую связь атома азота с Fe2+. В отсутствие кислорода шестым лигандом является вода. В случае, когда вода замещается на кислород, образуется оксигемоглобин. Кроме воды и кислорода ион Fe2+ может связывать и некоторые другие лиганды, например, СО, CN и оксиды азота. Так, с молекулами угарного газа гемоглобин образует карбоксигемоглобин, а с оксидами азота метгемоглобин, содержащий ионы Fe3+. Накопление этих видов гемоглобина в крови приводит к снижению снабжения тканей кровью.

|
|
CH2 |
|
|
|
|
CH |
|
CH3 |
CH2 |
|
|
|
|
|
||
|
CH3 |
N |
N |
CH |
|
|
|
|
CH |
||
|
|
|
|
|
|
H2O или O2 |
|
Fe |
|
N |
C Белок |
|
CH3 |
N |
N |
CH3 |
CH NH |
|
|
|
Гистидин |
||
|
CH2 |
Гем |
CH2 |
CH2 |
|
|
CH2 |
|
|
|
|
O |
C |
|
|
C |
O |
OH |
|
HO |
|||
|
|
|
|||
Рис. 6. Схема образования связей в гемоглобине
Гем в виде гем-порфирина является простетической группой производных гемоглобина:
миоглобина, каталазы, пероксидазы и цитохромов.
Отличительной особенностью гемоглобина (миоглобина) является постоянство степени окисления железа Fe2+. Равновесие:
О2 + гемоглобин оксигемоглобин в легких смещено вправо, а в клетках – влево.
Таким образом, гемоглобин (миоглобин) является переносчиком молекул (Н2О, О2). Транспортные функции выполняют и цитохромы, в которых связь между гемом и
полипептидной цепью осуществляется при помощи остатков цистеина белковой цепи. Однако, в отличие от гемоглобина и миоглобина, механизм их действия основан на
изменении степени окисления железа: |
|
|
|
|
|
Fe2+ |
e |
|
|
|
Fe3+, |
|
|
||||
Fe3+ + |
e |
|
|
|
Fe2+. |
|
|
|
|||
Передавая электроны от цитохрома b к цитохромооксидазе, ионы железа участвуют в процессе окислительного фосфорилирования.
С кислородом и СО цитохромы не взаимодействуют.
Единственным витамином, содержащим в своей структуре металл, является витамин
В12 (кобаламин).
В его состав входит ион Со3+, который находится в центре плоской корриновой системы (подобна порфириновой) и связан с атомами азота восстановленных пиррольных колец. Перпендикулярно плоскости корриновой системы расположен нуклеотидный лиганд, состоящий из 5,6-диметилбензимидазола и рибозы с остатком фосфорной кислоты. Наконец, шестым лигандом является цианид-ион.

Витамин В12 содержится в ферментных системах в виде В12-коферментов или кобамидных коферментов метилкобаламина, содержащего дополнительную метильную группу, и дезоксиаденозин-кобаламина, содержащего 5 -дезоксиаденозинкобаламин.
Так, метил-кобаламин выполняет функции переносчика метильной группы в реакции синтеза метионина. Кроме того, витамин В12 необходим для образования эритроцитов.
Недостаток витамина В12 приводит к нарушениям деятельности нервной системы и вызывает резкое снижение кислотности желудочного сока.
|
|
|
|
O |
|
|
CH3 |
|
O |
|
|
|
H2N |
C |
|
|
|
C |
NH2 |
|
|||
|
|
|
|
CH |
CH |
|
H3C |
CH |
|
||
|
|
H2N |
|
2 |
|
2 |
|
|
2 |
|
O |
|
|
C |
CH2 |
|
|
|
|
CH2 |
CH2 |
||
|
|
O |
|
N |
|
N |
C |
||||
|
|
|
H3C |
+ |
|
|
NH2 |
||||
|
|
H2N |
C |
H C |
Co |
C |
N |
|
|||
|
|
O |
CH2 |
3 |
N |
|
N |
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H3C |
CH |
|
|
CH3 |
|
|
|
|
|
|
|
H2C |
2 |
|
CH2 |
|
|
|
|
|
|
|
|
H3C |
|
CH2 |
O |
|
|||
H C |
|
CH2 |
C |
|
|
|
C |
|
|||
3 |
|
CH |
|
NH |
|
O |
|
|
|
NH2 |
|
|
|
|
|
|
|
|
|
||||
|
|
O |
|
O |
|
|
N |
|
CH3 |
|
|
|
|
|
P |
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OO
 N
N
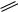
 CH3
CH3
O
HO CH2
Рис. 7. Схема образования связей в витамине B12 (кобаламине)
9. Задачи
Задача 1. Для комплексного соединения [Сr(NН3)5С1]С12 определить заряд комплексообразователя, указать координационное число (к.ч.), дать название по международной номенклатуре, написать уравнения первичной и вторичной диссоциации и составить выражение для константы нестойкости комплексного иона.
Решение. 1) заряд комплексного иона равен +2, следовательно, алгебраическая сумма зарядов внутренней сферы:
x + 0 +( 1) = 2, x = +3;
2)все лиганды монодентатные, следовательно, к.ч. = 6;
3)название: хлорид хлоропентамминхрома (III);
4)уравнения диссоциации:
[Сr(NН3)5С1]С12  [Сr(NН3)5С1]2+ + 2С1 (первичная); [Сr(NН3)5С1]2+ Сr3+ + 5NН3 + С1 (вторичная).
[Сr(NН3)5С1]2+ + 2С1 (первичная); [Сr(NН3)5С1]2+ Сr3+ + 5NН3 + С1 (вторичная).
5) выражение для константы нестойкости:
K нест= |
[ Cr3+ ] [ NH 3]5 [Cl− ] |
|||
|
|
|
. |
|
[[ Cr(NH |
2+ |
] |
||
|
) Cl ] |
|
||
|
|
3 5 |
|
|
Задача 2. Вычислить изменение энергии Гиббса при 250С для процесса диссоциации
комплексного иона [Cd(CN)4]2 , если  .
.
Решение. В соответствии с формулой
ΔG0дисс=−2,303 R T lgKнест=2,303 R T lgKуст получим:
ΔG0дисс=−2,303 R T lgKнест=−2,303 8,31( 25+273)lg7,8 10−18= =97600 Дж/моль=97,6 кДж/моль.
Положительная величина ΔG0дисс означает, что диссоциация комплексного иона [Cd(CN)4]2 при стандартной температуре возможна лишь в очень незначительной степени.
