
ОСНОВЫ ХИМИЧЕСКОЙ КИНЕТИКИ. ГЕТЕРОГЕННЫЕ РАВНОВЕСИЯ
.pdf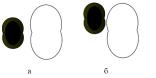
рис.6. Ориентация молекул водорода и йода при их столкновении:
а— благоприятная для реакции;
б— неблагоприятная для реакции
Экспоненциальный множитель е–Ea/RT характеризует долю активных соударений от общего числа двойных соударений. Так как k –это произведение двух сомножителей А и е– Ea/RT, то k (константа скорости) имеет смысл числа активных соударений. Температура влияет на оба сомножителя. При увеличении температуры на 100°С предэкспоненциальный множитель увеличивается в 1,2 раза: экспоненциальный множитель увеличивается в 20 тысяч раз. Следовательно, увеличение скорости реакции при повышении температуры обусловлено главным образом резким увеличением доли активных соударений. Кроме того, повышение температуры ведет к уменьшению степени е, что является математическим подтверждением
увеличения экспоненциального множителя. |
|
|
|
|||
(Чем выше температура, тем < |
Ea |
и тем > A |
1 |
|
) |
|
RT |
eEa / |
RT |
||||
|
|
|
||||
Зная энергию активации, теория активных соударений позволяет рассчитать общее число эффективных соударений, а отсюда — скорость реакции. Но эта теория не объясняет механизм самого соударения, что является ее недостатком.
Влияние температуры на скорость биохимических процессов. С повышением температуры скорость биохимических процессов в определенном интервале температур возрастает. Температурный коэффициент реакции для ферментативных процессов равен 1-2 (исключение составляют два типа реакций: термическая инактивация ферментов и денатурация белков в температурной зоне денатурации, для которых значение γ колеблется от десятков до нескольких сотен). Для каждого фермента имеется свой температурный оптимум, при котором скорость процесса оказывается максимальной; для ферментов животного происхождения он обычно лежит в зоне температур 40-50°С и для растительных ферментов при 50-60°С.
Температура оказывает влияние на отдельные стадии ферментативных процессов (скорость образования и распада комплекса фермент-субстрат (ES), образования продукта (Р) и т. д.) и, таким образом, меняет стационарную скорость реакции.
5. Катализ: гомогенный и гетерогенный. Ферментативный катализ. Уравнение Михаэлиса-Ментен.
Катализ — изменение скорости реакции под действием веществ, которые сами не изменяются ни качественно, ни количественно в конце реакции. Эти вещества называются
катализаторами.
Катализатор не влияет на константу химического равновесия. Он только ускоряет или замедляет достижение химического равновесия, но одинаково влияет на константу скорости прямой реакции и на константу скорости обратной реакции.
Катализатор ведет реакцию по пути с меньшей или с большей энергией активации Еа. Положительный катализатор увеличивает скорость реакции, т. к. уменьшается Еа; отрицательный катализатор уменьшает скорость реакции и увеличивает Еа. Катализатор практически не влияет на общее число соударений, но влияет на энергию активации Еа.
Катализатор может способствовать достижению ориентации, необходимой для взаимодействия молекул. Различают гомогенный и гетерогенный катализ. Катализаторы, которые находятся в системе в том же фазовом состоянии, что и реагенты, называются гомогенными. Механизм гомогенного катализа можно объяснить на основе теории промежуточных соединений. Согласно этой теории, катализатор образует с реагентами промежуточные соединения, которые уменьшают энергию активации реакции. Например, реакция 2SO2 + О2 → 2SО3 в присутствии оксида азота (II) NО может происходить по схеме:
2NO + О2 → 2NO2 (промежуточное соединение) NO2 + SO2 → SO3 + NO
Как видно из системы, в суммарное уравнение реакции катализатор NO не входит, т. е. в результате реакции он не изменяется. В случае гетерогенного катализа катализатор и реагенты находятся в разных фазах и имеют границу раздела. На поверхности твердого катализатора (а точнее на поверхности раздела фаз) реагируют газообразные или жидкие вещества.
Механизм каталитических гетерогенных реакций очень сложен и зависит от природы реакции. Вначале на активных центрах поверхности гетерогенного катализатора происходит процесс хемосорбции молекул исходных веществ, в результате чего происходит:
a) локальное увеличение концентрации молекул исходных веществ на активных центрах;
б) ослабление химических связей в молекулах исходных веществ, что заставляет их распадаться до атомов, которые реагируют друг с другом и образуют молекулу нового вещества, которое покидает поверхность катализатора.

К каталитическим гетерогенным реакциям относятся известные реакции получения аммиака и оксида серы (IV).
N2 + 3H2 → Fe, 500°C 2NH3
2SO2 + O2 → Pt 2SO3
Ферментативный катализ
Химические процессы в живых организмах осуществляются при помощи биологических катализаторов — ферментов. Все известные в настоящее время ферменты являются белками, многие из которых содержат ионы металлов.
Особенности действия ферментов:
1. Высокая каталитическая активность. Ферменты резко снижают Еа
биохимических реакций. |
|
2Н2О2 → Fe2+ 2Н2О + О2; |
Еа = 42 кДж/моль |
2Н2О2 → каталаза 2Н2О + О2 ; |
Еа = 7,1 кДж/моль |
Гидролиз мочевины: кислотой – Еа = 103 кДж/моль; уреазой Еа = 28 кДж/моль.
2.Высокая специфичность и направленность действия. Например, амилаза, которая содержится в слюне, легко и быстро расщепляет крахмал, но не расщепляет сахарозу. Фермент уреаза расщепляет только мочевину.
3.Мягкие условия действия ферментов. Каталитические действие ферментов происходит при температуре 37–40°С, невысоком давлении и определенном значении рН.
4.Отсутствие побочных эффектов в биохимических реакциях с участием ферментов. Общая схема действия ферментов не отличается от обычных катализаторов.
где Е — энзим (фермент); S — субстрат [ES] — фермент-субстратный комплекс; Р — продукт реакции; k1, k2, k3, k4 — константы скорости реакций.
Скорость ферментативного процесса можно рассчитать по уравнению Михаэлиса-
Ментен:
v v |
|
|
|
|
C(S) |
|
, |
|
max |
k |
s |
C(S) |
|||||
|
|
|
||||||
|
|
|
|
|
|
|
||
где С(S) – концентрация субстрата; |
|
|
|
|
|
|
|
|
vmax – максимальная скорость реакции, т. е. скорость, когда весь фермент находится в составе фермент-субстратного комплекса.

Из уравнения Михаэлиса-Ментен можно сделать следующие заключения:
а) при большой концентрации субстрата скорость реакции будет практически равна
максимальной скорости, т. е. v vmax ;
б) при малой концентрации субстрата скорость реакции будет прямо пропорциональна его концентрации, т. е.:
v vmax C(S)ks
Уравнение Михаэлиса-Ментен довольно точно описывает только начальный период ферментативного процесса, так как в нем не учитывается влияние и взаимодействие с ферментом продуктов реакции.
6. Химическое равновесие. Обратимые и необратимые реакции.
Существуют обратимые и необратимые реакции. Необратимые реакции идут преимущественно в одном направлении и заканчиваются образованием осадка, выделением газа или образованием слабых электролитов.
Обратимые реакции идут в прямом и обратном направлении. Примером обратимой реакции может служить взаимодействие водорода с йодом:
Обратимая реакция характеризуется скоростью прямой реакции (Vпр.) и скоростью обратной (Vобр.). Состояние системы, когда Vпр. = Vобр., называется химическим равновесием. Концентрации исходных веществ и продуктов реакции в состоянии химического равновесия системы называются равновесными концентрациями.
7. Константа химического равновесия. Прогнозирование смещения химического равновесия.
Связь между равновесными концентрациями исходных веществ и продуктами реакции выражается константой химического равновесия (Кх.р.). Например, для реакции аА + вВ сС + dD константа химического равновесия равна:
Константа химического равновесия — это отношение произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ в степенях, равных их стехиометрическим коэффициентам. Константа химического

равновесия характеризует глубину протекания реакции, т. е. степень превращения исходных веществ в продукты реакции. Если Кх.р. >> 1, то в состоянии химического равновесия в системе присутствуют продукты реакции, т. е. степень превращения исходных веществ в продукты реакции большая. Если Кх.р.<< 1, то степень превращения исходных веществ в продукты реакции мала, т. е. продуктов реакции образуется очень мало.
Константа химического равновесия зависит от температуры и природы реагирующих веществ, но не зависит от концентрации всех веществ, которые участвуют в реакции. Соотношение равновесных концентраций продуктов реакции и исходных веществ известно как математическое выражение закона действующих масс.
Способы выражения константы химического равновесия:
1. Для растворов неэлектролитов и сильно разбавленных растворов электролитов используется константа Кс. Например, для реакции:
СН3СООН + С2Н5ОН СН3СО–ОС2Н5 + Н2О,
Кс равна:
где СЭА, CH2O, СCH3COOH, CС2H5OH – концентрация (моль/дм3) этилацетата, воды, уксусной кислоты и этанола соответственно.
2. Для сильных электролитов пользуются активностью a. Например, для реакции: NaCl Na+ + Cl– ,
Ка запишется:
где aNa+, aCl−, aNaCl активность ионов Na+ и Cl–, хлорида натрия соответственно.
3. Когда реагируют газы константа химического равновесия записывается через парциальные давления исходных газов и продуктов реакции, и обозначается как Кр. Например, Кр для реакции Н2(г) + I2 (г) 2 HI(г).
Запишется:
где РНI, РН2, РI2 — парциальные давления газов.
При изменении условий – температуры, давления и концентрации реагирующих веществ — химическое равновесие смещается. В основе смещения химического равновесия
лежит принцип французского ученого Ле-Шателье (1884 г.): «При изменении внешних
условий химическое равновесие смещается в сторону той реакции (прямой или обратной), которая уменьшает это внешнее воздействие».
Определим, в какую сторону смещается равновесие реакции
2SО2(г) + О2(г) 2SО3(г) + Q
При изменении температуры, давления и концентрации веществ. Заметим, что прямая реакция – экзотермическая, а обратная реакция (2SО3→2SО2 + О2 – Q) – эндотермическая. При повышении температуры равновесие смещается в сторону эндотермической реакции, которая ослабляет повышение температуры. При понижении температуры равновесие смещается в сторону экзотермической реакции, которая ослабляет понижение температуры. При повышении давления равновесие смещается в сторону уменьшения числа молекул, т. е. в сторону образования SО3. При понижении давления равновесие смещается в сторону увеличения числа молекул, т. е. в сторону образования SО2 и О2.
В равновесной системе N2(Г) + О2(Г) 2NO(Г) равновесие при изменении давления не смещается, так как число молекул газов в правой и левой частях уравнения этой реакции одинаково. Не влияет давление на равновесие и тогда, когда все реагирующие вещества находятся в жидком или твердом состоянии. При увеличении концентрации какого-либо вещества равновесие смещается в сторону уменьшения концентрации этого вещества.
8. Гетерогенные равновесия. Константа растворимости. Условия образования и растворения осадков.
Гетерогенные равновесия – это равновесия, которые устанавливаются в гетерогенных системах. Гетерогенные системы состоят из нескольких фаз, разделенных реальными физическими границами раздела фаз. Примеры гетерогенных систем: газ - жидкость, твердое тело — жидкость, твердое тело-газ. Гетерогенные системы всегда многофазные.
Фаза – это часть системы с одинаковыми химическими и физическими свойствами. Константа растворимости. Рассмотрим гетерогенную систему, состоящую из
малорастворимого осадка сильного электролита и насыщенного раствора над ним, между которыми устанавливается динамическое химическое равновесие. При контакте осадка (например, BaSO4) с водой в системе протекают процессы:
1)растворения – полярные молекулы воды переводят часть ионов из кристаллической решетки BaSO4 в жидкую фазу;
2)осаждения –– под влиянием электростатического поля кристаллической решетки BaSO4 часть ионов Ва2+ и SO42- переходят из жидкой фазы в твердую, достраивая кристаллическую решетку соли.

С течением времени скорость растворения станет равной скорости осаждения и установится динамическое равновесие между кристаллическим осадком малорастворимой соли BaSO4 и его водным раствором, содержащим ионы Ва2+ и SO42-:
BaSO4(к) Ba2+(p) + SO42− (p)
Раствор, находящийся в равновесии с твердой фазой, состоящей из BaSO4, называют насыщенным относительно осадка. Такой раствор представляет собой равновесную гетерогенную систему.
Применим к этому равновесному гетерогенному процессу закон действующих масс. Так как ВаSO4 – малорастворимый сильный электролит, то используем кажущуюся концентрацию (активность):
В химии активность а твердой фазы принято считать равной единице и она является постоянной величиной. Произведение двух констант дает новую постоянную величину, которую называют термодинамической константой растворимости и обозначают К0S.
Эту величину часто называют произведением растворимости и обозначают ПР.
Таким образом, в насыщенном растворе малорастворимого сильного электролита произведение равновесных активностей его ионов есть величина постоянная при данной температуре.
Раствор, находящийся в равновесии с осадком BaSO4 является насыщенным, но сильно разбавленным. В разбавленных растворах сильных электролитов коэффициент активности fa →1, и a→С. В таком случае активности ионов можно заменить их молярными концентрациями и термодинамическая константа растворимости К0S перейдет в концентрационную константу растворимости KS.
Уравнение последнее выражение уравнение будет иметь вид:

где С — равновесные концентрации катионов и анионов (моль/л) в насыщенном растворе малорастворимого сильного электролита.
Если малорастворимый сильный электролит образует при диссоциации несколько ионов, то в выражения К0S и KS входят активности (концентрации) ионов в соответствующих степенях.
Примеры:
Для упрощенных расчетов пользуются концентрационными константами растворимости KS, принимая fa = 1.
В общем виде концентрационная константа растворимости для реакции АmВn mАn++ nВm–
запишется:
Для упрощения расчетов пользуются концентрационными константами КS, принимая fa
= 1.
Взаимосвязь между растворимостью и К0S. Растворимость вещества – это равновесная концентрация ее в растворе. Количественно растворимость различных веществ выражается концентрацией насыщенных растворов. Растворимость данного вещества равна его молярной концентрации в насыщенном растворе (молярная растворимость вещества): S моль/л. Растворимость часто также выражают в граммах растворенного вещества на 100 г растворителя или в граммах растворенного вещества на 1 л раствора.
Растворимость твердых веществ зависит от природы растворенного вещества, растворителя, температуры и т. д.
Связь между величиной К0S и растворимостью зависит от числа ионов, на которые распадается малорастворимый сильный электролит в растворе.
Сравнивая величинуК0S однотипных (1 моль разных малорастворимых сильных электролитов образует при растворении одинаковое число моль ионов) электролитов можно качественно оценить растворимость осадков.
Осадок |
К0S (25°С) |
AgCl |
1,8·10–10 |
AgBr |
5,3·10–13 |
AgI |
8,3·10–17 |
Из приведенных галогенидов серебра наименее растворим AgI, наиболее – AgCl
Условия образования и растворения осадков
Зная концентрации ионов в растворе, можно предположить направление гетерогенного процесса. Пусть у нас имеется равновесная гетерогенная система:
AgCl Ag+ + Cl–.
Вэтой системе насыщенный раствор будет при условии, если С(Ag+)·С(Сl–) = КS. В другом случае раствор будет ненасыщенным, если С(Ag+)·С(Сl–) < КS. Происходит растворение осадка или сдвиг равновесия в данной гетерогенной системе вправо. Осадок AgCl будет выпадать, когда С(Ag+)·С(Сl–) > КS.
Таким образом, осадок выпадает в том случае, если произведение концентрации ионов малорастворимого сильного электролита будет больше величины концентрационной константы растворимости КS.
Процесс образования осадка – это последовательный процесс, который можно разделить на три основные стадии:
1) возникновение зародышей кристаллизации;
2) рост кристаллов из зародышей;
3) агрегация кристаллов с образованием поликристаллического осадка.
Эти стадии протекают с разной скоростью. Вот почему при С(Ag+)·С(Сl–)> КS не всегда образуется осадок хлорида серебра AgCl. Последняя стадия может продолжаться несколько часов или даже суток. Растворение осадка или сдвиг равновесия вправо может быть осуществлен с помощью любого метода уменьшения концентрации свободных катионов Аn+ или свободных анионов Вm–:
1) связыванием этих ионов в другой менее растворимый осадок;
2) связыванием ионов металла в комплекс;
3) связыванием аниона в малодиссоциированную кислоту;
4) окислением или восстановлением катиона или аниона.
Конкурирующие равновесия в гетерогенных системах. В реальных системах редко приходится сталкиваться со случаями, когда имеет место только одно гетерогенное равновесие. Присутствие в биологических жидкостях большого числа ионов приводит к тому, что одновременно могут образовываться несколько малорастворимых электролитов.
Однотипные конкурирующие равновесия. Допустим, имеется гетерогенная равновесная система
СаSO4 Ca2+ + SO42–
Вэту систему добавим раствор хлорида стронция SrCl2. Образуются два однотипных конкурирующих равновесия.

Кs (СаSO4) = 2,5·10–5 Кs (SrSO4) = 3,2·10–7
При Кs(СаSO4) > Кs(SrSO4) и составимых концентрациях анионов происходит преимущественно образование SrSO4. Конкуренцию за общий ион «выигрывает» тот малорастворимый электролит, который имеет меньшее значение Кs.
Если в растворе в равных концентрациях присутствуют SO42– ионы и СО32− -ионы, то при введении в раствор ионов кальция Са2+ в осадок в первую очередь переходит СаСО3, т. к. Кs(СаCO3) < Кs(CaSO4).
Таким образом, в общем случае катион М+ может образовывать два малорастворимых электролита с анионами А– и В–: МА и МВ. При Кs(МА) = Кs(МВ) и равных исходных концентрациях А– и В– будет происходить одновременное образование МА и МВ в равных количествах.
При Кs(МА) > Кs(МВ) и сопоставимых концентрациях анионов происходит преимущественное образование МВ. Отсюда следует: чем меньше константа растворимости, тем раньше (т. е. при меньшей концентрации) начнет выпадать осадок. Сравнение значений констант растворимости имеет смысл только в том случае, если рассматриваемые электролиты дают при ионизации одинаковое число ионов. Например:
1.AgJ, AgCl, CaSO4, BaSO4.
2.Ag2CrO4, PbCl2, Ag2CO3, PbI2.
3.Ca3(PO4), Ba3(PO4).
При рассмотрении конкурирующих гетерогенных равновесий с участием разнотипных электролитов СаСО4 и Са3(РО4)2 математический аппарат усложняется.
