
- •2022 Весна. Общая химическая технология Вопросы для подготовки к экзамену
- •I. Теория химических процессов
- •Химические процессы
- •II. Теория химических реакторов
- •III. Химико-технологическая система и основы разработки эффективных хтс
- •Классификация элементов хтс проводится по их назначению.
- •Классификация связей (потоков)
- •Типы или структура связей
- •Модели хтс
- •Формы представления балансов:
- •Свойства хтс:
- •Система с фракционным рециклом
- •Концепция более полного использования сырьевых ресурсов решается путём:
2022 Весна. Общая химическая технология Вопросы для подготовки к экзамену
Введение
Химическая технология, определение.
Химическая технология – это естественная прикладная наука о наиболее выгодных способах и процессах переработки, в которой преобладают химические и физико-химические явления, что приводит к коренному изменению свойств и строения веществ.
Как наука химическая технология имеет:
- объект изучения – химическое производство (способы и процессы переработки исходных веществ в полезные продукты);
- цель изучения – разработка эффективного способа производства необходимых человеку продуктов;
- методы исследования – экспериментальный, математическое моделирование и системный анализ.
Химическое производство – это совокупность функциональных отделений подсистем), связанных между собой технологическими, электрическими, транспортными и информационными потоками, обеспечивающая получение нужных продуктов с использованием химических превращений.
Компоненты химического производства делятся на переменные и условно-постоянные:
— переменные: сырьё, вспомогательные материалы, энергия, продукты (целевой и побочные), отходы матернальные, энергетические;
— усповно-постоянные: оборудование, аппаратура, трубопроводы; здания, сооружения; приборы ковтроля, управления, система безопасности, обслуживающий персонал.
Показатели химического производства:
Технические

Экономические определяют экономическую эффективность производства:
капитальные и удельные затраты (проект, площадка, оборудование, монтаж коммуникации и т.д.,)
себестоимость продукции
прибыль или доход
Эксплуатационные показатели определяют качество процесса в период эксплуатации:
надежность – свойство отдельных элементов ХП выполнять заданные функции в пределах нормативными документами периода времени. Часто характеризуется продолжительностью безаварийной работы или числом аварийных остановок за год.
безопасность функционирования (пожаро-взрывобезопасность), т.е. отсутствие риска возникновения форсмажорных обстоятельств при соблюдении технологического регламента.
чувствительность, характеризуется степенью отклонения какого-либо выходного параметра, (например, температуры в реакторе) при изменение входного параметра.
устойчивость характеризует способность оборудования стабильно работать в заданном режиме при кратковременном наложении на них возмущений.
управляемость и регулируемость – способность оборудования откликаться на управляющее воздействие при минимальном времени запаздывания.
Социальные
экологическая безвредность – отсутствие вредных выбросов и стоков, переход на безотходные производства.
безвредность (или безопасность) обслуживания, т.е. соответствие условий труда требованиям ТБ и охраны труда.
степень автоматизации и механизации, минимизация ручного труда.
I. Теория химических процессов
Физико-химические закономерности
Стехиометрические соотношения.
Они позволяют:
1) Рассчитать количества веществ, принимающих участие в химическом превращении т.е. являются основой расчетов материальных и тепловых балансов;
2) Провести расчет показателей (расходные коэффициенты, степень превращения, селективность и другие)
Стехиометрическое уравнение — это форма представления взаимодействия веществ, которая показывает, в каком соотношении вещества вступают во взаимодействие друг с другом.
расчет количеств реагирующих веществ.
Простая и сложная реакция.
Стехиометрическое уравнение для простой реакции (описывается одним уравнением) имеет вид:
![]()
Реагенты А, В расходуются, продукты R, S образуются в соответствии с их стехиометрическими коэффициентами. Уравнение (1) можно представить также в форме алгебраического уравнения:
![]()
Сложная реакция, состоит из нескольких частных реакций, описываемых стехиометрическими уравнениями следующего вида:
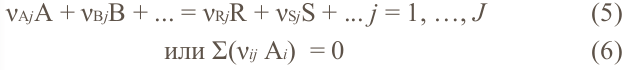
где индекс j относится к j-й частной реакции. В уравнении (6) стехиометрический коэффициент vij может быть равен 0, если это вещество не участвует в данной реакции.
Важно! Для количественных расчётов сложной реакции необходимо использовать только стехиометрические независимые уравнения.
Базисная система линейно независимых уравнений химических реакций, назначение, примеры.
Такая система однозначно и полно описывает процесс. Доказано, что она должна содержать число уравнений, равное: для окислительно-восстановительных реакций
У = В – Э (7)
для обменных реакций
У = В – Э + 1 (8)
где У — число уравнений в базисной системе; В — число веществ (участников химического превращения); Э — число химических элементов, из которых состоят вещества.
Пример
Окисление аммиака кислородом воздуха до оксида азота как целевого продукта сопровождается протеканием ряда побочных реакций. Общее превращение аммиака можно представить в виде, схемы, состоящей из 4 реакций:
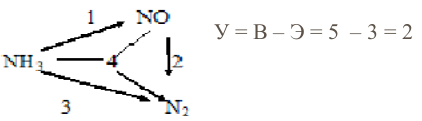
Расчет состава реагирующей смеси на основе балансового стехиометрического соотношения.
Определение и расчетные формулы для концентрации, в том числе, для реакций с изменяющимся объемом.
Степень
превращения
– отношение количества, превращенного
исходного вещества
![]() к
его начальному количеству N0
к
его начальному количеству N0
Степень превращения может быть определена для любого исходного реагента, например, В:
![]()
Используя степень превращения ключевого вещества, можно определить по уравнению количество i-го вещества, израсходованного или образовавшегося в результате протекания реакции (1) в соответствии с (3):
![]()

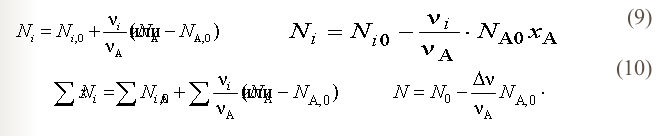

Выход продукта - отношение количества исходного вещества, превращенного в продукт к исходному
количеству этого вещества.
Для продукта R:

Для простой реакции: ER=xA
Для
сложной реакции, например, будет ER=
SRxA
будет ER=
SRxA
Селективность (избирательность)
Интегральная селективность по продукту — отношение количества исходного вещества, превращенного в данный продукт, ко всему количеству превращенного реагента. Если R-целевой продукт:
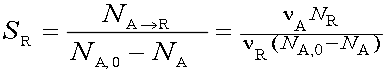
Термодинамические закономерности.
Расчет константы равновесия и равновесного состава смеси

Способы управления равновесием экзо− и эндотермических химических реакций (влияние температуры, давления, избытка реагента и т.д.), примеры.
Влияние температуры, давления, избытка реагента на Кр и хр

а – экзотермическая
б – эндотермическая
Кинетические закономерности.
Понятия скорости реакции и скорости превращения вещества для простой и сложной реакции.
Скорость реакции – отношение количества превращённого вещества к объему смеси, времени и стехиометрические коэффициенты.
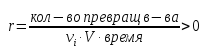
Всегда одинакова, не зависит от вещества, по которому считают
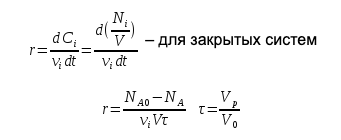
Скорость превращения вещества – количество вещества превращающегося в единицу времени в единице реакционного пространства.
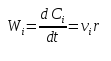


Кинетическое уравнение, порядок реакции.
Кинетическое уравнение, или кинетическая модель, реакции — зависимость скорости реакции от условий ее протекания.
Формы кинетических уравнений весьма разнообразны. Методы построения кинетических моделей и способы определения ее параметров являются предметом специального раздела физической химии.
Для элементарной реакции А + В= R +..., т.е. протекающей в одну стадию, кинетическое уравнение строится на основе закона действующих масс:
r = kCACB а в общем виде: r = kf(C)
Схема превращения и её отличие от базисной системы линейно независимых уравнений химических реакций.
Схема превращения показывает реальные взаимодействия между компонентами — пути превращения — в реагирующей системе.

Схема превращения состоит из частных реакций, или этапов. В отличие от стехиометрических, кинетические уравнения не могут быть записаны произвольно, и их число должно соответствовать реальным путям превращения компонентов.
