
Типы экзаменационных задач
.docxЗаконы термодинамики
n моль идеального газа находятся при температуре Т и давлении Р. Определите работу, изменение внутренней энергии и энтропии в процессе изотермического расширения газа до объема V2.
Рассчитайте изменение энтропии и внутренней энергии при изотермическом смешении двух идеальных газов заданного количества при температуре Т, если каждый газ находился при давлении Р, суммарный объем системы после смешения V.
На основании справочных данных рассчитайте изменение энтальпии и энтропии нагревании вещества от
 до
до
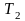 :
а) считать теплоемкость вещества
постоянной, б) учитывая зависимость
теплоемкости от температуры.
:
а) считать теплоемкость вещества
постоянной, б) учитывая зависимость
теплоемкости от температуры.Вещество заданного количества испаряются при температуре нормального кипения, а затем изотермически расширяются до давления Р2. Рассчитайте изменение энергии Гиббса (энтропии) в этом процессе.
Пользуясь справочными данными, рассчитайте тепловой эффект (изменение энтропии) реакции, протекающей при температуре Т и постоянном давлении (объеме): а) считать теплоемкости веществ постоянными, б) учитывая зависимость теплоемкости от температуры.
Пользуясь справочными данными, рассчитайте стандартное изменение энергии Гиббса и энергии Гельмгольца для реакции, протекающей при температуре Т.
Рассчитайте абсолютную энтропию вещества при температуре Т и давлении Р (воспользуйтесь справочными данными).
Химическое равновесие
Для реакции СО+Н2О = Н2+ СО2 дана зависимость (взять из справочника):
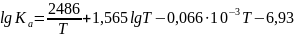
Вывести уравнение зависимости теплового эффекта реакции от температуры и рассчитать значение теплового эффекта при температуре Т.
Равновесное давление Н2О(пар) по реакции Ca(OH)2(тв) = CaO(тв)+ Н2О(пар) равно 100 мм. рт. ст. при t=450оС и 400 мм. рт. ст. при t=531оС. Найти среднее значение ∆Н в данном интервале температур.
Константа равновесия реакции H2 + I2 = 2HI при 717К равна 46,7. Определить количество (в молях) разложившегося HI при нагревании 1 моль HI до 717 К.
Константа равновесия реакции: Fe3O4(тв)+ СО=3FeO тв)+ СO2 при 600оС равна 1,15. Смесь 1 моля Fe3O4, 2-х молей СО, 0,5 моль FeO и 0,3 моль СO2 нагрета до 600оС при общем давлении 5 атм. Определить количество каждого вещества при равновесии.
При 550 К и общем давлении 1 атм. степень диссоциации фосгена COCl2 = CO + Cl2 равна 80%. Определить КР и КС.
Для реакции N2O4 = 2NO2 при 55оС КР=1,38∙105 Н/м2. Сколько молей N2O4 следует поместить в сосуд с ёмкостью 10 л для того, чтобы при равновесии концентрация NO2 в нём была 0,1 моль/л?
Степень диссоциации PCl5 при 473 К и р=1 атм. равна 0,485, а при 523К и том же давлении – 0,8. Рассчитать ∆Н реакции: PCl5 = PCl3 + Cl2 в интервале 473 – 523К.
При смешении 1 кмоль А с 1 кмоль В в результате реакции А + 2В = АВ2 в равновесной смеси образовалось 0,2 кмоль АВ2. Определить численное значение КР при общем давлении 105 Н/м2, если все вещества находятся в идеальном газообразном состоянии.
Пользуясь справочными данными рассчитать КР реакции SO2+Cl2= SO2Cl2 при 298К. Все вещества считать идеальными газами.
Фазовое равновесие в однокомпонентных системах
Определить температуру кипения этилового спирта при давлении
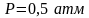 ,
если его нормальная температура кипения
,
если его нормальная температура кипения
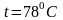 .
Принять, что в интервале температур
.
Принять, что в интервале температур
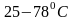 теплота испарения спирта
теплота испарения спирта
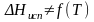 .
Воспользуйтесь справочными данными.
.
Воспользуйтесь справочными данными.Рассчитайте изменение энтропии при изотермическом испарении 0,0332 кг CBr4 при нормальном давлении, если зависимость давления насыщенного пара от температуры выражается уравнением
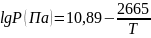
Вычислите теплоту испарения хлора при нормальной температуре кипения (взять из справочника), если давление насыщенного пара над жидким хлором определяется уравнением:
 .
.При нормальном давлении и температуре плавления 234,3 К жидкая ртуть имеет плотность 13,69 г/см3, а твердая – 14,19 г/см3. Рассчитайте температуру плавления ртути при давлении 3,78∙107 Па, если теплота плавления равна 9,74 Дж/г.
Рассчитайте мольный объем (м3/моль) жидкого дейтерия при 18,65 К, если тангенс угла наклона касательной к кривой зависимости температуры плавления от внешнего давления при этой температуре
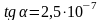 К/Па,
теплота плавления 196 Дж/моль,
а мольный объем кристаллического
дейтерия составляет 20,5 см3/моль.
К/Па,
теплота плавления 196 Дж/моль,
а мольный объем кристаллического
дейтерия составляет 20,5 см3/моль.
Фазовое равновесие в двухкомпонентных системах
Определите температуру начала кипения системы, содержащей 400 г CCl4 и 500 г С2Н5ОС2Н5.
Сколько граммов и какого компонента можно выделить в чистом виде при ректификации
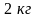 смеси
смеси
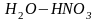 ,
содержащей 40% (мольн.) воды (Р., рис.28.8,
стр. 39).?
,
содержащей 40% (мольн.) воды (Р., рис.28.8,
стр. 39).?Пар имеет массовый состав: 30% CCl4 и 70% С2Н5ОС2Н5. Найдите состав жидкости (в моль.%), находящейся в равновесии с этим паром.
Какого компонента и сколько (в граммах) нужно добавить к смеси, содержащей 8 молей воды и 2 моля азотной кислоты, чтобы получить азеотропную смесь?
Растворы
Определите парциальный молярный объём метилового спирта, если плотность 60%-ного водного раствора спирта при 293 К равна 0,8946 г/см3. Парциальный молярный объём воды в этом растворе 16,8 см3/моль.
Определить изменение объёма при образовании 1 моля раствора метилового спирта в воде из чистых компонентов. Р=1атм, Т=293К,
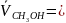 39,7
см3/моль,
39,7
см3/моль,
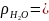 0,9982
г/см3,
0,9982
г/см3,
 0,7915
г/см3.
0,7915
г/см3.
Зависимость объёма раствора хлорида натрия от количества молей соли n2, растворенной в 1000 г воды, выражается уравнением:
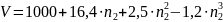 (см3)
(см3)
Р=1 атм, Т=293К. Определить парциальные мольные объёмы воды и соли в трехмольном растворе.
Раствор толуола в бензоле можно считать совершенным раствором. Мольная доля толуола в растворе 0,2; t=60oC.
Найти: 1) относительные химические потенциалы компонентов в растворе;
2) изменение энергии Гиббса при образовании 1 моля раствора из чистых компонентов;
3) изменение энтропии при образовании 1 моля раствора;
4) изменение объёма при смешении;
5) теплоту смешения.
Дана смесь этанола и хлороформа при 35оС. Когда мольная доля этанола в жидкости (
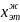 )
равна 0,2, общее давление пара над
раствором равна 304,22 мм. рт. ст. При этом
мольная доля этанола в парах
)
равна 0,2, общее давление пара над
раствором равна 304,22 мм. рт. ст. При этом
мольная доля этанола в парах
 равна 0,1382. Давление насыщенного пара
над чистым хлороформом
равна 0,1382. Давление насыщенного пара
над чистым хлороформом
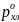 равна 295,11 мм. рт. ст., а над этанолом
равна 295,11 мм. рт. ст., а над этанолом
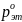 =102,78
мм. рт. ст.
=102,78
мм. рт. ст.
Найти: 1) активности компонентов раствора;
2) коэффициенты активности;
3) относительные химические потенциалы компонентов;
4) изменение энергии Гиббса при образовании 1 моля раствора из чистых компонентов.
Рассчитайте изменение энергии Гиббса, энтропии и энтальпии при образовании идеального раствора из 50 г н-гексана и 50 г н-гептана при 298К.
Температура замерзания чистого бензола 278,5К, а температура замерзания раствора, содержащего 0,2242 г камфоры в 30,55 г бензола, равна 278,254К. Криоскопическая постоянная бензола 5,16К. Определите молекулярную массу камфоры.
Температура замерзания разбавленного водного раствора тростникового сахара 272,171К. Давление пара чистой воды при этой температуре 568,6 Па, а теплота плавления льда 6029 Дж/моль. Вычислите давление пара раствора.
Рассчитайте осмотическое давление 0,01 молярного раствора Na2SO4 при 300К. Кажущаяся степень диссоциации α=0,88.
На основании справочных данных о парциальном давлении пара компонентов в системе этанол-бензол (Р., табл. 20) рассчитайте активности и рациональные коэффициенты активности каждого компонента в растворе с концентрацией
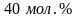 этанола. Сделайте вывод о характере
отклонений от закона Рауля. Паровую
фазу рассматривать как смесь идеальных
газов.
этанола. Сделайте вывод о характере
отклонений от закона Рауля. Паровую
фазу рассматривать как смесь идеальных
газов.
