
Контрольная ТКДС
.docx
1.Характеристики наполнителей: форма частиц, дисперсность, удельная поверхность. Основные модельные формы частиц, их количественные характеристики (соотношение размеров, коэффициенты формы в уравнениях D=f(Sуд) и Эйнштейна). Классификация наполнителей по размерам частиц. Экспериментальные методы определения размеров частиц и Sуд.
Форма частиц зависит от кристаллической решетки и от способа получения. От этого зависит прессуемость (насыпная плотность) и микробиологическая активность.

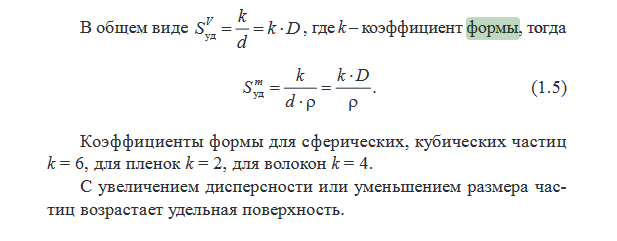
2. Лиофильность поверхности наполнителей, коэффициент гидрофильности, метод определения. Гидрофильно-гидрофобная мозаичность, методы ее определения.
Лиофильность поверхности определяет интенсивность взаимодействия молекулы дисперсионной среды с дисперсной фазой.
Гидрофильные (полярные) имеют полярные частички SiO2- на поверхности возникают силоксановые группы, (SiOH)- силанольные группы будут взаимодействовать с водой, поверхность является гидрофильной
Гидрофобные (неполярные) - углеродные материалы, полимеры (тефлон), нет полярных групп
Фильность определяется теплотой смачивания- количество энергии, выделяющейся при смачивании единицы поверхности твердого тела данной жидкостью. ∆Нсм [Дж/м2]
Коэффициент
гидрофильности
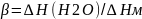 (полярная жидкость- вода, неполярная
жидкость- масло)
(полярная жидкость- вода, неполярная
жидкость- масло)
∆Н [Дж/г]- можно не определять удельную поверхность
Если
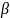 >1,
то поверхность гидрофильна,
<1-
гидрофобна
>1,
то поверхность гидрофильна,
<1-
гидрофобна
Вещество |
|
фильность |
SiO2 |
4 |
гидро |
Крахмал |
18 |
гидро |
Графит |
0,2 |
гидрофобн |
Акт.уголь |
0,3 |
гидрофобн |
коэффициент можно найти в справочнике
Гидрофильно-гидрофобная мозаичность поверхности частиц
Часто поверхность частиц неоднородна, содержит участки различной фильности
(различные сплавы, природные минералы)
Может возникать в процессе диспергирования частиц, поверхность может быть неоднородной (кристал., аморфизованной)
Количественная оценка
По адсорбции неионогенных ПАВ из воды и неполярной жидкости
адсорбция из воды (неионогенный- на гидрофобный)
адсорбция из масла (декан)
в первую очередь, неионогенная адсорбция на полярных участках
𝛗
обозначает
долю поверхности, занятой полярными
или неполярными участками

3. Методы получения дисперсных частиц. Гомогенная и гетерогенная конденсация. Диспергирование. Физическая теория прочности тел, соотношение Гриффитса. Эффект Ребиндера. Дисперсные наполнители, используемые в фармацевтике и косметике, назначение, дисперсность.
Для получения грубодисперсных частиц (d > 10 мкм) используются методы диспергирования, для получения микродисперсных частиц (d ~ 0,1 - 10 мкм) используются методы диспергирования и конденсации
Для получения ультрамикродисперсных частиц ( d ~ 1-100 нм) используются методы конденсации
Методы получения дисперсных систем измельчением более крупных частиц называют диспергационными. Для диспергирования твердых тел используют механические (дробление, истирание и т.п.), электрические (распыление в электрическом поле) методы, взрывы. В лабораторных условиях диспергирование проводят в шаровых и вибрационных мельницах.
Для облегчения диспергирования твердых тел используют понизители твердости (растворы электролитов, ПАВы, и др.) – вещества, повышающие эффективность диспергирования (эффект П.А.Ребиндера). Механизм уменьшения твердости заключается в том, что добавляемое вещество (понизитель твердости) адсорбируется в местах дефектов кристаллической решетки твердого тела, что приводит к экранированию сил сцепления, действующими между противоположными поверхностями щели (при адсорбции электролитов возникают силы электростатического отталкивания между одноименно заряженными ионами, ПАВ понижают поверхностное натяжение на границе раздела твердое тело – газ, что облегчает деформирование твердого тела).
Добавки помогают не только разрушить материал, но и стабилизируют систему в дисперсном состоянии, так как, адсорбируясь на поверхности частиц, мешают их обратному слипанию.
Методы, основанные на образовании частиц в результате кристаллизации или конденсации, называют конденсационными.
Методы конденсации делятся на физические и химические
Физические - пропускание пара частиц через холодную среду, метод замены растворителей
Химические - реакции восстановления
Различают гомогенную и гетерогенную конденсацию:
при гетерогенной конденсации зарождение новой фазы происходит на уже имеющихся поверхностях (стенках сосудов, посторонних веществах);
гомогенная конденсация протекает на поверхности зародышей, возникающих в результате флуктуации плотности и концентрации в системе.
Соотношение Гриффитса
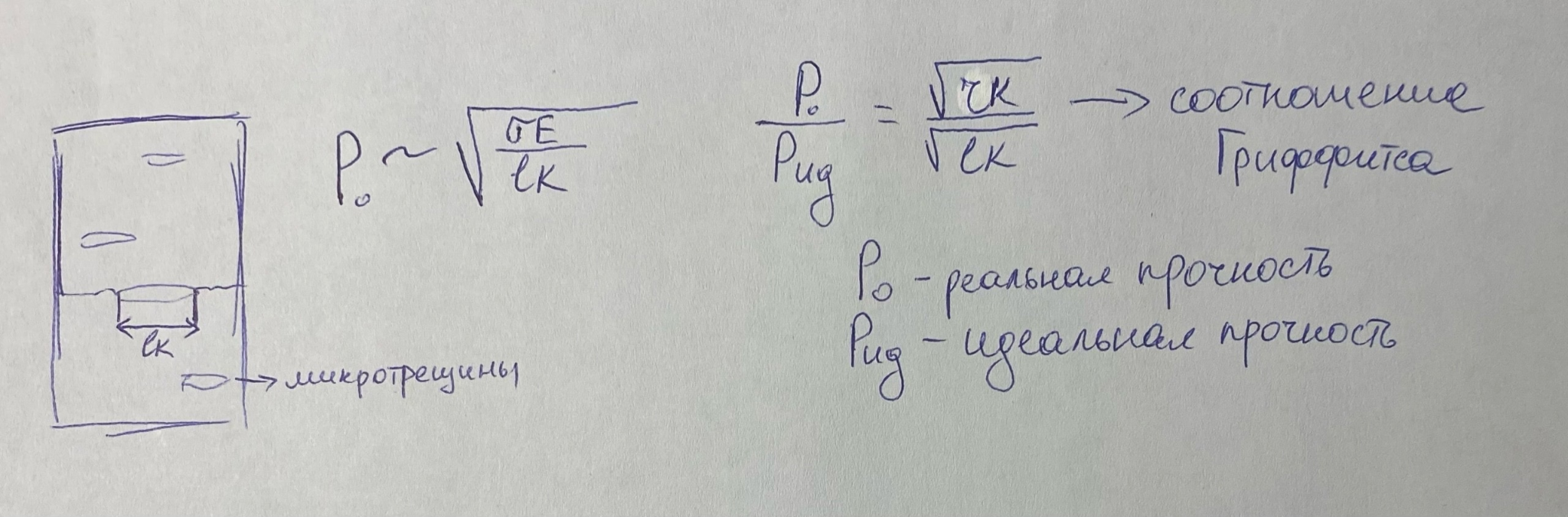
Наполнители для косметических и фармацевтических дисперсных систем:
1) Пигменты- окрашенные частицы, нерастворимые в воде, высокодисперсные
По природе делятся на: органические и неорганические, по способу получения на: природные и синтетические, по цветности на: ахроматические и цветные
2) Молотый силикагель в зубных пастах
3) В скрабах для тела применяются частицы: скорлупы яиц, орехов, ракушек, размером 1-100 нм. В скрабах для лица используются полимерные шарики.
В фармацевтике в качестве вспомогательных веществ: наполнители, связующие, диспергаторы
Наполнители: вводятся в таблетки в качестве носителя для активных фармацевтических ингредиентов, входящих в малых количествах.
Также при таблетировании сильнодействующих и ядовитых веществ их приходится разбавлять индифферентными веществами с целью придания таблетке определенной массы. Применяются крахмал, натрия хлорид, натрия гидрокарбонат сахара и другие вещества
Связующие: Для обеспечения необходимой прочности гранул и таблеток и для гранулирования государственная фармакопея допускает использование в качестве связующих веществ, такие как вода, спирт этиловый, растворы природных камедей, натрия альгината, сахара, желатина, крахмала, поливинилового спирта (ПВС), производные целлюлозы – метилцеллюлозу (МЦ), оксипропилметилцеллюлозу (ОПМЦ), карбоксиметилцеллюлозу (КМЦ), натрийкарбоксиметилцеллюлозу (Na-КМЦ), водорастворимую ацетилцеллюлозу (ВАЦ) и некоторые другие.
Диспергаторы: это ПАВы, которые применяют для измельчения пигментов и наполнителей. Добавление этого вещества препятствует агрегации частиц и их слипанию.
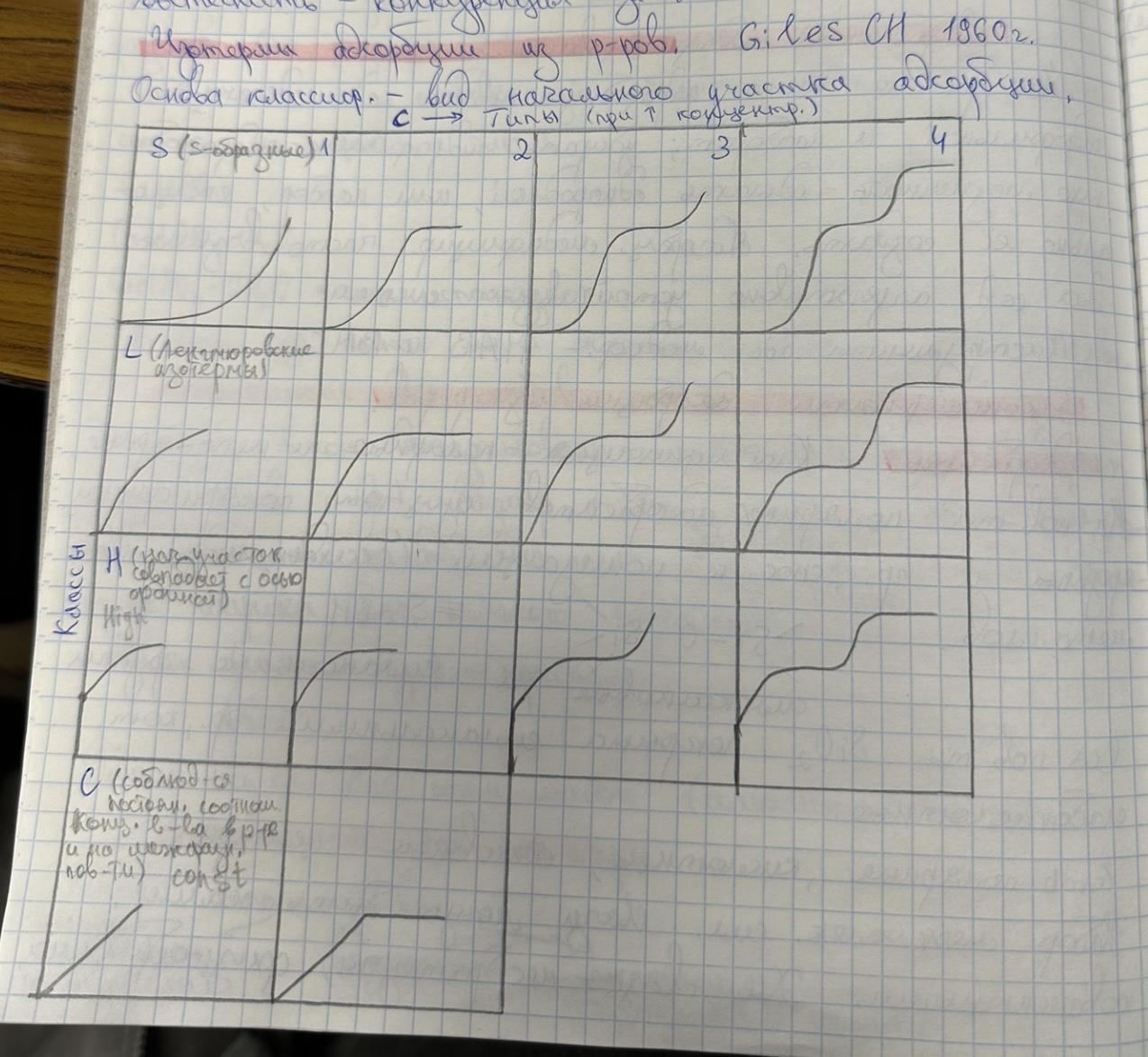
4. Специфика адсорбции из растворов. Классификация типов изотерм адсорбции из растворов. Взаимосвязь вида изотерм с механизмом адсорбции и строением адсорбционных слоев.
Является конкурентной- поверхность адсорбента занята молекулами дисперсионной среды → молекулы адсорбата должны их вытеснить - конкуренция за место на поверхности.

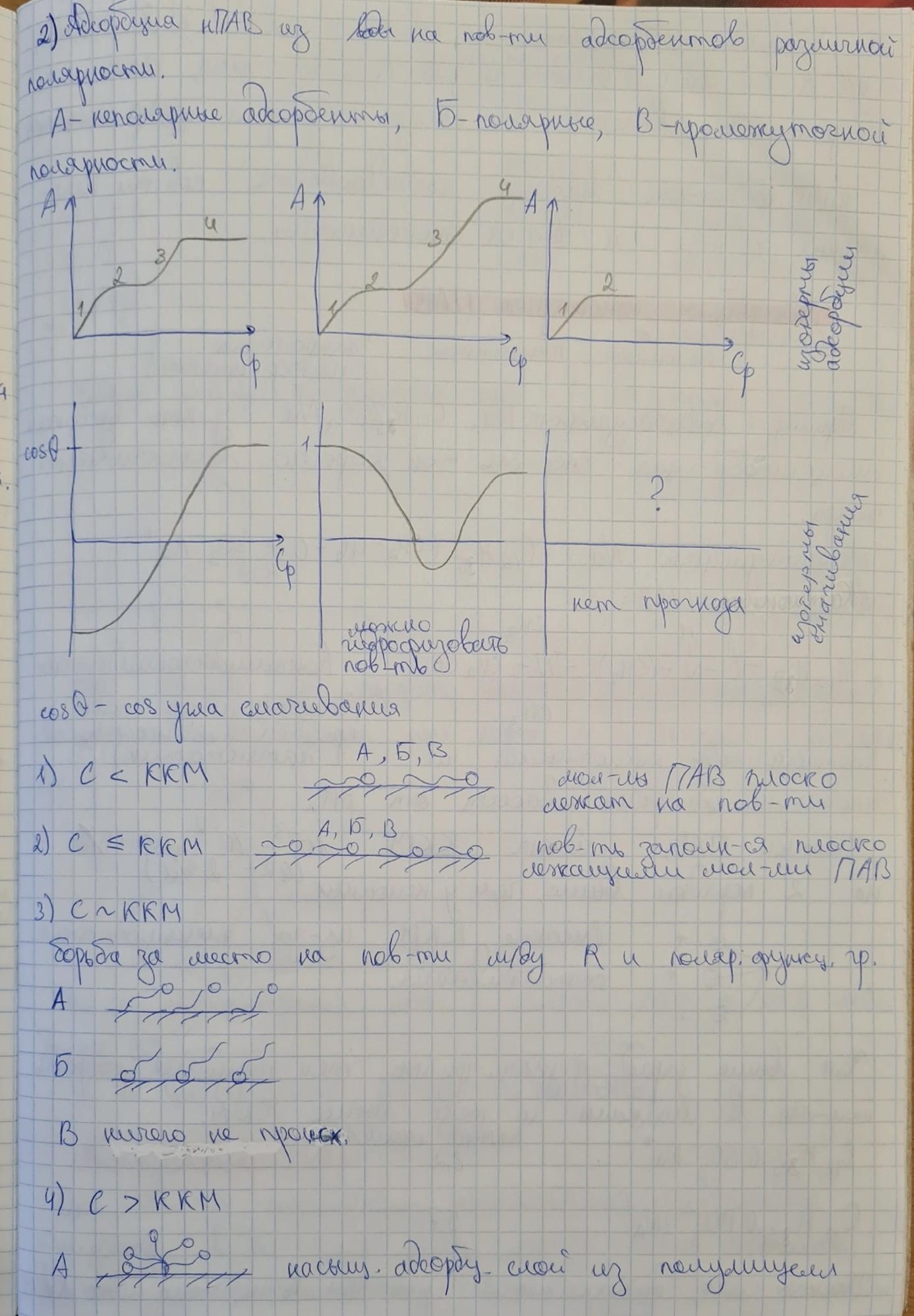
5. Неионогенные ПАВ, специфика химического строения, примеры. ККМ НПАВ. Механизм адсорбции НПАВ из воды на неполярных адсорбентах. Изотермы адсорбции и изотермы Cos Q = f(CПАВ). Уравнение Хилла де Бура, физический смысл констант. Схемы адсорбции НПАВ из сред различной полярности на адсорбентах различной полярности. Изотермы адсорбции и изотермы CosQ = f(СПАВ).
нПАВ- химические соединения, обладающие поверхностно-активными свойствами, не диссоциирующие в водных растворах на ионы.
Методы их получения основаны на реакции присоединения окиси этилена к спиртам, карбоновым кислотам, аминам, алкилфенолам и другим соединениям.
Оксиэтилированные ПАВ
R(CH2-CH2-О-)nH n-степень оксиэтилирования n=2÷20
Оксиэтилированные спирты R-O-(CH2-CH2-О-)nH Пример: синтанолы (спирты)
Оксиэтилированные амины R-NH-(CH2-CH2-О-)nH
Оксиэтилированные алкилфенолы:

В отличие от ионогенных ПАВ в гомологических рядах этих соединений может изменяться не только гидрофобная, но и гидрофильная часть молекулы.
Как правило, неионогенные ПАВ являются смесью гомологов с различной длиной полиоксиэтиленовой цепи. К недостаткам этих ПАВ относится медленное разложение из-за наличия в их составе ароматического радикала и, как следствие, накопления их в объектах окружающей среды. Неионогенные ПАВ с алкильными радикалами способны биологически разлагаться достаточно полно и быстро.


 нПАВ
обеспечивают высокую смачиваемость
поверхности неполярных тв. тел и являются
экономными.
нПАВ
обеспечивают высокую смачиваемость
поверхности неполярных тв. тел и являются
экономными.
6. Ионогенные ПАВ,
классификация примеры. ККМ ИПАВ. Специфика
адсорбции ИПАВ. Адсорбция ИПАВ из воды
на неполярных адсорбентах. Изотермы
адсорбции, зависимости
 =f(СПАВ)
и CosQ =f(СПАВ).
Механизмы адсорбции ИПАВ из воды на
полярных адсорбентах в случаях
разноименных и одноименных зарядов
ионов ПАВ и поверхности адсорбента.
Изотермы адсорбции, зависимости
=f(СПАВ)
и CosQ =f(СПАВ).
Способы изменения лиофильности
поверхности частиц наполнителя и знака
поверхностного заряда.
=f(СПАВ)
и CosQ =f(СПАВ).
Механизмы адсорбции ИПАВ из воды на
полярных адсорбентах в случаях
разноименных и одноименных зарядов
ионов ПАВ и поверхности адсорбента.
Изотермы адсорбции, зависимости
=f(СПАВ)
и CosQ =f(СПАВ).
Способы изменения лиофильности
поверхности частиц наполнителя и знака
поверхностного заряда.
Ионогенные ПАВ – вещества, диссоциирующие в воде на ионы, одни из которых обладают адсорбционной (поверхностной) активностью, другие (противоионы) – адсорбционно неактивны.
Классификация
· Анионные
· Катионные
· Амфолиты (цвиттер-ионные)
Примеры:
Додецилсульфат натрия С12H25OSO3Na – обладает высокой мицеллообразующая способность
2)
Лауретсульфат
натрия C12H5
( CH2-CH2-O
)_
SO3⁻Na⁺
3) Кокамидопропилбетаин - амфолитный ПАВ – стабилизатор пены, придает мягкость, антистатик.
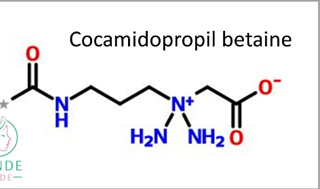
Соотношение между кислотными и основными центрами зависит от pH.
4) Алкиларилсульфонаты
ККМ ИПАВ
ККМ ИПАВ = 10⁻³ - 10⁻² моль/л - на 2 порядка выше, чем у неионных.
Высокие ККМ из-за электростатического отталкивания.
Чем
выше заряд функциональной группы, тем
труднее собрать молекулы в мицелллы и
тем выше ККМ.

Чем выше ионная сила дисперсионной среды, тем ниже ККМ.
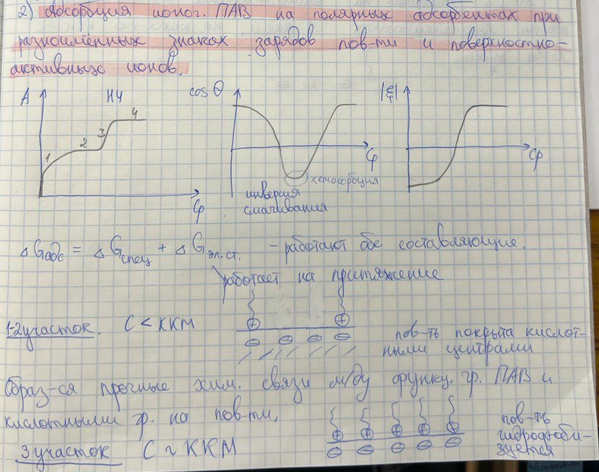
Специфика адсорбции ИПАВ
Адсорбируются не молекулы, а поверхностно-активные ионы; поверхность полярных адсорбентов может нести двойной заряд - заряжен адсорбат и поверхность адсорбента.
Адсорбция складывается из двух составляющих:

Адсорбция ионогенных ПАВ может быть и физической, и необратимой хемосорбцией.
Адсорбция ИПАВ из воды на неполярных адсорбентах. Изотермы адсорбции, зависимости =f(СПАВ) и CosQ =f(СПАВ).
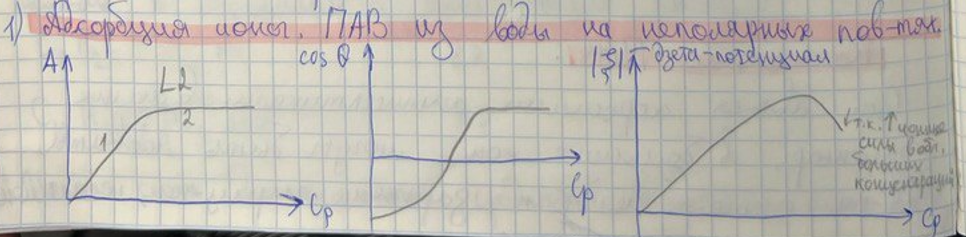
Дополнение к 3 графику (подпись на рисунке) - т.к. увеличиваются ионные силы в области больших концентраций.

Механизмы адсорбции ИПАВ из воды на полярных адсорбентах в случаях разноименных и одноименных зарядов ионов ПАВ и поверхности адсорбента. Изотермы адсорбции, зависимости =f(СПАВ) и CosQ =f(СПАВ).

7. Полимеры, специфика строения макромолекул, классификация. Специфика адсорбции макромолекул, строение адсорбционных слоев. Экспериментальное определение преимущественной ориентации макромолекул в адсорбционных слоях (уравнение Перкеля- Алмана). Основные закономерности адсорбции полимеров. Водорастворимые полимеры. Полиэлектролиты, специфика адсорбции.
Полимер – это в-во, состоящее из молекул, характеризующихся многократным повторением одного или более типов составных звеньев, соединенных между собой в количестве, достаточном для проявления комплекса свойств, который остаётся практически неизменным при добавлении или удалении 1 или нескольких составных звеньев.
По топологии классифицируют: линейные, разветвленные (звездообразные, гребнеобразные), сшитые/сетчатые (густо- редкосшитые)
По хим. составу: гомополимеры, сополимеры (статистические, чередующиеся, градиентные, блок-сополимеры, привитые сополимеры)
Спецификой строения макромолекул являются их большая молекулярная масса (до нескольких миллионов) и гибкость, т.е. способность к конформационным превращениям. В результате чего, при адсорбции с поверхностью адсорбента может взаимодействовать не вся макромолекула, а только ее отдельные части. Общий вид полимерного адсорбционного слоя представлен на рис. 16.
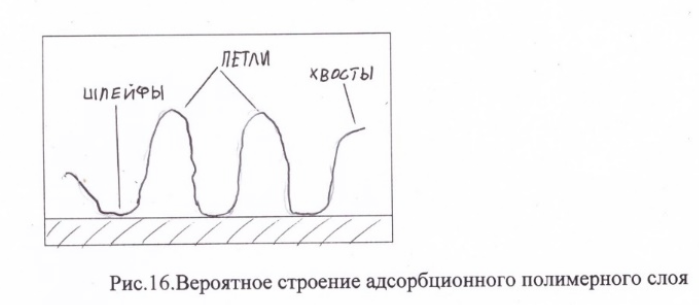
Те части макромолекулы, которые непосредственно взаимодействуют с поверхностью называются шлейфами. Части макромолекулы, находящиеся в дисперсионной среде, образуют петли и хвосты. Соотношение между шлейфами, петлями и хвостами зависит от природы полимера (гибкоцепной или жесткоцепной), термодинамического качества растворителя. Часто для создания адсорбционных слоев используют блок-сополимеры, в которых одни блоки имеют повышенное сродство к адсорбенту и образуют шлейфы (якорные группы), другие блоки имеют высокое сродство к растворителю и образуют петли. Оценить вероятное расположение макромолекул на поверхности адсорбента можно используя уравнение Перкеля-Алмана: Амах = КМ^a, где Амах[кг/м^2] – максимальная адсорбция, К-константа, М- молекулярная масса, α- константа, величина которой зависит от строения адсорбционного слоя.
В том случае, когда макромолекулы преимущественно связаны с поверхностью (т.е адсорбционный слой состоит из шлейфов) коэффициент α=0 (см. рис.17). Когда макромолекулы ориентированы по нормали к поверхности (хвосты) коэффициент α=1. В наиболее вероятном случае, когда в адсорбционном слое имеются шлейфы, петли и хвосты коэффициент 0<α<0,5

В
логарифмическом виде уравнение
представляет собой: lgAmax=lgK
+αlgM.
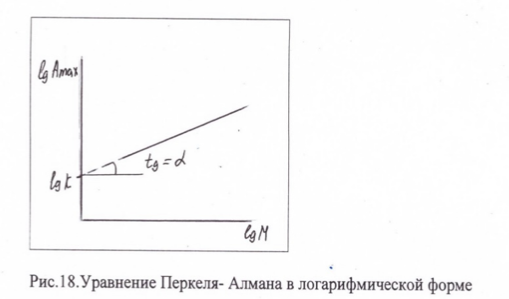
Для нескольких фракций полимера с узким молекулярно-массовым распределением определяется величина Амах и строится зависимость lgAmax от lgM, тангенс угла которой по отношению к оси абсцисс дает искомое значение α (см. рис.18).
Основные закономерности адсорбции полимеров:
1.Полимеры адсорбируются на поверхности самых различных адсорбентов вне зависимости от их природы (сродства).
2. Адсорбция полимеров как правило необратима.
3. Для адсорбции полимеров характерны изотермы класса Н2
4.На изотермах адсорбции вместо плато часто наблюдается восходящий участок, появление которого связано с полидисперсностью макромолекул.
5.Адсорбция из хороших растворителей (А2˃0) увеличивается с ростом молекулярной массы и слабо зависит от молекулярной массы при адсорбции из плохих растворителей.
6.Адорбционные равновесия устанавливаются очень медленно (сутки, недели).
Водорастворимые полимеры- это вещества, которые растворяются, диспергируются или набухают в воде и, таким образом, изменяют физические свойства водных систем в виде гелеобразования, сгущения или эмульгирования/стабилизации.
Полиэлектролиты- – это полимеры, макромолекулы которых содержат ионогенные функциональные группы, способные к электролитической диссоциации.
Адсорбции полиэлектролитов подчиняется тем же закономерностям, что и адсорбция ИПАВ. В этом случае так же действует электростатическая составляющая энергии адсорбции (Gадс= Gспециф. + Gэл. стат.), а сама адсорбция может быть, как физической так и химической.
8. Каким образом методом адсорбционного модифицирования можно изменить знак поверхностного заряда частиц Al2O3 с отрицательного на положительный в водной суспензии при рН>7 ?. Какие вещества и в каком количестве необходимо добавить в суспензию?
Оксид алюминия полярный адсорбент, является амфотерным. При рН>7 (в щелочной области) заряд поверхности будет отрицательным. Для того, чтобы перезарядить поверхность, используются ИПАВ. Оксид алюминия имеет на поверхности слабокислотные группы, способные удерживать вещества с основными свойствами. Увеличение рН раствора ведет к изменению знака заряда поверхности частиц Al2O3. Изоэлектрическая точка близка к рН = 7.0. Для изменения знака поверхностного заряда на положительный в предложенных условиях необходимо добавить КПАВ до концентрации С˃ККМ - происходит перезарядка поверхности. (Метод адсорбции ИПАВ на полярных адсорбентах при разноименных знаках зарядов поверхности и пов.-акт. ионов).
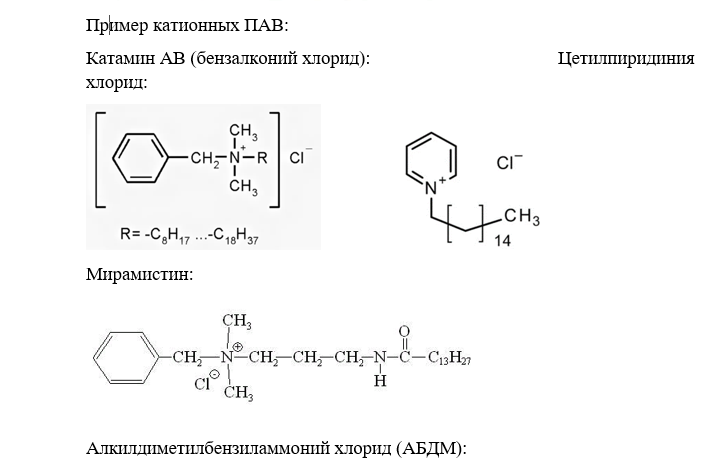
Пример катионных ПАВ:
Катамин АВ:
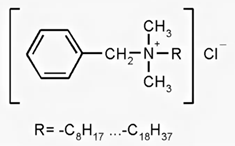
Цетилпиридиния хлорид:
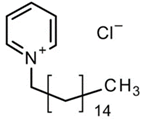
Мирамистин:
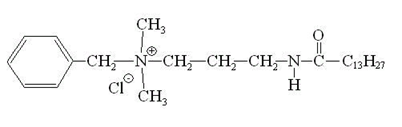
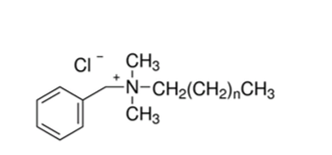
Алкилдиметилбензиламмоний хлорид (АБДМ):
*Поверхности полярных адсорбентов хорошо смачиваются водой (Ɵ =0, cosƟ=1). По мере адсорбции происходит гидрофобизация поверхности, которая достигает максимума (θ˃90˚) преобразования монослоя (С~ККМ), в котором углеводородные радикалы обращены к полярной дисперсионной среде. Таким образом гидрофильную поверхность можно перевести в олеофильную. При дальнейшем увеличении концентрации ИПАВ и образовании бимолекулярного адсорбционного слоя происходит инверсия смачивания, поверхность опять становится гидрофильной.
При адсорбции ИПАВ на заряженной поверхности происходит постепенное уменьшение поверхностного заряда поскольку поверхностные функц. группы нейтрализуются в результате хемосорбции противоположно заряженных ионов ИПАВ. Электрокинетический потенциал ДЭС при этом уменьшается по абсолютной величине. При С~ККМ поверхностный заряд и электрокинетический потенциал равны нулю. При С˃ККМ происходит перезарядка поверхности. Подбирая тип ИПАВ и его концентрацию, можно гидрофобизовать поверхность полярных адсорбентов, изменять знак поверхностного заряда.
9. Изотерма адсорбции додецилсульфата
натрия из воды на поверхности частиц
Fe2O 3 при рН<6 (потенциал
поверхности частиц положителен) имеет
тип H4. Сделайте выводы о механизме
адсорбции и нарисуйте строение
адсорбционных слоев. Какие значения
примет z-потенциал частиц в этой области
концентраций ПАВ? Какова будет лиофильность
поверхности частиц?
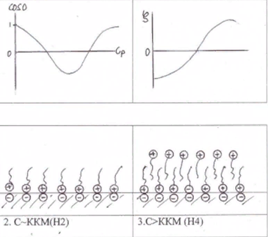
10. Изотерма адсорбции Катамина АБ (ЧАО) из воды на поверхности частиц SiO2 при рН>6 (потенциал поверхности частиц отрицателен) имеет тип H2. Сделайте выводы о механизме адсорбции и нарисуйте строение адсорбционных слоев. Какое значение примет z-потенциал частиц в этой области концентраций ПАВ? Какова будет лиофильность поверхности частиц?
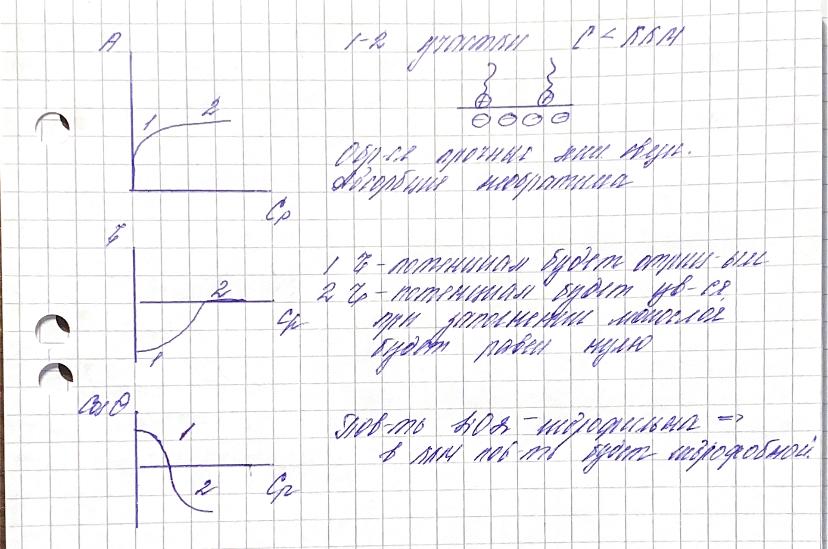
11. Каким образом из водных суспензий бентонитовой глины методом адсорбционного модифицирования можно получить частицы с олеофильной поверхностью (рН>6 поверхностный потенциал алюмосиликатов имеет отрицательное значение)? Какие вещества и в каком количестве необходимо добавить в суспензию?
Бентонит. Al2[Si4O10](ОH)2·nH2О – полярный адсорбент.
Для получения частиц с олеофильной поверхностью нужно добавить катионный ПАВ с концентрацией С~ККМ – образуется насыщенный адсорбционный слой, имеет место необратимая хемосорбция, и поверхность гидрофобизуется. При этом неполярные углеводородные радикалы обращены к полярной дисперсионной среде. Так гидрофильную поверхность можно перевести в олеофильную. При С~ККМ поверхностный заряд и электрокинетический потенциал равны нулю.
12. Изотерма адсорбции оксиэтилированного спирта из воды на частицах сажи при СПАВ≈ККМ имеет тип L2. Сделайте предположения о механизме адсорбции и нарисуйте строение адсорбционных слоев.

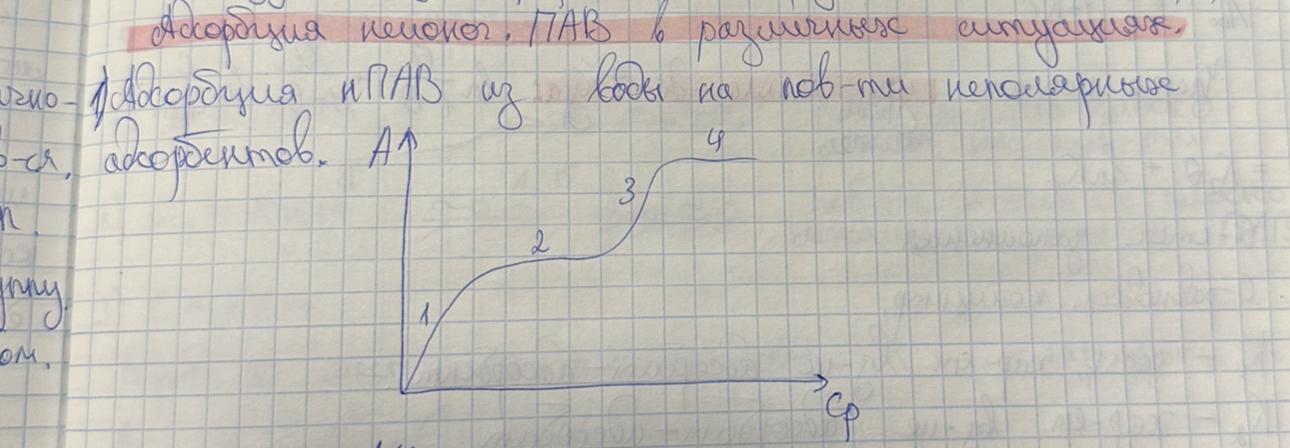

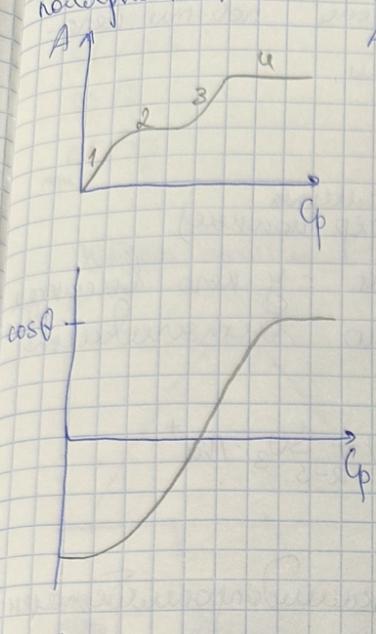
13. Изотерма адсорбции оксиэтилированного алкилфенола АФ 9-12 из воды на графите при СПАВ>ККМ имеет тип L4. Сделайте предположения о механизме адсорбции и нарисуйте строение адсорбционных слоев.
Для изотерм адсорбции класса L (изотермы Ленгмюра) характерна независимость теплоты адсорбции от степени заполнения поверхности и отсутствие конкуренции со стороны растворителя. Они имеют выгнутый относительно оси концентраций начальный участок, т.к. с увеличением доли занятых адсорбционных мест молекулами адсорбтива сложнее найти вакантное место, особенно если они склонны к образованию больших ассоциатов с повышением их концентрации в растворе за счет межмолекулярного взаимодействия. В типе L4 изотерма выходит на второе плато, это может быть обусловлено полимолекулярной адсорбцией или переориентацией молекул или их ассоциатов относительно поверхности сорбента.
В молекуле АФ 9-12 9- число атомов С в радикале, 12- число оксиэтилированных групп. Оксиэтилированная группа- слабополярная, следовательно, чтобы растворить молекулу ПАВ в воде, требуется много этих групп.
В данном случае адсорбция нПАВ из воды на поверхности неполярного адсорбента
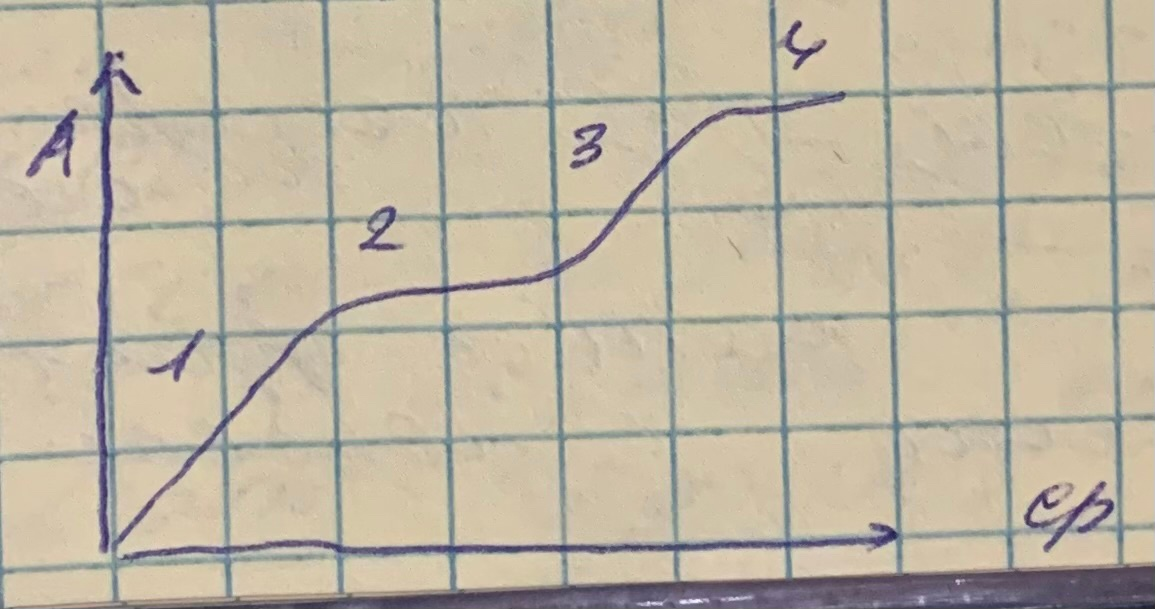
Изотермы класса L4.
1 участок: С< ККМ (L1) - область малых концентраций- молекулы нПАВ плоско лежат на поверхности адсорбента
2 участок: С≤ ККМ (L2) - постепенное заполнение поверхности плоско лежащими молекулами нПАВ, возникает первое плато
Насыщенный
адсорбционный слой их плоско лежащих
молекул нПАВ
3 участок: С∼ ККМ (L3) - борьба за место на поверхности между радикалом и полярными оксиэтилированными группами, последние вытесняются в воду
4 участок: С> ККМ (L4) - полярные группы вытесняются в раствор, а на поверхности насыщенный адсорбционный слой из вертикальных молекул нПАВ
На поверхности адсорбируются полученные мицеллы
1-2 участки описываются уравнением Ленгмюра:


Часто используют уравнение Хилла-де Бура:
ϴ- степень заполнения, С- равновесная концентрация, К1- const, характеризующая взаимодействие адсорбат-адсорбент, К2- характеризует взаимодействие адсорбат-адсорбат
14. Изотерма адсорбции Катамина АБ (ЧАО) из воды на поверхности частиц SiO2 при рН>6 (частицы имеют отрицательный потенциал поверхности) имеет тип H4. Сделайте выводы о механизме адсорбции и нарисуйте строение адсорбционных слоев. Какие значения примет z-потенциал частиц в этой области концентраций ПАВ? Какова будет лиофильность поверхности частиц?

