
Лаб4_производство_HNO3
.docxОписание процесса
Технологическая схема производства азотной кислоты под давлением 0,73 МПа представлена на рис. V.8:
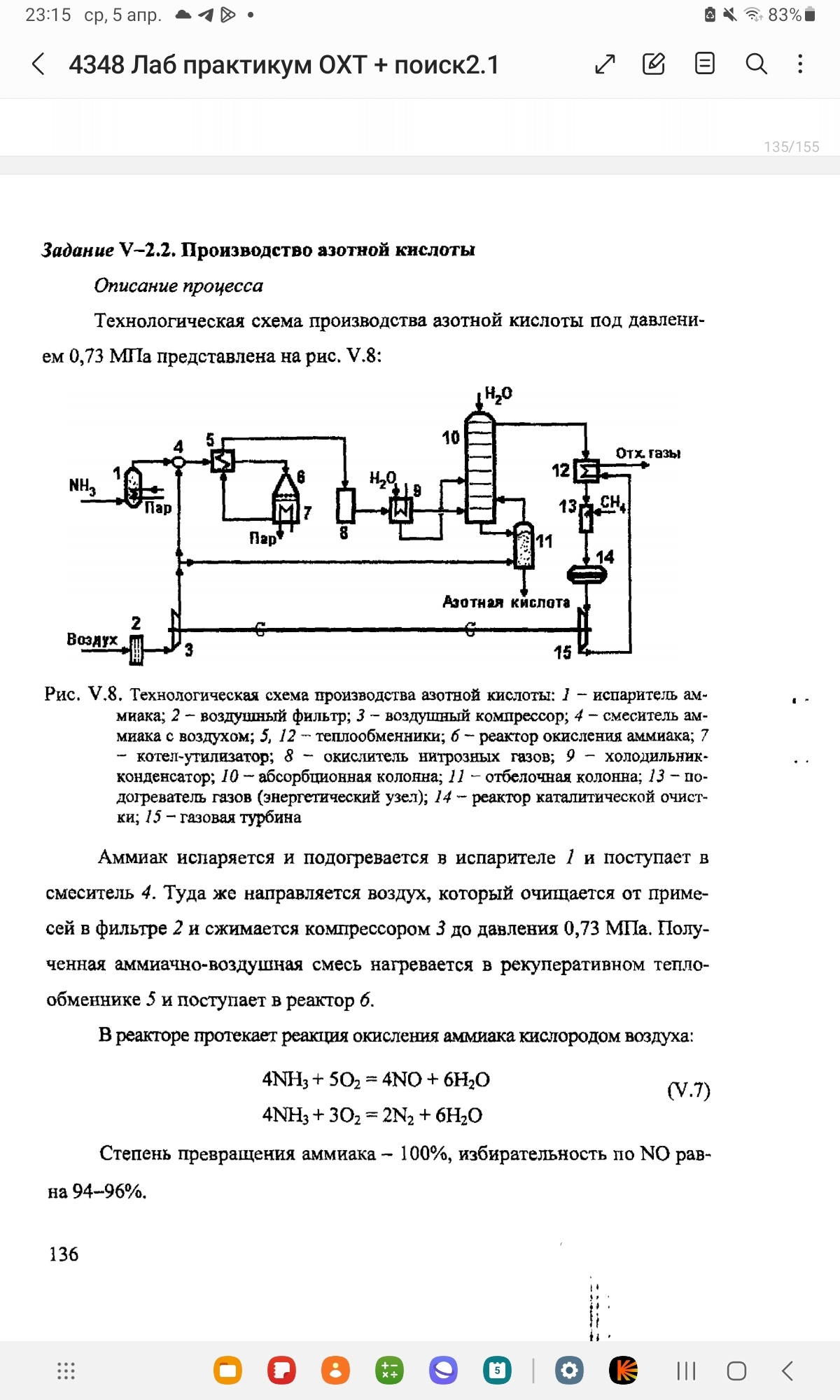
Аммиак испаряется и подогревается в испарителе 1 и поступает в смеситель 4. Туда же направляется воздух, который отчищается в фильтре 2 и сжимается компрессором 3 до давления 0,73 МПа. Полученная аммиачно-воздушная смесь нагревается в рекуперативном теплообменнике 5 и поступает в реактор 6.
В реакторе протекает реакция окисления аммиака кислородом воздуха:
4NH3 + 5O2 —> 4NO + 6H2O
4NH3 + 3O2 —> 2N2 + 6H2O
Тепло реакции идет на выработку пара в котле-утилизаторе 7 и подогрев исходный аммиачно-воздушной смести (АВС). В аппарате 8 проводится окисление:
2NO + O2 —> 2NO2
В холодильнике-конденсаторе 9 нитрозные газы охлаждаются дополнительно, при этом конденсируется вода и образуется некоторое количество слабой азотной кислоты:
3NO2 + 2H2O —> 2HNO3 + NO
Жидкость и нитрозные газы из холодильника-конденсатора подаются в абсорбционную колонну 10, где происходит доокисление нитрозных газов и получение товарной азотной кислоты. Суммарное стехиометрическое уравнение:
4NO2 + 2H2O + O2 —> 4HNO3
Образовавшаяся азотная кислота насыщена оксидами азота, которые удаляются в отбелочной колонне 11 путем их десорбции при пропускании воздуха. Последний направляется в абсорбционную колонну 10 и способствует доокислению NO.
Выходящий из колонны газовый поток подогревается в теплообменнике 12 и далее разогревается до 700-800 С◦ природным газом (метаном) в подогревателе 13. При этом расходуется оставшийся кислород, а непрореагировавший метан восстанавливает оксиды азота в реакторе каталитической отчистки 14:
2NO + CH4 + O2 —> N2 + CO2 + 2H2O
2NO2 + CH4 —> N2 + CO2 + 2H2O
Потенциал нагретого и сжатого газа используется в газовой турбине 15 (что полностью обеспечивает энергией привод воздушного компрессора 3) и для подогрева газа после абсорбционной колонны 10. Очищенный отходящий газ выбрасывается в атмосферу (отходящие газы).
Задание
Концентрация NH3 в АВС, % об. |
9,5 |
Избирательность окисления NH3 |
0,96 |
Степень окисления NO |
1,0 |
Степень абсорбции NO2 |
0,995 |
Концентрация кислоты, % мас. |
55 |
-
1. Рассчитать материальный баланс производства азотной кислоты мощностью 1 тонна 100 %-й ΗΝΟ3 в час.
Протекающие реакции:
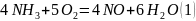
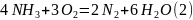
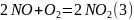
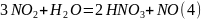
Составим брутто уравнение:
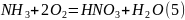
Расчет количества подаваемых компонентов
1. Расчет количества аммиака. В соответствии с уравнением (5) реакции на 1 кмоль (63 кг) HNO3 расходуется 1 кмоль (17 кг) NH3. На 1000 кг безводной кислоты необходимо аммиака
17 × 1000 / 63 = 270 кг,
где 17 и 63 г/моль – молярные массы NH3 и HNO3 соответственно.
С учетом избирательности окисления NH3 и степени абсорбции полученных оксидов количество необходимого аммиака составит
270 × 100 / 96,0 × 100 / 99,5 = 282,66 кг или 282,66 / 17 = 16,63 кмоль.
2. Расчет аммиачно-воздушной смеси. Концентрация аммиака в аммиачно-воздушной смеси 9,5 об.%. Следовательно, на долю воздуха приходится 90,5 об.%. Необходимое количество воздуха
16,63 × 90,5 / 9,5 = 158,42 кмоль, в т. ч.
кислорода: 158,42 × 21 / 100 = 33,27 кмоль, или 33,27 × 32 = 1064,64 кг;
азота: 158,42 × 79 / 100 = 125,15 кмоль, или 125,15 × 28 = 3504,20 кг,
где 21 и 79 – концентрация кислорода и азота в воздухе, об.%; 32 и 28 – их молярные массы, кг/моль.
Расчет количества нитрозных газов
1. Количество образующегося оксида азота. По реакции (1) из 1 кмоль NH3 образуется 1 кмоль NO, а при степени избирательности окисления 96 % количество NO составит
16,63 × 96 / 100 = 15,96 кмоль, или 15,96 × 30 = 478,80 кг.
2. По реакции (2) из 1 кмоль NH3 образуется 0,5 кмоль N2. В этой реакции участвует 4 % аммиака от начального количества. Количество образующегося азота по реакции (2) составит
16,63 × 0,5 × 4 / 100 = 0,33 кмоль, или 0,33 × 28 = 9,24 кг.
3. Количество образующихся водяных паров. Согласно уравнениям реакции (1), (2), из 4 кмоль NH3 образуется 6 кмоль Н2О; суммарное количество паров воды по двум реакциям составит
16,63 × 6 / 4 = 24,95 кмоль, или 24,95 × 18 = 449,10 кг.
4. Количество оставшегося кислорода в нитрозных газах. По реакции (1) вступило в реакцию кислорода:
16,63 × 96 / 100 × 5 / 4 = 19,96 кмоль.
По реакции (2): 16,63 × 4 / 100 × 3 / 4 = 0,50 кмоль.
Всего вступило в реакцию кислорода: 19,96 + 0,50 = 20,46 кмоль.
Осталось в нитрозных газах кислорода:
33,27 - 20,46 = 12,81 кмоль, или 12,81 × 32 = 409,92 кг.
5. Количество азота в нитрозных газах складывается из первоначального количества азота в воздухе и азота, образовавшегося по реакции (2):
125,15 + 0,33 = 125,48 кмоль или 3504,20 + 9,24 = 3513,44 кг.
Приход |
Расход |
||||||
Наимен. |
кмоль |
% об. |
кг |
Наимен. |
кмоль |
% об. |
кг |
NH3 |
16,63 |
9,5 |
282,66 |
NO |
15,96 |
9,87 |
478,80 |
O2 |
33,27 |
19 |
1064,64 |
O2 |
12,81 |
8,45 |
409,92 |
N2 |
125,15 |
71,5 |
3504,20 |
N2 |
125,48 |
72,42 |
3513,44 |
|
|
|
|
H2O |
24,95 |
9,26 |
449,10 |
Итого |
175,05 |
100 |
4851,50 |
Итого |
179,2 |
100 |
4851,26 |
-
2. Определить:
– количества ΝΗ3 и воздуха для обеспечения заданной производительности с точностью < 1%.;
– количество воды, подаваемой на орошение колонны для получения товарной кислоты заданного состава;
– количество природного газа (CH4), которое надо подать для очистки отходящих газов от оксидов азота;
– расходные коэффициенты по аммиаку, воздуху (О2), воде, метану на 1 тонну 100 %-й ΗΝΟ3.
Количество ΝΗ3 и воздуха для обеспечения заданной производительности с точностью < 1%.
(см. выше)
Количество воды, подаваемой на орошение колонны для получения товарной кислоты заданного состава
1000 – 55%
Х – 100%;
Х=1818,18 кг/сут. (кол-во разб. азотной кислоты)
GH2O = (1818,18 – 1000)/0,995 = 822,29 кг/сутки.
Количество природного газа (CH4), которое надо подать для очистки отходящих газов от оксидов азота
4NO2 + 2H2O + O2 = 4HNO3
По реакции находим количество NO2:
GNO2 = (1000/63)*46 = 730,16 кг
Учитывая степень адсорбции, найдем 100% NO2:
GNO2 = 730,16/0,995 = 733,83 кг
Тогда количество непрореагировавшего NO2:
GNO2 = 733,83*0,005 = 3,67 кг
Так как после получения HNO3 получилось 3,67 кг NO2, то по реакции

GCH4 = (1/2)*(3,67/46)*16 = 0,64 кг
GCO2 = (1/2)*(5,50/46)*44 = 1,76 кг
GN2 = (1/2)*(5,50/46)*28 = 1,12 кг
Расходные коэффициенты по аммиаку, воздуху (О2), воде, метану на 1 тонну 100 %-й ΗΝΟ3
Наим. |
Расх. коэф. |
Аммиак |
1,05 |
Воздух (О2) |
9,98 |
Вода |
2,88 |
Метан |
0,003 |
