
- •Теоретические основы электролиза криолито-глиноземных расплавов
- •Общие сведения
- •Сущность электролиза. Основные законы электролиза
- •Характеристики электролиза
- •Форма рабочего пространства
- •Гашение анодных эффектов
- •Технологическое обслуживание электролизеров
- •Обслуживание анодов
- •§ 76. Нарушения технологического режима процесса электролиза
- •9Л. Энергоснабжение электролизных серий
- •Механизация процессов обслуживания электролизеров.
- •Автоматическая система управления технологическим процессом (асутп)
- •Централизованная раздача и автоматизированное питание ванн глинозёмом
13 |
Алюминий |
Al 26,982 |
|
3s23p1 |
|
Алюми́ний — элемент главной подгруппы третьей группы третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 13. Обозначается символом Al (лат. Aluminium). Относится к группе лёгких металлов. Наиболее распространённый металл и третий по распространённости химический элемент в земной коре (после кислорода и кремния).
Простое вещество алюминий (CAS-номер: 7429-90-5) — лёгкий, парамагнитный металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Алюминий обладает высокой тепло- и электропроводностью, стойкостью к коррозии за счёт быстрого образования прочных оксидных плёнок, защищающих поверхность от дальнейшего взаимодействия.
История
Впервые алюминий был получен Гансом Эрстедом в 1825 году действием амальгамы калия на хлорид алюминия с последующей отгонкой ртути.
Физические свойства

Микроструктура алюминия на протравленной поверхности слитка, чистотой 99,9998 %, размер видимого сектора около 55 × 37 мм.
Металл серебристо-белого цвета, лёгкий, плотность — 2,7 г/см³, температура плавления у технического алюминия — 658 °C, у алюминия высокой чистоты — 660 °C, удельная теплота плавления — 390 кДж/кг, температура кипения — 2500 °C, удельная теплота испарения — 10,53 МДж/кг, временное сопротивление литого алюминия — 10…12 кг/мм², деформируемого — 18…25 кг/мм², сплавов — 38…42 кг/мм².
Твёрдость по Бринеллю — 24…32 кгс/мм², высокая пластичность: у технического — 35 %, у чистого — 50 %, прокатывается в тонкий лист и даже фольгу. Модуль Юнга — 70 ГПа.
Алюминий обладает высокой электропроводностью (0,0265 мкОм·м) и теплопроводностью (1,24×10−3 Вт/(м·К)), 65 % от электропроводности меди, обладает высокой светоотражательной способностью. Слабый парамагнетик. Температурный коэффициент линейного расширения 24,58×10−6 К−1 (20…200 °C). Температурный коэффициент электрического сопротивления 2,7×10−8K−1.
Алюминий образует сплавы почти со всеми металлами. Наиболее известны сплавы с медью и магнием (дюралюминий) и кремнием (силумин).
Нахождение в природе
Природный алюминий состоит практически полностью из единственного стабильного изотопа 27Al со следами 26Al, радиоактивного изотопа с периодом полураспада 720 тыс. лет, образующегося в атмосфере при бомбардировке ядер аргона протонами космических лучей.
По распространённости в природе занимает 1-е среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. Процент содержания алюминия в земной коре по данным различных исследователей составляет от 7,45 до 8,14 % от массы земной коры[3].
В природе алюминий в связи с высокой химической активностью встречается почти исключительно в виде соединений. Некоторые из них:
Бокситы — Al2O3 · H2O (с примесями SiO2, Fe2O3, CaCO3)
Нефелины — KNa3[AlSiO4]4
Алуниты — (Na,K)2SO4·Al2(SO4)3·4Al(OH)3
Глинозёмы (смеси каолинов с песком SiO2, известняком CaCO3, магнезитом MgCO3)
Корунд (сапфир, рубин, наждак) — Al2O3
Полевые шпаты — (K,Na)2O·Al2O3·6SiO2, Ca[Al2Si2O8]
Каолинит — Al2O3·2SiO2 · 2H2O
Берилл (изумруд, аквамарин) — 3ВеО · Al2О3 · 6SiO2
Хризоберилл (александрит) — BeAl2O4.
Тем не менее, в некоторых специфических восстановительных условиях возможно образование самородного алюминия[4] (Олейников Б. В. и др. Алюминий — новый минерал класса самородных элементов //Записки ВМО. — 1984, ч. CXIII, вып. 2, с. 210—215.).
В природных водах алюминий содержится в виде малотоксичных химических соединений, например, фторида алюминия. Вид катиона или аниона зависит, в первую очередь, от кислотности водной среды. Концентрации алюминия в поверхностных водных объектах России колеблются от 0,001 до 10 мг/л, в морской воде 0,01 мг/л[5].
Химические свойства
На воздухе алюминий покрывается тонкой прочной беспористой пленкой А12О3, защищающей металл от дальнейшего окисления и обусловливающей его высокую коррозионную стойкость. По этой же причине алюминий не реагирует с конц. HNO3. Техн. алюминий легко взаимод. с разбавленными соляной к-той H2SO4 и HNO3, образуя соли. Алюминий легко реагирует со щелочами, давая алюминаты.
При 25 °С алюминий
образует с хлором,
бромом
и иодом
соотв. алюминия
хлорид
А1С13,
бромид
А1Вr3
и иодид
АlI3,
при 600°С с фтором-алюминия фторид
A1F3.
Бромид
-бесцв. расплывающиеся на воздухе
кристаллы;
т. пл. 97 °С, т. кип. 255°С; H°обр-514
кДж/моль;
раств. в воде,
спирте,
CS2,
ацетоне.
Иодид-светло-коричневые расплывающиеся
на воздухе
кристаллы;
т. пл. 180°С, т. кип. 360°С;
H°обр-309
кДж/моль;
раств. в воде,
спирте,
эфире, CS2.
H°обр-514
кДж/моль;
раств. в воде,
спирте,
CS2,
ацетоне.
Иодид-светло-коричневые расплывающиеся
на воздухе
кристаллы;
т. пл. 180°С, т. кип. 360°С;
H°обр-309
кДж/моль;
раств. в воде,
спирте,
эфире, CS2.
Порошкообразный алюминий выше 800°С образует с азотом алюминия нитрид A1N. При взаимод. атомарного Н с парами алюминия при -196 °С получается гидрид (А1Н)Х (х = 1, 2), стабильный до — 76°С; (А1Н3)Х, синтезированный взаимод. А1С13 с Li[А1Н4],-бесцв. аморфный порошок, разлагается на элементы выше 100°С, водой гидролизуется. Алюминий реагирует с S выше 200°С, давая сульфид A12S3-бесцв. кристаллы; т. пл. 1120°С, т. возг. 1550°С (в токе N2);
H°обр -723 кДж/моль; разлагается водой, к-тами. С фосфором при 500°С алюминий образует фосфид А1Р-желтовато-серые кристаллы, устойчивые до 1000°С; H°обр — 121 кДж/моль; разлагается к-тами и щелочами. При взаимод. расплавленного алюминия с В образуются бориды А1В2 и А1В12-желто-серые или коричневые кристаллы; т. пл. 2200 °С; не разлагаются водой и к-тами.
Выше 800°С могут образовываться соед. А1(I), напр.: А12Х3 + 4А1 ЗА12Х (X = О, S, Se).
С рядом металлов и неметаллов алюминий образует сплавы (см. Алюминия сплавы), в к-рых содержатся интерметаллич. соед. - алюминиды, обычно весьма тугоплавкие (как правило, т. пл. выше 1000°С) и обладающие высокой твердостью (напр., твердость по Бринеллю для СuА12 и СгА17 ок. 5000 МПа, для TiAl3 ок. 7000 МПа, для РеА13 ок. 10000 МПа) и жаропрочностью. Алюминиды выполняют роль модификаторов сплавов и придают изделиям высокие мех. св-ва.
Производство
Основная статья: алюминиевая промышленность


Одна красивая, но, вероятно, неправдоподобная легенда из «Historia naturalis» гласит, что однажды к римскому императору Тиберию (42 год до н. э. — 37 год н. э.) пришёл ювелир с металлической, небьющейся обеденной тарелкой, изготовленной, якобы из глинозёма — Al2O3. Тарелка была очень светлой и блестела, как серебро. По всем признакам она должна быть алюминиевой. При этом ювелир утверждал, что только он и боги знают, как получить этот металл из глины. Тиберий, опасаясь, что металл из легкодоступной глины может обесценить золото и серебро, приказал, на всякий случай, отрубить человеку голову. Очевидно, данная легенда весьма сомнительна, так как самородный алюминий в природе не встречается в силу своей высокой активности и во времена Римской империи не могло быть технических средств, которые позволили бы извлечь алюминий из глинозёма.
Лишь почти через 2000 лет после Тиберия — в 1825 году, датский физик Ханс Христиан Эрстед получил несколько миллиграммов металлического алюминия, а в 1827 году Фридрих Вёлер смог выделить крупинки алюминия, которые, однако, на воздухе немедленно покрывались тончайшей пленкой оксида алюминия.
До конца XIX века алюминий в промышленных масштабах не производился.
Только в 1854 году Анри Сент-Клер Девиль (его исследования финансировал Наполеон III, расчитывая, что алюминий пригодится его армии[7][8]) изобрёл первый способ промышленного производства алюминия, основанный на вытеснении алюминия металлическим натрием из двойного хлорида натрия и алюминия NaCl·AlCl3. В 1855 году был получен первый слиток металла массой 6—8 кг. За 36 лет применения, с 1855 по 1890 год, способом Сент-Клер Девиля было получено 200 тонн металлического алюминия. В 1856 году он же получил алюминий электролизом расплава хлорида натрия-алюминия.
В 1885 году, основываясь на технологии, предложенной русским ученым Николаем Бекетовым, был построен завод по производству алюминия в немецком городе Гмелингеме. Технология Бекетова мало чем отличалась от способа Девиля, но была проще и заключалась во взаимодействии между криолитом (Na3AlF6) и магнием. За пять лет на этом заводе было получено около 58 т алюминия — более четверти всего мирового производства металла химическим путем в период с 1854 по 1890 год.
Метод, изобретённый почти одновременно Чарльзом Холлом во Франции и Полем Эру в США в 1886 году и основанный на получении алюминия электролизом глинозема, растворённого в расплавленном криолите, положил начало современному способу производства алюминия. С тех пор, в связи с усовершенствованием электротехники, производство алюминия совершенствовалось. Заметный вклад в развитие производства глинозема внесли русские ученые К. И. Байер, Д. А. Пеняков, А. Н. Кузнецов, Е. И. Жуковский, А. А. Яковкин и др.
Первый алюминиевый завод в России был построен в 1932 году в Волхове. Металлургическая промышленность СССР в 1939 году производила 47,7 тыс.тонн алюминия, ещё 2,2 тыс.тонн импортировалось.
Вторая мировая война значительно стимулировала производство алюминия. Так, в 1939 году общемировое его производство, без учёта СССР, составляло 620 тыс. т, но уже к 1943 году выросло до 1,9 млн т.
К 1956 году в мире производилось 3,4 млн т первичного алюминия, в 1965 году — 5,4 млн т, в 1980 году — 16,1 млн т, в 1990 году — 18 млн т.
В 2007 году в мире было произведено 38 млн т первичного алюминия, а в 2008 — 39,7 млн т. Лидерами производства являлись:
 Китай
(в 2007 году произвёл 12,60 млн т, а в
2008 — 13,50 млн т),
Китай
(в 2007 году произвёл 12,60 млн т, а в
2008 — 13,50 млн т),Россия (3,96/4,20),
 Канада
(3,09/3,10),
Канада
(3,09/3,10), США
(2,55/2,64),
США
(2,55/2,64),Австралия (1,96/1,96),
Бразилия (1,66/1,66),
Индия (1,22/1,30),
Норвегия (1,30/1,10),
ОАЭ (0,89/0,92),
Бахрейн (0,87/0,87),
ЮАР (0,90/0,85),
Исландия (0,40/0,79),
Германия (0,55/0,59),
Венесуэла (0,61/0,55),
Мозамбик (0,56/0,55),
Таджикистан (0,42/0,42)[9].
См. также более полный Список стран по выплавке алюминия.
В России монополистом по производству алюминия является компания «Российский алюминий», на которую приходится около 13 % мирового рынка алюминия и 16 % глинозёма[10].
Десятка крупнейших компаний-производителей алюминия выглядит следующим образом[6]:
Место |
Название компании |
Страна |
Объём производства, тыс. т |
1 |
Объединённая компания "Российский алюминий", UС RUSAL |
Россия, Швейцария |
4153 |
2 |
Alcoa Inc. |
США |
3965 |
3 |
Alcan |
Канада |
3454 |
4 |
Aluminum Corporation of China Limited, CHALCO |
Китай |
2034 |
5 |
Årdal og Sunndal Verk, ASV (Hydro Aluminium) |
Норвегия |
1576 |
6 |
BHP Billiton |
Австралия |
1349 |
7 |
Dubai Aluminium Company Limited (DUBAL), |
Объединённые Арабские Эмираты |
872 |
8 |
Rio Tinto |
Великобритания, Австралия |
864 |
9 |
Aluminium Bahrain B.S.C. (Alba) |
Бахрейн |
860 |
10 |
Century Aluminum |
США |
741 |
Самым крупным предприятием по производству алюминия является Братский алюминиевый завод, который первым в мире стал производить более 1 миллиона тонн алюминия в год. Завод производит 30% российского алюминия и 4% мирового. Завод потребляет 75% электроэнергии, вырабатываемой Братской ГЭС[7].
Мировые запасы бокситов практически безграничны, то есть несоизмеримы с динамикой спроса. Существующие мощности могут производить до 44,3 млн т первичного алюминия в год. Следует также учитывать, что в будущем некоторые из применений алюминия могут быть переориентированы на использование, например, композитных материалов.
Применение
Широко применяется как конструкционный материал. Основные достоинства алюминия в этом качестве — лёгкость, податливость штамповке, коррозионная стойкость (на воздухе алюминий мгновенно покрывается прочной плёнкой Al2O3, которая препятствует его дальнейшему окислению), высокая теплопроводность, неядовитость его соединений. В частности, эти свойства сделали алюминий чрезвычайно популярным при производстве кухонной посуды, алюминиевой фольги в пищевой промышленности и для упаковки.
Основной недостаток алюминия как конструкционного материала — малая прочность, поэтому его обычно сплавляют с небольшим количеством меди и магния (сплав называется дюралюминий).
Электропроводность алюминия всего в 1,7 раза меньше, чем у меди, при этом алюминий приблизительно в 4 раза дешевле [11] за килограмм, но, за счёт в 3,3 раза меньшей плотности, для получения равного сопротивления его нужно приблизительно в 2 раза меньше по весу. Поэтому он широко применяется в электротехнике для изготовления проводов, их экранирования и даже в микроэлектронике при изготовлении проводников в чипах. Меньшую электропроводность алюминия (37 1/ом) по сравнению с медью (63 1/ом) компенсируют увеличением сечения алюминиевых проводников. Недостатком алюминия как электротехнического материала является наличие прочной оксидной плёнки, затрудняющей пайку.
Благодаря комплексу свойств широко распространён в тепловом оборудовании.
Алюминий и его сплавы сохраняют прочность при сверхнизких температурах. Благодаря этому он широко используется в криогенной технике.
Высокий коэффициент отражения в сочетании с дешевизной и лёгкостью напыления делает алюминий идеальным материалом для изготовления зеркал.
В производстве строительных материалов как газообразующий агент.
Алитированием придают коррозионную и окалиностойкость стальным и другим сплавам, например клапанам поршневых ДВС, лопаткам турбин, нефтяным платформам, теплообменной аппаратуре, а также заменяют цинкование.
Сульфид алюминия используется для производства сероводорода.
Идут исследования по разработке пенистого алюминия как особо прочного и лёгкого материала.
В качестве восстановителя
Как компонент термита, смесей для алюмотермии
Алюминий применяют для восстановления редких металлов из их оксидов или галогенидов.
Сплавы на основе алюминия
В качестве конструкционного материала обычно используют не чистый алюминий, а разные сплавы на его основе. Нумерация серий сплавов приведена для США (стандарт маркировки компании Alcoa)
Алюминиево-магниевые Al-Mg (серия 5ххх). Сплавы системы Al-Mg характеризуются сочетанием удовлетворительной прочности, хорошей пластичности, очень хорошей свариваемости и коррозионной стойкости. Кроме того, эти сплавы отличаются высокой вибростойкостью.
В сплавах этой системы, содержащих до 6 % Mg, образуется эвтектическая система соединения Al3Mg2 c твердым раствором на основе алюминия. Наиболее широкое распространение в промышленности получили сплавы с содержанием магния от 1 до 5 %. Рост содержания Mg в сплаве существенно увеличивает его прочность. Каждый процент магния повышает предел прочности сплава на 30 МПа, а предел текучести — на 20 МПа. При этом относительное удлинение уменьшается незначительно и находится в пределах 30…35 %. Сплавы с содержанием магния до 3 % (по массе) структурно стабильны при комнатной и повышенной температуре даже в значительно нагартованном состоянии. С ростом концентрации магния в нагартованном состоянии структура сплава становится нестабильной. Кроме того, увеличение содержания магния свыше 6 % приводит к ухудшению коррозионной стойкости сплава. Для улучшения прочностных характеристик сплавы системы Al-Mg легируют хромом, марганцем, титаном, кремнием или ванадием. Попадания в сплавы этой системы меди и железа стараются избегать, поскольку они снижают их коррозионную стойкость и свариваемость.
Алюминиево-марганцевые Al-Mn (серия 3ххх). Сплавы этой системы обладают хорошей прочностью, пластичностью и технологичностью, высокой коррозионной стойкостью и хорошей свариваемостью.
Основными примесями в сплавах системы Al-Mn являются железо и кремний. Оба этих элемента уменьшают растворимость марганца в алюминии. Для получения мелкозернистой структуры сплавы этой системы легируют титаном. Присутствие достаточного количества марганца обеспечивает стабильность структуры нагартованного металла при комнатной и повышенной температурах.
Алюминиево-медные Al-Cu (Al-Cu-Mg) (серия 2ххх). Механические свойства сплавов этой системы в термоупрочненном состоянии достигают, а иногда и превышают, механические свойства низкоуглеродистых сталей. Эти сплавы высокотехнологичны. Однако у них есть и существенный недостаток — низкое сопротивление коррозии, что приводит к необходимости использовать защитные покрытия.
В качестве легирующих добавок могут встречаться марганец, кремний, железо и магний. Причем наиболее сильное влияние на свойства сплава оказывает последний: легирование магнием заметно повышает предел прочности и текучести. Добавка кремния в сплав повышает его способность к искусственному старению. Легирование железом и никелем повышает жаропрочность сплавов второй серии. Нагартовка этих сплавов после закалки ускоряет искусственное старение, а также повышает прочность и сопротивление коррозии под напряжением.
Сплавы системы Al-Zn-Mg (Al-Zn-Mg-Cu) (серия 7ххх). Сплавы этой системы ценятся за очень высокую прочность и хорошую технологичность. Представитель системы — сплав 7075 является самым прочным из всех алюминиевых сплавов. Эффект столь высокого упрочнения достигается благодаря высокой растворимости цинка (70 %) и магния (17,4 %) при повышенных температурах, резко уменьшающейся при охлаждении.
Однако существенным недостатком этих сплавов является крайне низкая коррозионная стойкость под напряжением. Повысить сопротивление коррозии сплавов под напряжением можно легированием медью. Нельзя не отметить открытой в 60-е годы закономерности: присутствие лития в сплавах замедляет естественное и ускоряет искусственное старение. Помимо этого, присутствие лития уменьшает удельный вес сплава и существенно повышает его модуль упругости. В результате этого открытия были разработаны новые системы сплавов Al-Mg-Li, Al-Cu-Li и Al-Mg-Cu-Li.
Алюминиево-кремниевые сплавы (силумины) лучше всего подходят для литья. Из них часто отливают корпуса разных механизмов.
Комплексные сплавы на основе алюминия: авиаль.
Алюминий переходит в сверхпроводящее состояние при температуре 1,2 кельвина.
Алюминий как добавка в другие сплавы
Алюминий является важным компонентом многих сплавов. Например, в алюминиевых бронзах основные компоненты — медь и алюминий. В магниевых сплавах в качестве добавки чаще всего используется алюминий. Для изготовления спиралей в электронагревательных приборах используют (наряду с другими сплавами) фехраль (Fe, Cr, Al).
Ювелирные изделия
Когда алюминий был очень дорог, из него делали разнообразные ювелирные изделия. Так, Наполеон III заказал алюминиевые пуговицы, а Менделееву в 1889 г. были подарены весы с чашами из золота и алюминия. Мода на них сразу прошла, когда появились новые технологии его получения, во много раз снизившие себестоимость. Сейчас алюминий иногда используют в производстве бижутерии.
В Японии алюминий используется в производстве традиционных украшений, заменяя серебро.
Стекловарение
В стекловарении используются фторид, фосфат и оксид алюминия.
Пищевая промышленность
Алюминий зарегистрирован в качестве пищевой добавки Е173.
Алюминий и его соединения в ракетной технике
Алюминий и его соединения используются в качестве высокоэффективного ракетного горючего в двухкомпонентных ракетных топливах и в качестве горючего компонента в твёрдых ракетных топливах. Следующие соединения алюминия представляют наибольший практический интерес как ракетное горючее:
Порошковый алюминий как горючее в твердых ракетных топливах. Применяется также в виде порошка и суспензий в углеводородах.
Гидрид алюминия.
Боранат алюминия.
Триметилалюминий.
Триэтилалюминий.
Трипропилалюминий.
Триэтилалюминий (обычно, совместно с триэтилбором) используется также для химического зажигания (то есть, как пусковое горючее) в ракетных двигателях, так как самовоспламеняется в газообразном кислороде.
Алюминий в мировой культуре
Поэт Андрей Вознесенский написал в 1959 году стихотворение «Осень»[12], в котором использовал алюминий в качестве художественного образа:
…А за окошком в юном инее лежат поля из алюминия…
Виктор Цой написал песню «Алюминиевые огурцы» с припевом:
Я сажаю алюминиевые огурцы На брезентовом поле
У ленинградской рок-группы «Народное ополчение» в альбоме «Брежнев жив» 1989 года есть песня «Алюминиевый дом».
Важную роль алюминий играет в историко-мистической трилогии Андрея Валентинова и Генри Олди «Алюмен».
В произведениях эпохи знакомства человечества с алюминием
В повести Н. Г. Чернышевского «Что делать?» (1862—1863) один из главных героев повести в своём письме другому пишет, что ему довелось увидеть слиток металла, «который называется алюминиум», и что, учитывая свойства алюминия, он уверен, что за алюминием большое будущее (во времена Н. Г. Чернышевского алюминий ещё только начинали открывать).
В повести Герберта Уэллса «Война миров» (1897 год) марсиане, покинув один из своих лагерей, оставили (бросили) в нём несколько листов алюминия.
Токсичность
Отличается незначительным токсическим действием, но многие растворимые в воде неорганические соединения алюминия сохраняются в растворённом состоянии длительное время и могут оказывать вредное воздействие на человека и теплокровных животных через питьевую воду. Наиболее ядовиты хлориды, нитраты, ацетаты, сульфаты и др. Для человека токсическое действие при попадании внутрь оказывают следующие дозы соединений алюминия (мг/кг массы тела):
ацетат алюминия — 0,2-0,4;
гидроксид алюминия — 3,7-7,3;
алюминиевые квасцы — 2,9.
В первую очередь действует на нервную систему (накапливается в нервной ткани, приводя к тяжёлым расстройствам функции ЦНС). Однако свойство нейротоксичности алюминия стали изучать с середины 1960-х годов, так как накоплению металла в организме человека препятствует механизм его выведения. В обычных условиях с мочой может выделяться до 15 мг элемента в сутки. Соответственно, наибольший негативный эффект наблюдается у людей с нарушенной выделительной функцией почек.
Норматив содержания алюминия в воде хозяйственно-питьевого использования составляет 0,2 мг/л. При этом данная ПДК может быть увеличена до 0,5 мг/л главным государственным санитарным врачом по соответствующей территории для конкретной системы водоснабжения.
По некоторым биологическим исследованиям поступление алюминия в организм человека было сочтено фактором в развитии болезни Альцгеймера[13][14], но эти исследования были позже раскритикованы и вывод о связи одного с другим опровергался[15][16][17].
См. также
Анодирование, оксидирование
Гидроксид алюминия
Энциклопедия об алюминии
Категория:Соединения алюминия
Международный институт алюминия
Алюминиевая промышленность
Ссылки
Алюминий // Энциклопедический словарь Брокгауза и Ефрона: В 86 томах (82 т. и 4 доп.). — СПб., 1890—1907.
Алюминий на Webelements
Алюминий в Популярной библиотеке химических элементов
Алюминий в месторождениях
История, производство и способы использования алюминия
Алексеев А. И., Валов М. Ю., Юзвяк З. Критерии качества водных систем: Учебное пособие. — СПб: ХИМИЗДАТ, 2002. ISBN 5-93808-043-6
ГН 2.1.5.1315-03 Предельно-допустимые концентрации (ПДК) химических веществ в воде водных объектов хозяйственно-питьевого и культурно-бытового водопользования.
Теоретические основы электролиза криолито-глиноземных расплавов
Состав электролита
Электролиты —это жидкие или твердые вещества и системы, в которых в сколько-нибудь заметной концентрации присутствуют ионы, обусловливающие прохождение электрического тока. Ионы, образующиеся в результате электролитической диссоциации, несут положительный (катионы) или отрицательный (анионы) заряд. Образовавшиеся ионы переносят электрический заряд в электролите. Вторая основная роль электролита – растворить соединение, подвергающееся электролизу, так как физико-химические свойства этого соединения как правильно не позволяют вести электролиз этого соединения в чистом виде.
До настоящего времени единственным применяющимся в крупномасштабном промышленном производстве способом получения металлического алюминия является электролитическое разложение его оксида, растворенного в расплавленном криолите Na3AlF6 (или ЗNаF.AlF3).
С 1886 г., когда Эру во Франции и Холл в Америке практически одновременно предложили использовать в качестве электролита для электролиза алюминия криолито-глиноземный расплав. электролит принципиально не изменился. Все многочисленные попытки изыскания лучшего состава электролита для процесса электролиза алюминия, не увенчались успехом.
Применяемый в настоящее время для электролиза алюминия промышленный электролит в основном состоит из обогащенного фтористым алюминием криолито-глиноземного расплава, свойств которого улучшены добавками различных химических соединений.
Сумма этих добавок, как правило, не превышает 8—10%. Наибольшее распространение в качестве добавок к промышленному электролиту получили следующие соединения: CaF2, LiF, NaCl. MgF2. Основное назначение добавок — снижение температуры плавления электролита и увеличение его электропроводности. Однако все добавки приводят в той или иной степени к снижению растворимости глинозема в электролите, что ограничивает их содержание в промышленном электролите.
В промышленных электролитах практически всегда содержится 2—3 % CaF2, поступающего в виде примеси с сырьем.
Кроме того, с исходными материалами в электролит поступают следующие примеси: Fe2О3, SiO2, P2O5, V2O5, SO42-.CuO и др. Следует помнить, что ионы металлов, электродный потенциал которых более электроположительный, чем потенциал алюминия, разряжаются в процессе электролиза и загрязняют алюминий. Поэтому к степени чистоты сырья для производства алюминия всегда предъявляются повышенные требования.
В практике электролиза алюминия принято выражать состав электролита молекулярным отношением его составляющих NaF:AlF3, так называемым криолитовым отношением. Следовательно, для криолита (ЗNаF.А1F3) молекулярное отношение равняется 3. При избытке в составе электролита фтористого алюминия криолитовое отношение будет меньше трех (кислые электролиты), а при избытке фтористого натрия —больше трех (щелочные электролиты).
Ниже приведено содержание основных компонентов и кислых промышленных электролитах различного состава, % (по массе):
Криолит ........... |
75—90 |
Фтористый алюминии (AlF3) |
5—12 |
Фтористый кальции (CaF2) |
2—1 |
Фтористый магний (MgF2) |
2—5 |
Глинозем (Al2O3 ) ....... |
1—10 |
Криолитовое отношение .... |
2,5—2,9 |
Свойства криолито-глиноземного расплава
Физико-химические свойства криолито-глиноземного расплава определяются свойствами его компонентов и продуктов их взаимодействия. К основным физико-химическим свойствам относятся: температура плавления, растворимость глинозема, плотность, электропроводность, вязкость, поверхностное натяжение и давление насыщенных паров.
Температура плавления определяет границу существования жидкого состояния системы, поэтому очень важна для практических целей. Знание температур плавления различных систем помогает выбрать нужные соотношения компонентов электролитов.
Используя свойство расплава скачкообразно изменять энтальпию при охлаждении в момент перехода из одного состояния в другое и измеряя во времени температуру охлаждающегося сплава, можно установить, при каком ее значении происходит то или иное превращение. Все превращения, происходящие с расплавом при изменении температуры и состава, обычно выражают графически в виде диаграммы состояния, которая представляет собой обобщение результатов всех наблюдении за данной системой расплавов.
В диаграммах состояния систем, включающих две пли более фаз, форма границы между жидким н твердым состоянием позволяет обнаружить химические соединения, возникающие между компонентами смеси, и судить о степени их термической диссоциации в расплаве. Кроме того, по форме этой границы в известной степени удастся предсказать изменение свойств смеси в зависимости от ее состава, так как максимумы и минимумы на этой границе обычно соответствуют изменениям физико-химических свойств.
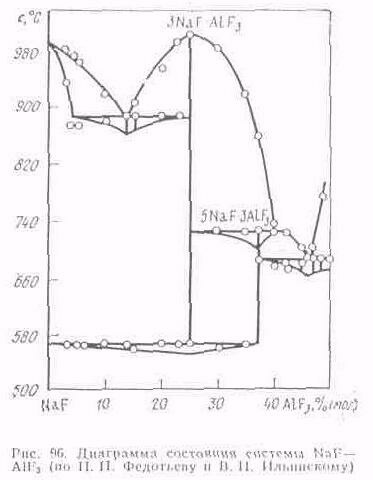
Впервые фундаментальные исследования физико-химических свойств криолито-глиноземного расплава были выполнены П. П. Федотьевым и В. П. Ильинским. Приведенная ими диаграмма состояния системы NaF—AlF3 (рис. 96) подтверждена рядом исследователей с незначительными уточнениями.
Фтористый натрии имеет температуру плавления 997°С; фтористый алюминий возгоняется при 1270 °С, не плавясь. Криолит Na3AlF6 образуется при 25 % (мол.) AlF3; температура его плавления около 1000 °С. Резко выраженный максимум, отвечающий образованию криолита, свидетельствует о прочности этого химического соединения. При 37,5 % (мол.) АlF3 образуется другое химическое соединение—хиолит 5NаF.ЗАlF3, температура плавления которого около 725°С. Это соединение непрочно и распадается при температуре его плавления на криолит и фтористый алюминий. Более поздними исследованиями и данной системе найдено еще одно химическое соединение (NaAlF4) и одна эвтектика.
На диаграмме видно, что при избытке фтористого алюминия (уменьшение криолитового отношения) в избытке фтористого натрия (увеличение криолитового отношения) понижается температура плавления расплава. Добавление к криолито-глиноземному расплаву фтористого алюминия нашло практическое использование при электролизе алюминия. Однако не следует забывать, что увеличение содержания фтористого алюминия в смеси приводит к увеличению испарения расплава. Избыточное содержание фтористого натрия также приводит к нежелательным последствиям, увеличивая вероятность выделения натрия на катоде.
Установлено, что температура плавления глинозема 2030 ºС, а алюминия технической чистоты 659 º.
Растворимость глинозема в криолите имеет большое практическое значение при использовании криолито-глиноземных распла
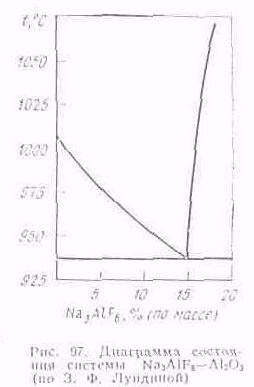
вов в качестве электролита. Система Na3AlF6—Al2O3 исследовалась многократно и различными методами. Результаты этих исследований значительно расходятся, особенно в области заэвтсктнческих сплавов. Предпочтение отдастся результатам, полученным 3. Ф. Лундиной (рис. 97). Анализ этой диаграммы состояния показывает, что глинозем значительно снижает температуру плавления криолита, по имеет ограниченную растворимость в нем. При содержании около 15 % (по массе) Al2O3 криолит с глиноземом образуют эвтектику, температура плавления которой 938 ºС. Дальнейшее незначительное растворение глинозема происходит при существенном повышении температуры расплава. При 950 °С растворимость глинозема в криолите составляет примерно 15 % (по массе).
Для снижения температуры плавления промышленною электролита в него всегда вводят некоторый избыток фтористого алюминия.
Наиболее полно тронная система Nа3AlF6— АlF3—Al2O3 исследована А. А. Костюковым (рис. 98). Эта система характеризуется четырьмя полями первичной кристаллизации —криолита, хиолита, фтористого алюминия и глинозема и двумя тронными точками—тройной эвтектической (678°С) и тройной перитектической (710 ºС). На диаграмме видно, что в области первичной кристаллизации криолита температура плавления расплавов снижается от
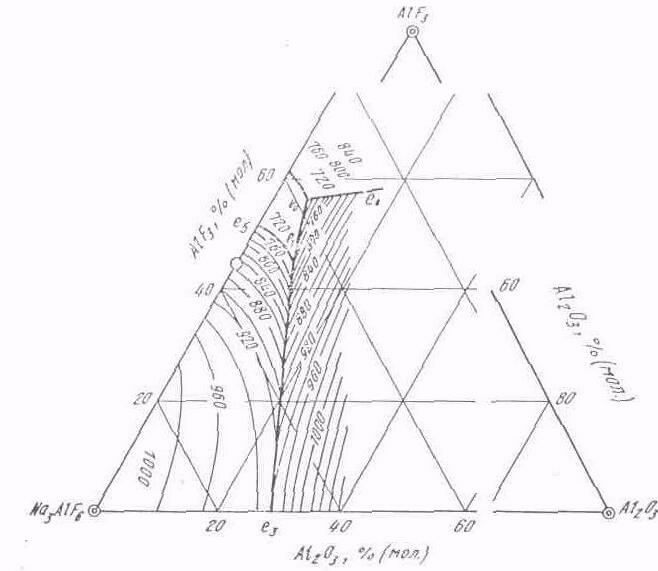
Рис. 98. Диаграмма состояния системы Nа3A1F6 - АlF3—Al2O3 (по А.А. Костюкову)
криолита к тройной переходной точке. Крутизна поверхности ликвидуса увеличивается по мере повышения концентрации фтористого алюминия в расплаве; при этом содержание глинозема в расплаве понижается.
Многочисленными исследованиями установлено, что растворимость глинозема в криолите при избыточном содержании в нем фтористого алюминия понижается. Для расплава с избытком фтористого алюминия, соответствующим криолитовому отношению 2,2—2,4, растворимость глинозема снижается до 8—10 % (мол.).
При повышении содержания фтористого натрия до 86 % (мол.) растворимость глинозема увеличивается, а затем начинает понижаться. В чистом фтористом натрии глинозем практически не растворяется.
Плотность криолита в твердом виде 2,95 г/см3, алюминия 2,7 г/см3, глинозема 3,9 г/см3. В расплавленном состоянии плотность алюминия примерно на 10 % выше, чем криолито-глиноземного расплава, что вполне достаточно для их разделения.
Плотность криолита и алюминия в расплавленном состоянии зависит от температуры. Этa зависимость определяется по уравнениям:
для алюминия d = 2,382 — 0,000273 (t — 659), для криолита d = 2,112 — 0,00093 (t— 1000),
где t— температура, ºС; d—плотность, г/см3. Добавки к криолиту NaF, АlF3 и Al2O3 снижают плотность расплава.
С повышением температуры плотность криолито-глиноземного расплава, как и чистого криолита, понижается. Для расплава, содержащего 5% Al2O3, при 960 °С она составляет 2,1 г/см3, при этой же температуре плотность алюминия равна 2,3 г/см3.
Плотность алюминия с повышением температуры понижается медленнее, чем плотность криолито-глиноземных расплавов. При понижении температуры плотности криолито-глиноземного расплава и алюминия увеличиваются не в одинаковой степени. Так как у электролита это происходит быстрее, то при снижении температуры может наступить такой момент, когда плотности металла и электролита будут близки и произойдет их перемешивание. При этом металл может всплыть на поверхность, что нарушит процесс электролиза.
Электропроводность криолито-глиноземных расплавов имеет весьма существенное значение в процессе электролиза, так как от величины падения напряжения в слое электролита зависят затраты электроэнергии. Поэтому естественно стремление применять электролит возможно более высокой электропроводности.
Измерения удельной электропроводности расплавленной смеси фторида натрия и алюминия показывают, что наиболее высокой электропроводностью обладает чистый NaF. Удельная электропроводность уменьшается с возрастанием содержания фтористого алюминия, подчиняясь линейной зависимости. Так, удельная электропроводность NaF при 1000 ºС равна 4,46, криолита 2,67, а смеси с 40 % (мол ) АlF3 2,01 См */см.
Удельная электропроводность криолито-глиноземного расплава находится в прямой зависимости от содержания глинозема. При изменении содержания глинозема в криолите от 2 до 15 % удельная электропроводность расплава соответственно уменьшается от 2,6 до 1,9 См/см.
В тройной системе Na3AlF6—AlF3—А12O3 удельная электропроводимость равномерно понижается от криолита как в сторону фторида алюминия, так и в сторону глинозема, что связано с уменьшением концентрации ионов Na+, которые переносят практически весь ток в электролите.
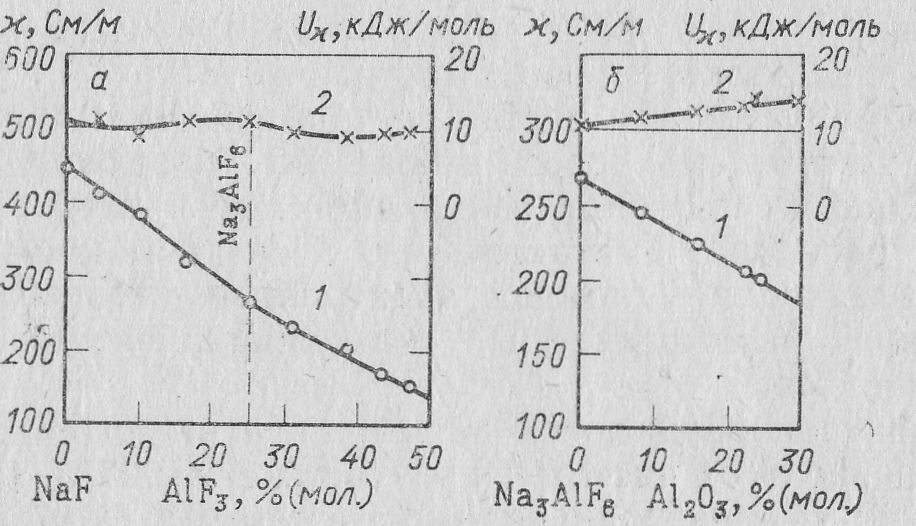
Рис. 12. Удельная электропроводимость расплавов систем NaF—A1F3 (а) и Na3AlF6—А12O3 (б) (Костюков):
1 - изотерма 1000 °С; 2 — энергия активации электропроводимости
Электропроводимость промышленных электролитов отличается от электропроводимости расплавов, синтезированных в лабораторных условиях. Помимо того, что промышленные электролиты содержат, кроме Na3AlF6, AlF3 и Al2O3, еще ряд компонентов, в них всегда имеется взвесь мелких частиц угольной «пены», представляющей собой частицы углерода, попавшие в электролит в результате неполного окисления анода. Несмотря на то, что уголь имеет электропроводимость на три порядка выше, чем электролит, наличие угольных частиц приводит к уменьшению электропроводимости. Происходит это потому, что электролит — проводник второго рода (ионный), а уголь — первого рода (электронный). Если ток протекает через границу их раздела, на поверхности возникает скачок потенциала. На стороне частицы, обращенной к аноду, возникает отрицательный скачок потенциала на стороне, обращенной к катоду,— положительный. Их разность значительно превосходит падение напряжения по длине частицы в электролите, и постоянный ток через частицу не протекает. Чем мельче частицы угольной «пены», тем устойчивее взвесь их в электролите и больше эффект понижения электропроводимости.
Кроме угольных частиц, в промышленных электролитах могут быть взвеси глинозема и карбида алюминия. Они не проводят ток и снижают электропроводимость расплава. Считается, что в среднем промышленные электролиты имеют электропроводимость на 5% меньшую, чем расплавы, синтезированные из чистых компонентов.
При практических расчетах пользуются обратной величиной—удельным электросопротивлением (ρ, Ξμ.см). Для расплава с 2% Al2O3 при 1000 °С удельное электросопротивление будет равно:
ρ= 1/α == 1/2,6=0,385, γде α.—удельная электропроводность, См/см.
* См—симменс (СИ)==1/Ом.
Электропроводность алюминия зависит от содержания в нем примесей. Так, электропроводность алюминия марки А995 составляет 65,45 % от электропроводности меди, а марка А0 62,5 %.
Удельное электросопротивление жидкого алюминия при температурах 950—1000°С равно 3.10-5 Ом.см, что составляет в 15000 раз меньшую величину, чем удельное электросопротивление промышленного электролиза.
Перенос ионов
Числом переноса иона называется доля его участия в переносе тока. Для одно-одновалентных солей числа переноса даются выражениями:
tк= uк/(uк + ua); tА= uА/(uк + uА) ,
где tк— число переноса катиона, доли ед.; tA — то же, аниона, доли, ед.; uk— скорость движения катиона в электрическом поле, м/с; uА—то же, аниона, м/с.
Среди разнообразных методов определения чисел переноса для криолито-глииоземных расплавов наибольшее применение нашел метод радиоактивных индикаторов, согласно которому, католит и анолит разделены пористой диафрагмой. В одно из этих пространств вводят радиоактивный изотоп и по интенсивности радиоактивного излучения во втором пространстве после пропускания определенного количества электричества судят о числах переноса. Таким способом для расплава фторида натрия было найдено (Гротгейм) число переноса tNa+=0,64 и соответственно tF- = 0,36.
Для криолито-глиноземных расплавов было показано (Франк и Фостер), что перенос тока осуществляется ионами, натрия: tNa+ = 0,99; только 1% тока переносится от катода к аноду анионами, причем отношение количества ионов фтора к количеству кислорода в этих расплавах равно 2.
Вязкость оказывает существенное влияние на процесс электролиза, так как от нее зависят скорость диффузии компонентов электролита, полнота отделения от него металла, удаление анодных газов и другие процессы. Исследованиями вязкости расплавленных смесей фтористого натрия и фтористого алюминия установлено, что в этих смесях максимум вязкости отвечает криолиту (2,75.10-3 Пa.c при 1000°С). При добавлении к криолиту фтористого алюминия снижается вязкость расплава; с повышением температуры расплава вязкость также понижается.
Наибольшее влияние на вязкость криолита оказывают глинозем: при добавлении к криолиту 10% (по массе) Al2O3 вязкость криолитоглиноземного расплава увеличивается на 23 % по сравнению с вязкостью расплавленного криолита при 1000°С. Повышение вязкости криолито-глиноземного расплава по мере увеличения концентрации в нем глинозема объясняется Л. П. Беляевым повышением в расплаве концентрации громоздких комплексных ионов тина А1О2- и A1O+. Эти ионы увеличивают внутреннее трение, а следовательно, и вязкость расплава.
Вязкость алюминия (99,998% А1) при 950 °С 0,082 Па. с. С понижением температуры вязкость алюминия возрастает и при 660°С составляет 0,118 Па. с.
Поверхностное натяжение —это избыток свободной энергии в поверхностном слое жидкости на границе раздела двух фаз, отнесенный к единице площади поверхности. Если поверхностное натяжение измерять как силу натяжения, действующую на единицу длины (нормальной к направлению силы) вдоль поверхности, то результаты измерения выражают в ньютонах на метр (или на сантиметр).
При электролизе криолито-глиноземных расплавов представляет интерес поверхностное натяжение на границах: расплав—газ, металл—газ, расплав—металл, а также смачиваемость твердых углеродистых материалов криолито-глиноземным расплавом и металлом.
Наибольшим поверхностным натяжением на границе с газовой фазой в системе NaF—АlF3 обладает NaF—1998 мкН/см при 1000 °С. С повышением содержания А1Рз поверхностное патяженнс системы понижается, и для криолита оно составляет 1455 мкН/см, а для смеси с 50% (мол.) АlF3 - 863 мкН/см. Поверхностное натяжение этой системы на границе с газовой фазой практически не зависит от содержания глинозема. Поверхностное натяжение металлического алюминия при 1000 °С более чем в три раза выше, чем криолита.
По данным А. Д. Герасимова и А. И. Беляева, поверхностное натяжение на границе жидкий алюминий —расплав в системе NaF—АlF3 с повышением содержания АlF3 увеличивайся. Если для криолита оно составляет 5200 мкН/см, тo при содержании 33% (мол.) АlF3 -5800 мкН/см, а при 40 % (мол.) АlF3—6400 мкН/см.
Поверхностное натяжение на границе с твердой поверхностью характеризуется краевым углом смачивания (рис. 99). Краевые углы меньше 90° характеризуют низкое, а больше 90°—высокое поверхностное натяжение. В системе NaF—АlF3 на границе расплав—твердая углеродистая поверхность—фтористый натрий имеет наименьший краевой угол смачивания. Под влиянием АlF3 краевой угол смачивания возрастает и достает максимальной величины у криолита. Дальнейшее увеличение содержания АlF3

практически не изменяет угол смачивания. Это показывает, что фтористый натрий (катион Na+) в системе NaF—АlF3 является поверхностноактивным веществом. Этим, в частности, объясняется хорошо известная из практики избирательная способность угольной футеровки поглощать из расплава фтористый натрий.
Растворенный в криолите глинозем уменьшает краевой угол смачивания на границе с твердой углеродистой поверхностью. По данным Л. И. Беляева, уменьшение содержания глинозема в криолите с 15 до 5% (по массе) при 1000°С увеличивает краевой угол смачивания соответственно с 90 до 125°. Дальнейшее уменьшение содержания глинозема приводит к незначительному изменению краевого угла смачивания. В системе криолит—глинозем поверхностно-активным веществом на границе с твердой углеродистой поверхностью является глинозем (анион О2- ).
В системе твердая углеродистая поверхность—электролиз—металл смачивающей жидкостью является элекролит. Проникая под металл, электролит пропитывает угольную футеровку электролизера. В криолито-глиноземных расплавах наиболее поверхностно-активными компонентами на границе раздела электролит—углеродистый материал являются KF, NaF и Al2O3 .
Давление насыщенного пара компонентов системы NaF и АlF3 возрастает с увеличением содержания фтoристого алюминия, насыщенный пар которого обладает наибольшим давлением. При повышении концентрации АlF3 сверх его содержания в криолите наблюдается резкое повышение давления насыщенного napа, а чем оно выше, тем выше летучесть вещества.
Преимущественное улетучивание при электролизе фтористого алюминия приводит к потерям его и к изменению состава электролита. С повышением температуры летучесть расплава и, следовательно, его потери увеличиваются.
При увеличении содержания глинозема в системе криолит - глинозем давление насыщенных паров всех компонентов системы понижается. При 1000°С и содержании 15 % (по массе) Al2O3 н криолите сумма давлении паров всех компонентов этой системы составляет 482,5 Па (3,62 мм pт. ст.), что в 2 paзa ниже давления пара криолита.
Высокое давление насыщенных паров фторидов натрия и алюминия приводит к потере этих компонентов в процессе электролиза вследствие испарения. Давление насыщенною пара алюминия при температуpax процесса электролиза (950—970 °С) незначительно, следовательно, испарения алюминия, находящеюся под слоем электролит, практически не происходит.
Строение криолито-глиноземных расплавов
Термин «строение вещества» обычно включает в себя три взаимосвязанных понятия: из каких материальных частиц состоит вещество, как эти частицы расположены в пространстве и какова природа сил, их связывающих. Известно, что расплавленные соли при температурах, близких к температуре плавления, наследуют структуру кристаллических солей. Поэтому сведения, имеющиеся о строении твердых солей и их смесей, могут быть в известной мере перенесены на структуру расплавов. Вместе с тем необходимо отметить, что при плавлении сохраняется лишь ближний порядок в расположении частиц, в то время как дальний порядок (т. е. упорядоченность в расположении частиц по всему объему кристаллической решетки, характерная для твердых солей) полностью нарушается.
Более высокая подвижность частиц жидкости, чем кристаллической соли, обеспечивается наличием микрополостей — слившихся между собой нескольких вакансий, которые как бы разъединяют отдельные структурные элементы жидкости.
Расплавы системы NaF—AIF3
Наибольший интерес в этой системе представляет криолит. В твердом состоянии при температуре до 565 °С он имеет моноклинную решетку; несколько искаженные октаэдры A1F63- образуют объемно центрированную элементарную ячейку (рис. 13). В октаэдрах соотношение радиусов ионов таково, что в плотнейшей упаковке ионов F- вписываются ионы А13+. Ионы Na+ занимают два положения: одна треть из них — Na+ (1) находится
Рис. 13. Кристаллическая решетка криолита:
1 — F-; 2 — А13+; 3 — Na+ (1); 4 — Na+ (2)
на середине ребер элементарной ячейки. Эти ионы имеют шестикратную координацию по отношению к ионам F- и расстояние между ними 0,221 нм. Две трети других ионов — Na+ (2) находятся внутри элементарной ячейки и окружены 12 ионами F- с расстоянием в 0,268 нм. При температуре 565 °С решетка криолита переходит в кубическую. При этом, как установлено рентгеноструктурным анализом (Ландон и Уббелоде), расстояние Na+ (1) — F- уменьшается до 0,219 нм, а расстояние Na+ (2) — F- существенно увеличивается— до 0,282 нм.
Зависимости электропроводимости кристаллических NaF и Na3AlF6 от температуры отличаются характерной особенностью: электропроводимость криолита оказывается на 1—2 порядка выше, чем для кристаллического NaF; при 565 °С, когда происходит полиморфное превращение и увеличиваются расстояния Na+ (2) — F-, на политерме электропроводимости криолита имеется скачок.
Сопоставление этих данных показывает, что структура криолита в твердом Состоянии характеризуется высокой степенью разупорядоченности: ионы Na+ (2), особенно при температуре выше 565 °С, обладают большой подвижностью и передвигаются в междуузлиях решетки, обеспечивая высокую электропроводимость криолита. Происходит «плавление» катионной решетки криолита. Вместе с тем ионы Na+ (2), находящиеся в междуузлиях, вырывают по, одному иону F- из комплексов AlF63-, т. е. еще до температуры плавления криолита, в твердом состоянии происходит термическая диссоциация криолитовых комплексов:
A1F63- =A1F4-+ 2F-. (11)
При переходе через точку плавления эта диссоциация усиливается в еще большей степени, однако определенная концентрация криолитовых комплексов остается в расплаве, что и определяет наличие максимумов на диаграммах плотности и вязкости (см. рис. 4 и 11).
Хиолит 5NaF*3AlF3 в твердом состоянии имеет слоистую решетку, образованную октаэдрами A1F63-. При плавлении происходит распад этого соединения (инконгруэнтное плавление). Рентгеноструктурные исследования возгонов показали, что над расплавом хиолита пар состоит из криолита и тетрафторалюмината натрия. Это означает, что и в расплаве существуют группировки, отвечающие этим соединениям, т. е. комплексные ионы A1F63- и A1F4-, причем доля последних возрастает по мере роста концентрации A1F3.
Тетрафторалюминат натрия NaAlF4 имеет кристаллическую решетку, в узлах которой находятся ионы Na+ и октаэдры AlF63+. Однако в отличие от криолита эти октаэдры сильно искажены: при удвоенной сумме радиусов ионов алюминия и фтора, равной 0,380 нм, постоянная решетки равно 0,348 нм, что указывает на сильную взаимную поляризацию ионов алюминия и фтора. Силы связи между этими ионами в значительной степени имеют ковалентный характер.
Рентгеноструктурный анализ закаленных проб, отвечающих по составу эквимольной смеси NaF и AlF3, указывает на наличие соединения NaAlF4. При медленном охлаждении происходит распад его на AIF3 и 5NaF*3AlF3. Таким образом, в жидком состоянии NaAlF4 довольно устойчив, что подтверждается и тем обстоятельством, что эти смеси являются азеотропными, т. е. в равновесии состав жидкости и пара одинаков.
Таким образом, расплавы системы NaF—AlF3 состоят из ионов: Na+, F-, AlF63- и A1F4- Комплексные ионы A1F63- и AlF4- имеют динамическую природу: возникая в одном месте, они распадаются в другом, и их следует рассматривать как временные упорядоченности ионов F- вокруг А13+.
Расплавы системы Na3AlF6—Al203
В узлах кристаллической решетки ά-глинозема находятся ионы А13+, вокруг которых группируются ионы О2- в шестикратной координации, в то время как координация ионов А13+ вокруг O2- тетраэдрическая, что обеспечивает стехиометрическое соотношение между ними. В отличие от солей в кристаллах оксидов значительна доля ковалентных связей, что накладывает определенный отпечаток на строение, в частности, растворов глинозема в криолите.
Прежде всего, возникает вопрос: почему криолит растворяет оксиды, в то время как в других расплавленных солях оксиды металлов практически не растворяются? Предполагается (Пазухин), что растворение глинозема в криолите связано с обменом ионами F- и О2- между анионами А1F63- расплавленного криолита и решеткой глинозема. Катионы А13+, принадлежащие криолиту, вырывают своим сильным полем анионы О2- из решетки глинозема. В результате этого обмена целостность кристаллической решетки глинозема нарушается и глинозем растворяется. Радиусы ионов F- (0,133 нм) и О2- (0,132 нм) близки между собой, что облегчает замену F- на О2-.
Таким образом, «растворителем» глинозема (и других оксидов) в криолите является ион А13+, входящий в криолитовые комплексы A1F63- и AIF4-.
В результате обмена F- на О2- в окружении ионов А13+ происходит образование новых оксифторидных комплексов типа AlOFx1-x, где x=2÷5. Простейший из таких комплексов A1OF2-; образование его можно представить реакцией:
Na3AlF6+ Al2O3=3NaA1OF2. (12)
Криоскопические исследования разбавленных растворов глинозема в криолите (Ролен, Холм) показывают, что понижение точки замерзания криолита при внесении в него глинозема соответствует случаю, когда растворенное вещество вносит в растворитель три «новые» частицы. Действительно, по реакции (12) на каждую молекулу глинозема образуется три новых оксифторидных иона AlOF2-.
Рассмотренные выше термодинамические характеристики глинозема, растворенного в криолите, также указывают, что растворение сопровождается заметным взаимодействием криолита и глинозема. Вместе с тем на диаграммах состав — свойство системы Na3AlF6 —А12O3 (см. рис.4, 6, 11, 12) не имеется никаких доказательств этого взаимодействия: диаграмма плавкости представляет собой простую эвтектическую систему, а на других диаграммах имеется монотонный ход изотерм. Объяснение этого состоит в том, что оксифторидные комплексы не имеют строго определенного состава: по мере роста концентрации растворенного глинозема строение оксифторидных комплексов усложняется, соотношение количеств ионов фтора и кислорода в них понижается. При больших концентрациях А12O3 в заэвтектической области, по-видимому, образуются сетки из алюминий-кислородных ионов с включенными в них ионами фтора. Вязкость таких расплавов резко увеличивается.
При равновесной кристаллизации происходит разрушение комплексов, и криолит кристаллизуется отдельно от глинозема. При закалке образуется твердый раствор глинозема в криолите.
Таким образом, глинозем, вводимый в криолитовый расплав, вступает во взаимодействие с криолитовыми комплексами и образует оксифторидные комплексы переменного состава. Расплав состоит из ионов: Na+, A1F63-, AlF4-, F-, AlOFx1-x.
Промышленный электролит. Влияние различных добавок и примесей
Промышленный электролит обладает всеми свойствами криолито-глиноземного расплава как основной его части (рис. 100). Вместе с тем в cocтaвa промышленного электролита, кроме криолито-глиноземного расплава, несколько обогащенного фтористым алюминием, входят различные добавки и примеси, поступающие с сырьем, которые в значительной мере изменяют свойства электролита.
Ранее упоминалось, что в состав промышленною электролита вместе с сырьем покупают CaF2 и оксиды различных химических соединений, а также частицы углеродистых материалов. Кроме того, для улучшения некоторых свойств криолито-глиноземного расплава в промышленный электролит вводят в виде добавок LiF, MgF2 и NaCl. В результате взаимодействия всех этих составляющих свойства промышленного электролита значительно отличаются от свойств криолито-глиноземного расплава
Наиболее детально свойства промышленных электролитов исследованы А. И. Беляевым, А. А. Костюковым, М. М Витюковым. Измерением плавкости, плотности, вязкости и электропроводности установлена количественная разница между этими свойствами образцов промышленного электролита и свойствами соответствующих расплавов системы Na3AlF6— АlF3—Al2O3 при 1000 °С.
В процессе электролиза содержание примесей относительно постоянно —изменяется во времени на незначительную величину, как и содержание добавок к электролиту. Переменными величинами, от которых зависят свойства электролита при оптимальном режиме, являются концентрация глинозема и криолитовое отношение. При применении непрерывного питания электролизеров глиноземом концентрацию его в электролите можно принять постоянной. В этом случае влияние глинозема на свойства электро лита будет практически одинаковым для электролита с различным криолитовым отношением.
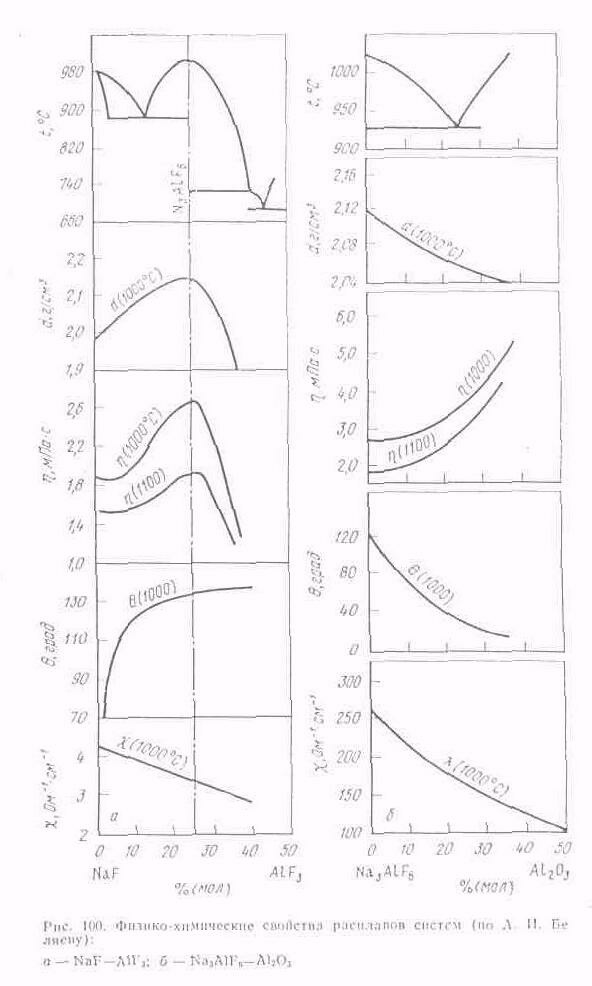
Промышленный электролит, содержащий 5% (по массе) Al2O3 и 4 % (по массе) CaF2, в зависимости от изменения криолитового отношения от 2,1 до 2,7 обладает соответственно следующими свойствами: температура начала кристаллизации 935—960°С;
плотность 2,09—2,11 г/см3; вязкость 0,295—0,325 Па.с; удельная электропроводность 1,85—2,05 См/см. Если учесть, что перегрев электролита, необходимый для нормального протекания процесса, составляет 15°С, то рабочая температура электролита такого состава должна быть 950—975 °С.
В табл. 9 приведены полученные А. И. Беляевым значения некоторых физико-химических свойств промышленною электролита, содержащею 4—6% (по массе) CaF2, в зависимости от содержания в нем глинозема и от криолитового отношения (К. О.).
Т а б л и ц а 9. Свойства промышленного электролита с 4—6% (по массе) CaF2
|
Al2O3 , % (по массе) |
||
К. О. |
8 |
5 |
1.3-2 |
Температура начала кристаллизации, ºС |
|||
2,8—2,6 |
945—940 |
960—955 |
975—970 |
2,6—2,4 |
910—935 |
955—950 |
970—965 |
2,4—2,3 |
935- 930 |
950—945 |
965—960 |
2,3—2,2 |
930—920 |
945—935 |
960—950 |
2,2—2,1 |
920—910 |
935—925 |
950—940 |
Плотность,* г/см3 |
|||
2,7—2,4 |
2,105—2,085 |
2,110—2,090 |
2,125—2,105 |
2,4-2,1 |
2.085-2.050 |
2,090—2,065 |
2,105—2,075. |
Вязкость * η•10-3, Па.с
|
|||
2,7—2,5 |
3,65-3,50 |
3,25—3,10 |
2,95 - 2,80 |
2,5—2,3 |
3,50—3,35 |
3,10—2,95 |
2,80—2,65 |
2,3—2,1 |
3,35—3,20 |
2,95—2,80 |
2,65—2,50 |
Удельная электропроводность,* См/см |
|||
2,7—2,5 |
1,85—1,75 |
2,05—1,95 |
2,25 – 2,15 |
2,5—2,3 |
1,75—1,65 |
1,95—1,85 |
2,15—2,05 |
2,3—2,1 |
1,65—1,55 |
1,85—1,75 |
2,05—1,95 |
* При рабочей температуре электролиза.
|
|||
Более низкая электропроводность и повышенная вязкость промышленного электролита по сравнению с криолито-глиноземным расплавом соответствующего состава объясняется отрицательным влиянием примесей, поступающих с сырьем, и углеродистых частичек, всегда присутствующих в промышленном электролите. При содержании в электролите 0,5% (по массе) углерода снижается его электропроводное и, на 6—7% Обычно при нормальной работе в электролите содержится 0,05- 0,1 % (по массе) углерода.
Введение различных добавок в промышленные электролиты необходимо для снижения температуры ею плавления и улучшения других его физико-химических свойств Наиболее часто применяемые добавки CaF2, LiF, MgF2 и NaCl. Все эти добавки в большей степени, чем АlF3, снижают температуру плавления электролита, а это позволяет работать с криолитовым отношением 2,7-2,9, при котором значительно уменьшается летучесть компонентов электролита и повышается его электропроводность.
Наибольшее снижение температуры плавления электролитa (на 50-55 ºС) достигается добавлением LiF; NaCl снижает температуру плавления па 30-35°С, остальные добавки—на 20—25 °С.
Отрицательным свойством всех добавок является значительное уменьшение растворимости глинозема в электролите, что осложняет обслуживание электролизеров. Для создания приемлемых условии работы содержание отдельных компонентов или суммы добавок в промышленном электролите не должно превышать 10 % (по массе), что соответствует максимальной растворимости глинозема 8—10% (по массе). При введении добавок следует учитывать также, что в их присутствии скорость растворения глинозема в электролите уменьшается.
Присутствие в электролите NaCl снижает межфазное натяжение расплава на границе с углеродистой поверхностью.
Влияние солевых добавок
Помимо основных компонентов электролита — криолита, фтористого алюминия и глинозема, в расплав специально вводят другие соли. Эти добавки изменяют физико-химические свойства электролита и приводят к улучшению показателей процесса электролиза.
Прежде чем рассматривать влияние каждой соли, выясним, какой эффект можно вообще ожидать от введения посторонних добавок в электролит.
Применяемые соли должны иметь катионы более электроотрицательные, чем А13+, а анионы более электроположительные, чем О2-. В противном случае будет происходить восстановление катионов добавок на катоде с загрязнением алюминия и окисление анионов на аноде с получением нежелательных продуктов в анодных газах. Другими словами, добавки должны быть в электрохимическом отношении индифферентными.
Первое, что ожидается от введения добавки — понижение температуры ликвидуса электролита. Действительно, введение другой соли дает более сложные системы, обычно эвтектического типа, что и приводит к понижению температуры начала кристаллизации. Необходимо, однако, иметь в виду, что понижение температуры плавления электролита не может автоматически привести к снижению рабочей температуры электролиза (со всеми вытекающими отсюда благоприятными последствиями).
Работающий электролизер находится в энергетическом равновесии с окружающей средой: сколько энергии выделяется внутри электролизера, столько расходуется на осуществление реакции и на компенсацию потерь энергии в окружающее пространство. Если в результате введения добавки произошло понижение температуры плавления электролита, то температура электролиза может снизиться только в том случае, если повысятся потери энергии в окружающее пространство. Опыт показывает, что обычно так и происходит: понижение температуры плавления приводит к уменьшению толщины гарниссажей из застывшего электролита на боковой поверхности футеровки, а также толщины корки электролита сверху ванны, отчего увеличиваются потери энергии.
Нарушенное энергетическое равновесие электролизера за счет введения добавок может быть восстановлено путем повышения плотности тока, что приводит к увеличению выделений энергии внутри электролизера до тех пор, пока не будут скомпенсированы увеличенные потери энергии. Этот путь приводит к повышению производительности электролизеров. —
Из других физико-химических свойств электролита, изменяющихся при введении добавок, отметим прежде всего электропроводимость. Повышение ее приводит при прочих равных условиях к увеличению производительности электролизеров либо за счет увеличения плотности тока при неизменном междуполюсном расстоянии, либо за счет повышения выхода по току, вызванного увеличением междуполюсного расстояния. Первый путь более эффективен.
Понижение вязкости электролита желательно для увеличения циркуляции и улучшения теплообмена и переноса растворенного глинозема между периферией и центром электролизера. С другой стороны, усиление циркуляции электролита приводит к повышению потерь металла.
Повышение плотности электролита нежелательно, поскольку уменьшается разность плотностей между электролитом и металлом, что способствует перекосу поверхности металла и увеличению высоты волн на этой поверхности. Большинство добавляемых солей имеют давление насыщенного пара значительно ниже, чем основные составляющие электролита — криолит и фтористый алюминий, что способствует снижению общего давления пара и уменьшению потерь солей с возгонами.
Добавляемые соли уменьшают активность NaF и AlF3, вследствие чего взаимодействие алюминия с электролитом ослабляется и потери металла по реакциям (25) и (26) уменьшаются, а выход по току повышается. Вместе с тем разбавление электролита индифферентной солью приводит к уменьшению активности комплексов A1F63- которые являются «растворителями» глинозема. Поэтому солевые добавки понижают растворимость глинозема, что вызывает ряд технологических затруднений: рост осадков и настылей на подине электролизеров, нарушение нормального питания глиноземом. Только введение в электролит фторидов калия могло бы привести к повышению растворимости глинозема, но соли калия никогда не вводят по той причине, что калий, восстанавливаясь на катоде, проникает в угольную футеровку и легко ее разрушает.
При выборе добавок большое внимание обращают на стоимость и доступность соли, а также на ее физические свойства, такие как гигроскопичность, склонность к гидролизу, токсичность.
В табл. 4 приведены физико-химические свойства криолитовых расплавов с добавками 10% (по массе) различных солей.
Таблица 4. Физико-химические свойства расплавленного криолита с добавками 10% (по массе) солей при 1000 °С
Соль |
Понижение температуры плавления, °С |
Плотность, г/см3 |
Удельная электропроводимость, См/м |
Вязкость, мПа*с |
Потери алюминия на 100 г расплава, г/ч |
Без добавок |
- |
2,100 |
270 |
2,75 |
1,20 |
LiF |
80 |
2,060 |
340 |
1,63 |
1,20 |
MgF2 |
59 |
2,106 |
255 |
Нет св. |
0,75 |
CaF2 |
25 |
2,162 |
265 |
2,88 |
0,95 |
NaCl |
44 |
2,010 |
308 |
2,40 |
1,30 |
MgCl2 |
92 |
2,020 |
237 |
1,50 |
1,05 |
Рассмотрим теперь более подробно влияние каждой из добавляемой соли на процесс электролиза.
Фторид кальция — обычно специально в электролит не вводят, поскольку эта соль присутствует как примесь в криолите и фториде алюминия. Диаграмма плавкости системы Na3AlF6—CaF2 эвтектического типа, с температурой эвтектики 945 °С при 50% (мол.) CaF2 (Холм). Фторид кальция понижает температуру плавления меньше, чем другие солевые добавки. Он повышает плотность и вязкость и понижает электропроводимость, что нежелательно. Фтористый кальций способствует созданию устойчивых гарниссажей и настылей и повышает выход по току.
Фторид магния—по многим свойствам более эффективная добавка, чем фторид кальция. Понижает температуру плавления значительно больше, чем другие добавки. В системе NaF—MgF2 имеется химическое соединение NaMgF3 (Костюков, Смородинов), поэтому система Na3AlF6—MgF2 является нестабильным диагональным сечением взаимной тройной системы: Na3AlF6 + 3MgF2 ↔ AlF3 + 3NaMgF3.
По некоторым данным, в системе NaF—MgF2 имеется еще одно соединение — Na2MgAlF7, что в значительной степени усложняет диаграмму состояния.
Добавка фтористого магния ухудшает смачивание расплавом угольных частиц и способствует полному отделению угольной «пены». Обычно в электролит вводят оксид магния, при этом фторид магния получается в результате реакции обмена
3MgO + 2Na3AlF6 =3MgF2 + Al2O3 + 6NaF.
Суммарное содержание фторидов кальция и магния обычно не превышает 6—8% (по массе).
Фторид лития — при взаимодействии с натриевым криолитом образует литиевый криолит Na3AlF6 + 3LiF↔Li3AlF6+3NaF, температура плавления которого 800 °С. В литиевом криолите растворимость глинозема приблизительно в 4 раза меньше, чем в натриевом. Поэтому добавки LiF в электролит приводят к резкому снижению растворимости Al2O3. Главное свойство добавок литиевых солей — сильное увеличение- электропроводимости электролита, что связано с малым, по сравнению с ионом Na+ радиусом иона Li+_ Поэтому добавки солей лития позволяют значительно' интенсифицировать процесс электролиза. Основное препятствие для использования солей лития в качестве добавок — высокая их стоимость и дефицитность.
Хлорид натрия увеличивает электропроводимость, электролита и существенно снижает температуру плавления. Реакция обменного разложения 3NaCl + Na3AlF6=6NaF+AlCl3 практически не происходит, поскольку для нее ΔG°= + 318 кДж/моль криолита. Испытания добавок хлорида натрия показали, что происходят потери ионов С1- из электролита, что связано с испарением NaCl. Взаимодействие этих паров с медными анодными спусками (в электролизерах БТ) приводит к значительной их коррозии. Другой существенный недостаток добавки NaCl — упрочнение электролитной корки, по-видимому, вследствие поглощения паров NaCl. Вместе с тем, как указано выше, добавки иона С1- в электролит приводят к заметному снижению расхода углерода. Для нивелирования упомянутых недостатков добавки NaCl эту соль вводят в электролит только в комбинации с другими добавками.
Хлорид магния существенно понижает температуру плавления и вязкость электролита. Однако применение его затруднено из-за склонности соли к гидролизу, при котором вместе с добавкой MgCl2 вносится в электролит значительное количество влаги, что недопустимо с позиций техники безопасности.
На некоторых заводах применяют совместные добавки NaCl и MgF2, при этом происходит повышение электропроводимости электролита за счет введения катионов Na+ и заметное снижение расхода углерода, поскольку вносятся анионы С1-, в то же время не наблюдаются недостатки, свойственные добавке одного NaCl.
Поведение примесей
Влияние примесей на процесс электролиза сводится, с одной стороны, к загрязнению алюминия элементами, •существенно ухудшающими его свойства, с другой — к изменению физико-химических свойств электролита, которые приводят к нарушению нормального течения электролиза. Основными источниками примесей являются исходные материалы: глинозем, фтористые соли и анодная масса (аноды). Кроме того, примеси поступают из футеровки и стального инструмента. Обычно настыли и гарниссаж, образующиеся в начальный период работы после пуска, имеют повышенное содержание примесей, поэтому нарушение работы электролизеров, связанное с расплавлением настылей и гарниссажа, также приводит к повышению содержания примесей в металле.
Влага поступает в электролит с глиноземом и фтористыми солями. Она содержится в глиноземе в двух формах: гигроскопической, удаляющейся при прокаливании на корке электролита, и связанной — в виде гидратов, которая удаляется труднее и отчасти переходит в электролит.
Фторид алюминия, содержащийся в электролите, при высоких температурах подвергается гидролизу 2/3AlF3+H2O↔1/3Al2O3+2HF при этом фтористый водород удаляется вместе с анодными газами. Константа равновесия этой реакции (Машовец и Юдин)
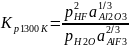 (52)
(52)
Для чистого фторида алюминия, в котором глинозем практически не растворяется (a Al2O3=l) равновесные давления будут ρHF = 95,32 кПа и ρH2O = 5,97 кПа, т. е. фторид алюминия почти нацело гидролизуется. Если принимать указанные выше значения активностей аAlF3 (см. рис. 8) и глинозема (см. рис. 10), то для электролита промышленных ванн (К.О. = 2,7 и концентрация глинозема 5% по массе) соответствующий расчет дает равновесные давления: ρHF = 38,0 кПа и ρH2O= 63,0 кПа. Эти величины давлений получены при условии, когда ρHF + ρH2O = 101,3 кПа.
Глинозем, поступающий в электролит, обычно прокаливается на корке, и основная масса воды удаляется, поэтому потери фторида алюминия относительно невелики: если считать, что в глиноземе останется 0,1% (по массе) воды, то на 1 т алюминия за счет реакции гидролиза будет затрачиваться всего 1,8 кг фтористого алюминия.
Источниками влаги являются также водород и углеводороды, образующиеся при коксовании анодной массы. Вода образуется по реакции Н2 + СO2 = Н2O + СO. Если допустить, что вся эта влага реагирует с фтористым алюминием, то потери его составят уже 19 кг на 1 т алюминия. На самом деле часть воды растворяется, в электролите и подвергается электролитическому разложению с выделением на катоде водорода, который растворяется в алюминии. При литье алюминиевых слитков водород вследствие понижения его растворимости выделяется в виде пузырьков, и качество отливок ухудшается. Для электролизеров с обожженными анодами этот источник влаги отсутствует.
Оксиды щелочных и щелочно-земельных металлов поступают в электролит в основном с глиноземом. Вредное влияние их на процесс связано прежде всего с изменением состава электролита за счет реакции обмена 2Na3AlF6 + 3Na2O=12NaF + Al2O3. В результате концентрация фторида алюминия падает и криолитовое отношение возрастает. Для корректировки состава электролита приходится вводить дорогой фторид алюминия.
Равновесное содержание натрия в алюминии составляет тысячные доли процента и повышается с возрастанием криолитового отношения и температуры. В промышленных условиях также отмечается, что повышение криолитового отношения с 2,5 до 3 вызывает увеличение содержания натрия от 0,005 до 0,014% (по массе). Между тем при производстве некоторых деформируемых сплавов на основе алюминия примесь натрия в таких концентрациях является недопустимой и приходится принимать специальные меры для его удаления.
Оксиды металлов, более электроположительных, чем алюминий (SiO2, TiO2, Fe2O3, V2O5, Сr2O3 и др.), попадают в электролит из исходных материалов или футеровки электролизеров. В электролите они хорошо растворимы и подвергаются электролитическому разложению, причем на катоде выделяется металл, загрязняющий алюминий. Часть оксидов кремния, титана, ванадия и хрома взаимодействует с криолитом по реакциям типа 3SiO2+4Na3AlF6↔3SiF4+12NaF+2Al2O3.
Хотя термодинамические расчеты показывают, что константы равновесия этих реакций малы (за исключением SiO2), но получающиеся продукты — фториды соответствующих металлов обладают большим давлением пара и уносятся анодными газами. Поэтому такие реакции играют существенную роль в удалении соответствующих примесей из электролита.
На промышленных электролизерах показано (Сенин), что 20—37% соединений ванадия, титана и хрома удаляются через системы газоулавливания.
Примеси титана, ванадия, хрома и марганца сильно снижают электропроводимость алюминия и поэтому особенно нежелательны для металла, идущего на производство проводов. Для очистки алюминия от этих примесей применяется добавка бора. Соединения бора — буру или борную кислоту вводят в электролит, где они разлагаются электролитически, а выделяющийся бор соединяется с указанными металлами, давая интерметаллиды. При этом концентрация примесей металлов в алюминии существенно понижается.
Повышение содержания бора до 0,017% приводит к снижению концентрации ванадия и титана в 5—6 раз (Сенин). Кроме того, введение бора в алюминий и его сплавы способствуют модификации — получению мелкокристаллической структуры, что улучшает пластические свойства металла.
Сульфаты и сульфиды поступают в электролит с глиноземом, фторсолями (сульфаты) и с анодной массой (сульфиды). Сульфаты вступают в обменную реакцию с криолитом 3Na2SO4+2Na3AlF6=Al2(SO4)3+ 12NaF, в результате которой повышается криолитовое отношение электролита. Растворенный в электролите сульфат восстанавливается алюминием 3Na2S04+8Al=3Na2S+ +4Al2O3, а получающийся сульфид переносится к аноду и окисляется: S2--2e = S; S + 2CO2 = SO2 + 2CO. Выделяющийся сернистый газ ухудшает условия труда в цехе.
Наличие заметных количеств серы в анодной массе нежелательно, поскольку на стальных штырях образуется корка плохо проводящего ток сульфида железа FeS, что повышает падение напряжения в аноде.
Фосфорный ангидрид Р2О5 поступает в электролит с глиноземом и фторсолями. Фосфор является вреднейшей примесью в алюминии, так как вызывает его красноломкость. Кроме того, с повышением содержания фосфора до 0,002% (по массе) заметно уменьшается коррозионная стойкость алюминия и сплавов на его основе.
Присутствие соединений фосфора в электролите приводит к улучшению смачивания электролитом угольной «пены». Взвесь углерода плохо отделяется от электролита, электросопротивление его увеличивается, электролизер перегревается и процесс электролиза нарушается.
При электролизе фосфор удаляется главным образом в виде летучих соединений (с газами) и с угольной «пеной». При флотации «пены» фосфор уходит в хвосты и не возвращается в электролит.
ТЕРМОДИНАМИКА ОСНОВНЫХ РЕАКЦИЙ
Общие сведения
Рассмотрим в общем виде реакцию разложения соединения на элементы:
AnXm=nA+mX.
Константа равновесия этой реакции, выраженная через активности компонентов, выражается уравнением:
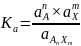
Она может быть подсчитана из величины изменения энергии Гиббса реакции:
ΔG°= - R*T*ln Ка.
По величине энергии Гиббса можно судить о возможности: протекания реакции в ту или иную сторону. При больших отрицательных значениях ΔG° реакция полностью смещена вправо, при больших положительных — она самопроизвольно не происходит. В тех случаях, когда для участников реакции известны термодинамические данные, может быть подсчитано ΔG° реакции и определена величина константы равновесия.
Если, например, известны следующие характеристики: стандартная энтальпия образования соединений, изменение энтальпии от стандартного состояния до определенной температуры и энтропия всех участников реакции, то изменение энтальпии и энергии Гиббса для реакции может быть подсчитано следующим образом. Изменение энтальпии — по величинам энтальпии компонентов реакции, причем для соединений принимается также энтальпия образования их из элементов в стандартном состоянии. Энтальпия реакции получается как алгебраическая сумма энтальпии всех компонентов, причем для продуктов реакции энтальпии принимаются со знаком плюс, для исходных веществ — со знаком минус. Изменение энергии Гиббса — из уравнения Гиббса—Гельмгольца ΔG°=ΔH°—TΔS°, где ΔS° — изменение энтропии участников реакции, Дж/(моль*К). Для подсчета ΔS° суммируются энтропии компонентов реакции, причем для исходных веществ принимаются отрицательные значения, для конечных — положительные.
В табл. 2 приведены термодинамические данные для веществ, имеющих значение при электролитическом получении алюминия, по справочнику В. П. Глушко «Термодинамические свойства индивидуальных веществ» (изд. «Наука» 1981 г.). Используя эти данные, можно рассчитать термодинамические величины для основных реакций, протекающих в алюминиевых электролизерах.
Рассчитаем, например, величины ΔН0 и ΔG° для реакции разложения глинозема на элементы при 1300 К:
А12O3(к) = 2А1 (ж) + 1,5O2(г) . (13)
Изменение энтальпии для алюминия 90,08 кДж, для кислорода 63,05 кДж, для глинозема -1537,45 кДж.
Изменение энтальпии для всей реакции ΔH = 1690,58 кДж.
Энтропия для алюминия: 163,92 Дж/(моль*К), для кислорода 379,16 Дж/(моль*К), для глинозема 213,60 Дж/ /(моль*К). Общее изменение энтропии ΔSo=329,48 Дж/ /(моль*К)
Изменение энергии Гиббса для реакции: ΔG°=ΔH°-TΔS°= 1262,26 кДж.
В расчете использованы данные для твердого глинозема. Эти данные могут быть использованы и для насыщенных растворов глинозема в электролите, поскольку химический потенциал глинозема в насыщенном растворе равен таковому для твердого глинозема. Состояние глинозема в насыщенном растворе будем принимать за стандартное, поэтому все величины для него имеют индекс ° (ΔН° и ΔG°).
Таблица 2. Термодинамические данные для веществ, имеющих значение при электролитическом получении алюминия
Вещество |
ΔH°обр(0) кДж/моль |
Температура, К |
||||
1000 |
1100 |
1200 |
1300 |
1400 |
||
А1(ж) |
0 |
35,51 |
38,69 |
41,86 |
45,04 |
48.21 |
73,63 |
76,66 |
79,42 |
81,96 |
84,32 |
||
С(кр.графит) |
0 |
12,79 |
14,99 |
17,26 |
19,59 |
21,96 |
24,45 |
26,55 |
28,52 |
30,38 |
32,14 |
||
F2(г) |
0 |
33,49 |
37,17 |
40,91 |
44,68 |
48,47 |
244,44 |
247,99 |
251,25 |
254,26 |
257,07 |
||
Cl2(г) |
0 |
34,70 |
38,42 |
42,14 |
45,88 |
49,62 |
266,60 |
270,14 |
273,39 |
276,38 |
279,15 |
||
Na(ж) |
0 |
29,91 |
32,80 |
35,72 |
38,69 |
41,73 |
94,49 |
97,24 |
99,79 |
102,16 |
104,42 |
||
Na(г) |
0 |
20,79 |
22,87 |
24,94 |
27,02 |
29,10 |
178,76 |
180,74 |
182,55 |
184,22 |
158,76 |
||
О2(г) |
0 |
31,39 |
34,90 |
38,45 |
42,03 |
45,65 |
243,47 |
246,82 |
249,90 |
252,77 |
255,45 |
||
A1C1 (г) |
—51,20 |
35,11 |
38,88 |
42,65 |
46,43 |
50,23 |
271,99 |
275,58 |
278,86 |
281,89 |
284,70 |
||
АlС13(г) |
—582,30 |
72,10 |
80,29 |
88,51 |
96,73 |
104,97 |
408,70 |
416,51 |
423,66 |
430,24 |
436,35 |
||
AlF(г) |
—265,40 |
33,72 |
37,43 |
41,15 |
44,89 |
48,63 |
257,26 |
260,80 |
264,04 |
267,03 |
269,81 |
||
AlF3(к) |
—1504,22 |
78,98 |
89,11 |
99,35 |
109,70 |
120,14 |
179.51 |
189,18 |
198,09 |
206,36 |
214,10 |
||
Al4C3(к) |
—201,96 |
127.33 |
145,38 |
163,82 |
182,64 |
201,82 |
273.33 |
290,53 |
306,57 |
321,63 |
335,85 |
||
А12О3(к) |
—1663,56 |
88,08 |
100,61 |
113,29 |
126,11 |
139,11 |
180,36 |
192,30 |
203,33 |
213,60 |
223,23 |
||
СО2(г) |
—393,14 |
42,77 |
48,26 |
53,85 |
59,52 |
65,27 |
269,19 |
274,42 |
279,28 |
283,83 |
288,09 |
||
CO (г) |
—113,81 |
30,36 |
33,70 |
37,10 |
40,54 |
44,01 |
234,43 |
237,62 |
240,57 |
243,32 |
245,90 |
||
CF4(r) |
—927,23 |
73,19 |
83,15 |
93,23 |
103,42 |
113,69 |
361,04 |
370,53 |
379.31 |
387,46 |
395,07 |
||
NaF(к, ж) |
—574,21 |
41,17 |
53,42 |
59,92 |
101,00( |
108,01 |
(к) |
(к) |
(к) |
(ж) |
(ж) |
||
116,36 |
122,32 |
127,97 |
160,42 |
165,62 |
||
NaCl(к, ж) |
—410,81 |
50,63 |
85,53 |
92,32 |
99,11 |
105,90 |
(к) |
(ж) |
(ж) |
(ж) |
(ж) |
||
139,43 |
172,07 |
177,98 |
183,41 |
188,44 |
||
Na3AlF6 (к, ж) |
—3310,05 |
231,54 |
260,33 |
289,78 |
435,51 |
474,61 |
(к) |
(к) |
(к) |
(ж) |
(ж) |
||
557,97 |
585,41 |
611,03 |
725,03 |
754,00 |
||
Примечания: 1. Числитель — величина ΔНТ°—ΔH0°, кДж/моль, знаменатель — ST°, Дж/(моль*К). 2. В скобках указано состояние вещества: г — газ; ж — жидкость; к — кристаллы
Из величины ΔG0 определяется напряжение разложения А12O3 (т.е. напряжение равновесной электрохимической системы:
Al/Na3AlF6, Al2O3 (нас)/O2
Eрo=ΔGо/(n*F)=2.18 В,
где п — число электронов, участвующих в реакции; F — постоянная Фарадея, 96486 Кл/моль.
Результаты подобных расчетов для веществ, составляющих электролит, представлены ниже:
ΔG°, кДж/ моль 1150,47/416,29
Ер°, В 3,97/4,31
В числителе — для реакции A1F3=A1+1,5F2; в знаменателе — для NaF=Na+0,5F2.
Из приведенных данных следует, что напряжение разложения Al2O3 меньше, чем NaF и A1F3, поэтому при электролизе происходит разложение глинозема. Только в некоторых специфических условиях электролиза, как будет показано в дальнейшем, возможно разложение других компонентов электролита. Кроме того, необходимо учитывать участие углерода анода во всех процессах электролиза.
Разложение глинозема
Анодные газы, выделяющиеся на промышленных электролизерах, содержат как СО, так и СО2. Эти компоненты газов образуются в результате протекания двух реакций разложения глинозема с участием углерода:
А12O3 + 3С = 2А1 + 3СО , EР°=1.109 (14)
А12O3 + 1,5С = 2А1 + 1,5СО2, EР°=1,211 (15)
Термодинамические расчеты для реакций дают величины ΔН0, ΔG° и напряжения разложения, приведенные ниже:
Температура, К |
1200 |
1223 |
1300 |
ΔН°, кДж/моль |
1352,03 |
1351,32 |
1348,95 |
1099,12 |
1098,68 |
1097,23 |
|
ΔG°, кДж/моль |
642,04 |
628,43 |
583,07 |
701,14 |
693,39 |
667,58 |
|
EР°, В |
1,109 |
1,085 |
1,007 |
1,211 |
1,198 |
1,153 |
Как будет показано ниже первичным газом при электролизе является СО2, не смотря на большее значение энергии разложения. Это объясняется тем, что анодный процесс многостадийный и конечная реакция зависит от механизма окисления углерода на аноде адсорбированными атомами кислорода.
Из этих данных следует, что изменение энтальпии реакции мало зависит от температуры, в то время как изменение энергии Гиббса и напряжение разложения заметно уменьшается с повышением температуры. Разность между ΔН° и ΔG° представляет собой связанную энергию (сумму теплот Пельтье для обоих электродов), которая для обеих реакций составляет значительную, величину.
Для реакции (15) напряжение разложения как функция концентрации глинозема известно из экспериментальных данных (Ветюков и Нгуен Ван Бан) (рис. 14).
Рис. 14. Зависимость напряжения разложения глинозема от содержания Al2O3 в системе Na3AlF6—Аl2O3 при 1000 °С:
1, 3— для реакции (14); 2, 4 — для реакции (15); 1, 2 — в мольных долях Аl2О3, для 3, 4 — lgaAl2O3
Напряжение разложения глинозема с образованием СО может быть подсчитано с учетом известной величины (ΔG°) энергии Гиббса для реакции
1,5СО2+ 1,5С = 3СО, (16)
равной при 1000°С —82,8 кДж на 1,5 моля СO2, и того, что реакция (14) представляет собой сумму реакций. (15) и (16). Отсюда следует, что напряжение разложения при 1000 °С для реакции (15) будет на 0,135 В выше при любой концентрации глинозема, чем для реакции (14).
Поскольку между напряжением разложения Ер° в стандартном состоянии и Ер при активности компонента, а имеется соотношение:
Ep=Epo-(2.3*R*T/nF)*lga (17)
то в координатах Ep— lga эта зависимость выражается; прямой линией (см. рис. 14).
Так как анодные газы содержат и СO2 и СО, суммарная реакция в электролизе состоит из реакций разложения глинозема (14) и (15). Но от условий электролиза (температуры, состава электролита и др.) зависит, какая реакция превалирует. Поэтому число молей углерода, участвующих в суммарной реакции, будет переменным (обозначим его у). Тогда суммарную реакцию можно представить уравнением:
А12O3+ уС = 2Аl + (3 - у) СO2 + (2у - 3)СО (18)
Коэффициенты при СO2 и СО получены в результате совместного решения двух уравнений. Первое относится к распределению углерода между двумя реакциями 1,5к1+3к2 = у, где к1 и к2 — доли участия реакций (14) и (15) в суммарной реакции. Второе вытекает из условия к1+к2=1.
Из этих уравнений следует: к1=(6-2у)/3; к2= (2у-3) /3. Энтальпия суммарной реакции ΔН°=к1*ΔH1+к2ΔН°2. Остальные термодинамические величины для суммарной реакции могут быть рассчитаны аналогичным образом.
Разложение фторидов
Рассмотрим реакции разложения A1F3 и NaF с учетом участия углерода и активности этих компонентов в расплаве.
Для реакции
4A1F3+3C = 4A1 + 3CF4 (19)
изменение энергии Гиббса при 1300 К составляет ΔG°1300К = 644 кДж/моль AlF3, что отвечает напряжению разложения фтористого алюминия Ер°=2,22 В. Для состава криолита, где активность A1F3 равна 3*10-4 (см. рис. 8), напряжение разложения фтористого алюминия составит 2,52 В. Эта величина соответствует энергии Гиббса для реакции разложения криолита
2Na3AlF6 + 1,5С = 6NaF + 2А1 + 1,5CF4. (20)
Для реакции
4NaF + С = CF4+ 4Na (21)
изменение энергии Гиббса для чистого фторида натрия составляет при 1300 К 253 кДж/моль, что отвечает напряжению разложения Epo = 2,62 В. Для состава криолита напряжение разложения NaF повысится незначительно: Eр = 2,70 В.
Из вышеприведенных данных следует, что напряжение разложения фторида натрия на 0,34 В выше, чем фторида алюминия. Следовательно, потенциал выделения алюминия в стандартном состоянии на 0,34 В положительнее, чем натрия. Однако, как будет показано далее, это не исключает возможности совместного разряда алюминия и натрия.
Различие между напряжением разложения фторида алюминия по реакции (19) и глинозема по реакции (15) еще более значительно и составляет при 1300 К 1,07 В. Но и в данном случае не исключается возможность совместного разряда ионов кислорода и фтора при определенных условиях электролиза. При обычных же условиях электролиза на катоде происходит восстановление ионов алюминия, на аноде — окисление ионов кислорода, причем и те, и другие ионы находятся в расплаве в виде комплексов.
Основные электродные реакции
П. П. Федотьев, создавший теорию электролиза, считал, что первичным является разложение глинозема, причем электродные реакции сводятся к следующему. На катоде: А13++3е=А1, на аноде: 2А1O33--6e=А12O3 +1,5O2.
Выделяющийся кислород взаимодействует с углеродом анода, образуя смесь СО2 и СО.
Эта точка зрения Федотьева в основном принимается и в настоящее время, но с некоторыми коррективами, вытекающими из современных представлений о строении криолито-глиноземных расплавов.
Предположим, что взаимодействие глинозема с криолитом приводит к образованию простейшего типа оксифторидных ионов — A1ОF2- и может быть представлено реакцией
Na3AlF6+ А12O3= 3NaA10F2= 3Na++3AlOF2- .
Как мы уже видели, перенос тока осуществляется почти полностью ионами Na+; разряду подвергаются оксифторидные комплексные ионы.
Катодный процесс можно представить реакцией
3A1ОF2- + 6е = 2А1 + 6F- + АlO33- . (22)
Анодный процесс:
3A1ОF2- - 6е + 1,5С = 1,5СO2 + 3А13++ 6F- . (23)
Суммарно:
2NазА1F6+2А12О3+1,5С = 2А1+1,5СО2+2Nа3А1F6+А12О3
Рассмотрим, какие изменения произойдут в анолите и католите при прохождении 6 фарадеев электричества.
В католите в результате переноса тока накопилось 6 ионов Na+, кроме того от диссоциации 3NaA1OF2 осталось 3 иона Na+. Изменение состава католита сводится к накоплению 6 молей фторида натрия и 1 моля алюмината натрия:
9Na++6F-+AlO33- =6NaF+Na3AlO3.
Из анолита в результате переноса ушло 6 ионов Na+ и осталось 6 ионов A1OF2- Три из них разрядились по реакции (23), три остались в анолите. Вместе с избыточными ионами А13+ и F-, получающимися при разряде, эти оксифторидные ионы дают 4 моля фторида алюминия и 1 моль глинозема:
3A1ОF2-+3A13++6F- =4A1F3 + А12O3.
Таким образом, в результате электролиза католит становится более «щелочным», а анолит — более «кислым». В условиях промышленного электролиза происходит энергичное перемешивание католита и анолита, и состав электролита почти выравнивается:
6NaF + Na3AlO3+ 4A1F3+ А12O3= 3Na3AlF6+2Al2O3. (24)
При пропускании 6 фарадеев электричества в процессе было вовлечено 9 молей NaA1OF2 (3 на катоде и 6 на аноде). Для образования такого количества оксифторидных комплексов понадобилось 3 моля глинозема. В результате всех процессов осталось 2 моля глинозема, один разложился при электролизе.
3NазА1F6+3А12О3+1,5С = 2А1+1,5СО2+3Nа3А1F6+2А12О3
А12О3 + 1,5С = 1,5СО2 +2А1
Взаимодействие алюминия с электролитом
Взаимодействие алюминия с электролитом приводит к растворению металла в солевом расплаве и переносу продуктов растворения к аноду, где они окисляются электрохимически на поверхности анода или химически анодными газами. В результате происходят бесполезные потери металла и выход по току на катоде становится меньше единицы. При производстве алюминия потери металла довольно значительны.
При растворении алюминия в криолито-глиноземных расплавах происходят две реакции: взаимодействия алюминия с фторидом алюминия с образованием субфторида алюминия
A1 + 1/2A1F3 = 3/2A1F. (25)
и обмена фторида натрия с алюминием
1/3A1 + NaF = Na + 1/3AlF3. (26)
Течение этих реакций в значительной степени определяется активностью фторидов алюминия и натрия в расплаве, т. е. криолитовым отношением и температурой.
Монофторид алюминия получается при взаимодействии фторида алюминия и алюминия при высоких температурах (начало заметного взаимодействия при 1000 °С). Реакция образования субфторида алюминия протекает главным образом в кислых расплавах, при достаточно больших активностях фторида алюминия. При повышении температуры реакция сдвигается вправо, при понижении — происходит распад субфторида на мелкодисперсный алюминий и фторид алюминия.
Реакция обмена между алюминием и фторидом натрия (26) в основном протекает в области нейтральных и щелочных электролитов. Получающийся по этой реакции натрий не выделяется в виде самостоятельной фазы, а образует раствор натрия в электролите. При этом также образуется раствор натрия в алюминий. Растворимость натрия в алюминии невелика: при 1000 °С она оценивается величиной в 0,45% (по массе). Растворы натрия в электролите, по-видимому, являются ионноэлектронными жидкостями.
Ниже приведена растворимость алюминия и натрия в электролите и натрия в алюминии при 1000 °С (Ветюков, Винокуров):
При 1,5% (по массе) А12Оз и К.О Растворимость, % (по массе): |
1,6 |
1,8 |
2,0 |
2,5 |
3,0 |
3,2 |
3,6 |
Na в электролите |
0,056 |
0,058 |
0,064 |
0,074 |
0,093 |
0,116 |
0,140 |
А1 в электролите |
0,138 |
0,130 |
0,102 |
0,077 |
0,063 |
0,051 |
0,043 |
Na в AI ... |
— |
0,007 |
— |
0,015 |
0,019 |
0,022 |
0,032 |
При К.О.=3 и А12О3, % (по массе) Растворимость, % (по массе): |
1,5 |
3,5 |
5,5 |
7,5 |
10 |
|
|
Na в электролите |
0,093 |
0,090 |
0,087 |
0,080 |
0,065 |
|
|
А1 в электролите |
0,063 |
0,068 |
0,064 |
0,055 |
0,058 |
|
|
Примечание. Прочерки означают, что растворимости в данных случаях не определяли. |
|||||||
С ростом криолитового отношения расплава концентрации натрия в электролите и в алюминии монотонно повышаются, что связано с увеличением активности NaF в расплаве, а концентрация алюминия в электролите понижается. Повышение концентрации глинозема при постоянном К.О. проявляется в уменьшении содержания натрия, в то же время как растворимость алюминия остается практически постоянной. Повышение температуры приводит к заметному сдвигу реакции (26) вправо: концентрация натрия в электролите при повышении температуры с 1000 до 1100 °С увеличивается в 1,5 раза; концентрация растворенного алюминия при этих же условиях повышается всего на 15%.
Несмотря на сравнительно малые растворимости алюминия и натрия в электролите, сильная циркуляция расплава в промышленных ваннах приводит к быстрому переносу катодных продуктов в анодное пространство, где они окисляются, что приводит к значительным, потерям металла.
Таблица 3. Термодинамические данные для реакций взаимодействия алюминия с электролитом
Метод определения |
Т, К |
ΔGo, кДж |
|
Реакция (25) |
|||
Расчет (Костюков) |
1300 |
45,48 |
1,49*10-2 |
Эксперимент (Ветюков, Винокуров) |
1273 |
37,5 |
2,84 *10-2 |
Реакция (26) |
|||
Расчет (Ветюков, Борисоглебский) |
1300 |
53,25 |
7,25 *10-3 |
Эксперимент (Дюинг) |
1293 |
52,15 |
7,8*10-3 |
Как видно, активность натрия почти на порядок выше, чем субфторида алюминия в расплаве криолита и резко понижается с ростом концентрации A1F3, в то время как активность A1F возрастает. Из этого следует важный практический вывод: чтобы избежать больших потерь алюминия при электролизе за счет реакции образования натрия, криолитовое отношение электролита следует сдвигать в сторону «кислых» электролитов (К.О.= 2,6 и менее).
Взаимодействие анодных газов с электролитом
Растворение газов в расплавленных солях представляет большой интерес для технологии электролиза. Анодные газы являются сильными окислителями; переходя в электролит, они окисляют растворенный металл не только на границе электролит — газ, но и во всем объеме междуполюсного пространства.
Растворимость газов подчиняется, закону Генри — сростом давления газа над расплавом растворимость увеличивается прямо пропорционально:
Cs = kpp, (27)
Энтальпию растворения можно рассматривать состоящей из двух слагаемых: одна обусловлена образованием в расплаве микрополостей, в которые входят молекулы газа (физическое растворение), другая — взаимодействием молекул газа с частицами расплава (химическое растворение). Первая, связанная с затратами энергии, положительна, вторая, связанная с выделением энергии, отрицательна. Если имеет место чисто физическое растворение, без заметного взаимодействия жидкости и газа, то с повышением температуры растворимость газа увеличивается. При химическом взаимодействии жидкости и газа растворимость с повышением температуры уменьшается.
Для криолито-глиноземных расплавов растворимость уменьшается с повышением температуры, энтальпия растворения отрицательна (-17 кДж/моль). Процесс растворения сводится к взаимодействию СО2 с оксифторидными комплексами расплава:
AlOFx1-x + СO2= A1Fx3-x+ СO32- .
Чем выше активность комплексов AlOFx1-x, тем больше растворимость СO2 в расплаве (рис. 16, б). Повышение температуры сопровождается распадом комплексов AlOFx1-x, и растворимость СO2 уменьшается.
КИНЕТИКА ЭЛЕКТРОДНЫХ ПРОЦЕССОВ
