
286_p495_B13_2904
.pdf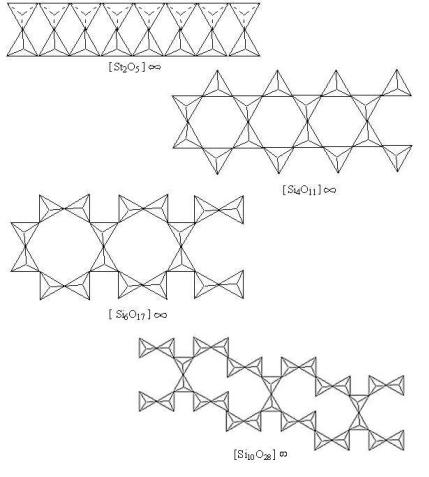
Типы ленточных силикатных мотивов
Рис. 6.2
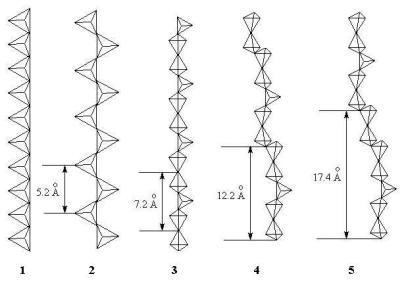
Типы цепочечных силикатных мотивов
1 – одночленная цепь;
2 – двучленная цепь;
3 – трехчленная цепь;
4 – пятичленная цепь;
5 – семичленная цепь.
Рис. 6.3.
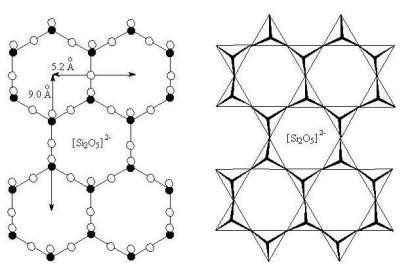
Тип слоистого силикатного мотива
Рис. 6.4
4.Каркасные силикаты с бесконечными трехмерными кремнекислородными радикалами.
Примером силиката с изолированным расположением тетраэдров, соединяющихся между собой через положительно заряженные ионы металлов, может служить природный минерал – оливин.
В том случае, если одна из четырех вершин кремнекислородного тетраэдра занята кислородом и используется для связи со вторым таким же тетраэдром, а остающиеся в сдвоенной группировке шесть атомов кислорода служат для связи с катионами, получается простейший тип сочлененных тетраэдров – радикалов [Si2O7]6-, лежащий в основе всей кристаллохимии силикатов с крупными катионами (калия, натрия, стронция, кальция, редкоземельных элементов), объединяемыми Беловым во «вторую главу» силикатной кристаллохимии. В первой же оказываются силикатами малых катионов – алюминия, железа, магния. Таким образом, классическая кристаллохимия силикатов Брегга определяется сравнительно «мелкими» катионами Mg, Fe, Al, которые создают вокруг себя кислородные октаэдры, ребра которых (2,7- 2,8 Ǻ) близки ребрам Si-тетраэдров, и здесь основной строительной силикатной единицей становится более крупная группа - Si2O7.
Если же в структуре островного силиката присутствуют комплексы из трех, четырех или шести тетраэдров, соединяющихся через общие “мостиковые” атомы кислорода, мы получаем характерные кольцевые изолированные радикалы состава [Si3O9]6-, [Si4O12]8-, [Si6O18]12-. В некоторых структурах,
например, в минерале миларита – KCa2AlBe2[Si12O30]·nH2O найдены двойные двухэтажные шестичленные
кольца [Si12O30]12-.
Все рассмотренные типы структур силикатов характеризуются наличием в них кремнекислородных радикалов, состоящих из одного, двух и большего, но конечного числа тетраэдров (табл. 6.1).
Таблица.6.1
Островные и цепочечные радикалы в структурах силикатов
Радикал |
Минерал |
Структурная формула |
|
|
минерала |
|
Островные |
радикалы |
[SiO4]4- |
Оливин |
(Mg,Fe)2[SiO4] |
|
|
|
|
|
|
[Si2O7]6- |
Тортвейтит |
Sc[Si2O7] |
[Si3O9]6- |
Бенитоит |
BaTi [Si3O9] |
[Si4O12]8- |
Баотит |
Ba(Ti,Nb)8O16Cl[Si4O12] |
[Si6O18]12- |
Берилл |
Be3Al2[Si6O18] |
[Si12O30]12 |
Миларит |
KCa2AlBe2[Si12O30] |
-
|
Цепочечные радикалы |
|
|
|
|
[SiO3]2- |
Синтет.метагерманат |
Cu[GeO3] |
|
меди |
|
[Si2O6]4- |
Диопсид |
CaMg[Si2O6] |
[Si3O9 ]6- |
Волластонит |
Ca3[Si3O9 ] |
|
|
|
|
|
|
[Si5O15]10- |
Родонит |
(Mn,Ca)5[Si5O15] |
[Si7O21]14- |
Пироксмангит |
(Mn,Fe,Ca)7[Si7O21] |
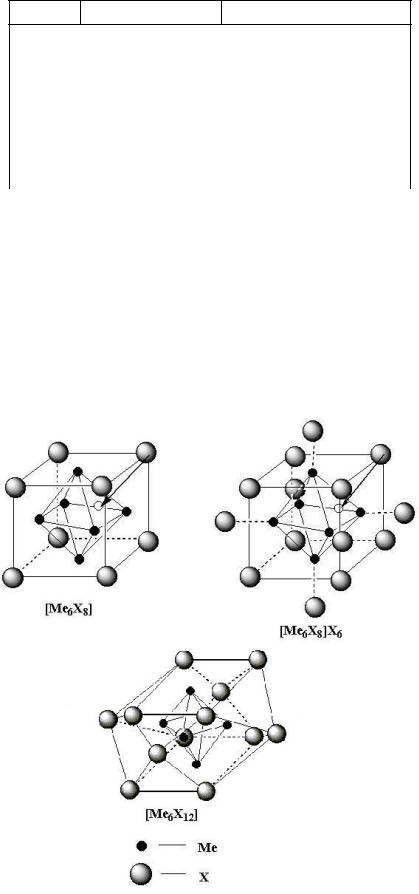
В состоянии низшей валентности (II, III) атомы Nb, Та, Мо, и W образуют с атомами С1, Br, I, а иногда также сo F комплексы, так называемые кластеры, в которых шесть атомов металла занимают вершины октаэдра, центр которого остается пустым. Атомы галогенов при этом могут располагаться тремя разными способами (рис. 6.5):
1) восемь атомов галогена могут окружать октаэдр из атомов металла по кубу так, что каждый атом галогена будет лежать над центром одной из граней октаэдра и принадлежать одновременно трем атомам металла;
3)двенадцать атомов галогена могут располагаться над ребрами октаэдра из атомов металла. Они занимают тогда углы кубооктаэдра (так называется геометрическая фигура, которая образуется из куба, если соединить середине его ребер). В этом случае каждый атом галогена имеет соседями два атома металла;
Строение комплексов с октаэдрическими кластерами [Me6]
Рис. 6.5
3) наконец, шесть атомов галогена могут располагаться на телесных диагоналях октаэдра. Они легко размещаются такими группами, как ОН- и Н2О, причем в растворе легко отщепляются лишь эти атомы
галогена, так что в целом комплексы в растворах обычно устойчивы. В структурах МоС12 лежащие в одной плоскости атомы С1 этого третьего типа связывают между собой комплексы образуя слои состава
[Mo6Cl8]Cl2Cl4/2 = 6MoCl2. Такое же строение имеют MoВr2, WCl2 , и WBr2 , хотя в [Nb6I8]I6/2 = Nb6I1,
отдельные комплексы [Nb6I8]3- образуют уже не слои, а трехмерный каркас.
Тяжелые элементы пятой побочной подгруппы ниобий и тантал образуют комплексные соединения типа [Me6X12]n+Xn. Если при этом для связи комплексов [Me6X12]]n+ использованы все атомы Х третьего
типа, то получаются соединения с n=6/2 состава [Me6X12]X6/12= 6MeX2,5, такие, как NbF2,5.
Нетрудно заметить, что эта структура выводится из структуры ReO3, в которой атомы Re заменены кластерами [Nb6] или, точнее [Nb6F12] , а атомы O - дополнительными атомами F. Пустоты подобной решетки так велики и расположены таким образом, что реальный кристалл состоит из двух одинаковых подрешеток, вставленных одна в другую.
Для связи кластеров между собой используются не только внешние атомы Х, но также два из внутренних атомов галогенидов. Структура подобного типа близка к рассмотренной ранее структуре NbО, но с той разницей, что в последней структуре для связи октаэдров [Nb6] используются все атомы О, причем каждый из одновременно принадлежит двум октаэдрам. Электронное строение кластеров [Me6X8}2+ и [Me6X12]4+ было рассмотрено недавно Коттоном и Хассом на основе метода молекулярных орбиталей. Выберем на каждом атоме металла Ме-октаэдра свою локальную систему декартовых координат хуz, ось z которой будет направлена к центру октаэдра, а также возьмем некую общую систему прямоугольных координат ХУZ, начало которой будет находиться в центре октаэдра, а оси будут параллельны его четверным осям.
Поскольку теперь квадрат из четырех атомов галогенидов будет располагаться в плоскости ху каждого атома Ме, можно считать, что в соответствующих связях Ме-Х заняты dх-уsр2 - орбитали атомов Ме. В таком случае, для связи между атомами металла в Ме-октаэдре имеются функции dz, dxy,dyz, dxz и pz каждого атома.
Первая молекулярная орбиталь в Ме-октаэдре тогда получается, если просто взять сумму орбиталей всех шести атомов Ме. При всех операциях симметрии октаэдра (включая инверсию) эта орбиталь переходит сама в себя. Другую молекулярную орбиталь можно получить, взяв аналогичную сумму
всех dxy-,dyz-, dxz -орбиталей.
Нетрудно заметить, что при вращениях октаэдра эта орбиталь также переходит в себя, в то время как при инверсии в центре симметрии она меняет свой знак на противоположный.
Наконец, еще две группы получаются из dxy-, dyz-орбиталей всех шести атомов Ме. Всего, таким образом, в октаэдре получится 1+1+3+3=8 связывающих орбиталей, которые могут быть заняты 16 электронами.
В некоторых клатратных соединениях пустоты могут располагаться друг над другом с образованием широких труб, в которых могут размещаться мелкие молекулы, в частности молекулы воды. В этом отношении клатратные соединения по своему строению становится неотличимыми от цеолитов.
Клатратные соединения обладают рядом специфических свойств, благодаря которым в последние годы к ним привлекается большое внимание. Особый интерес представляют также клатратные соединения, в пустотах которых находятся металлические атомы. В некоторых клатратах серебра, в частности, наблюдалась сверхпроводимость, которая до сих пор наблюдалась лишь у металлов или интерметаллических соединений с особыми структурами.
Хотя связь [МеХ6] - октаэдров через общую грань наблюдается во всех соединениях, реальное укорочение расстояния Ме-Ме наблюдается только в соединениях вольфрама. При этом, соответствующие атомы вольфраму смещены из центров октаэдров по направлению к общей грани и соединение К3W2Cl9 диамагнитно, тогда как в структуре Cs3Cr2Cl9 смещение атомов хрома происходит в обратном направлении и это соединение обладает спиновым парамагнетизмом, соответствующим наличию трех неспаренных электронов на атом.
Укорочение межатомного расстояния в ионе [W2Cl9]3- и диамагнетизм такого комплекса можно объяснить взаимодействием d-орбиталей обоих атомов вольфрама. Подобную систему связей можно продолжить в направлении тройной оси иона [Ме2С19]3-, что и реализуется в структуре МоВr3.
При этом, в решетке цепи расположены так, что атомы брома образуют слои с последовательностью типа АВАВ... как в случае гексагональной плотнейшей упаковки шаров. Наконец, расположение атомов молибдена в структуре МоВr3 можно получить из структуры FeCl3 , если в решетке FeCl3 удалить каждый второй атом Fe в слое из атомов железа и поместить его посредине между двумя атомами железа, лежащими один над другим. Упаковка при этом, приобретает такой же характер, как в структуре WCl6, с той разницей, что в направлении оси x имеется вдвое больше атомов больше атомов металла.
Метастабильная форма NbI3 в структуре MoBr3. На рентгенограмме этого соединения отчетливо видна сверхструктура, которую можно объяснить удвоением периода а. Это показывает, что в структуре типа MoBr3 могут возникать искажения, однако характер последних не установлен.
Известны нам и такие типы соединений, в которых атомы металла связаны особым типом химической связи с несколькими углеродными атомами, образующими определенный цикл. Систематическое исследования
соединений, в которых металлический атом связан с несколькими углеродными атомами, началось с работы Пфафа и Фишера (1953 г.).
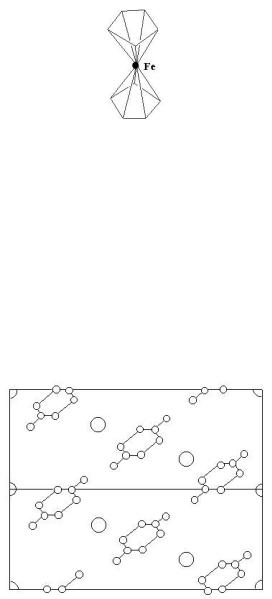
Рентгеноструктурный анализ ферроцена Fe(C5H5)2 (бис-циклопентадиенила двухвалентного железа) показал (рис. 6.6), что структура его молекулярная и состоит из двух плоских параллельно расположенных углеводородных пятиугольников, причем каждая вершина (атом углерода) одного пятиугольника приходится между двумя вершинами второго пятиугольника. Между этими двумя пятиугольниками в центре симметрии на оси пятого порядка молекулы размещается атом железа. Такие структуры стали называть сэндвичевыми. Расстояние железо-углерод равное 2,0 Ǻ, точно соответствует сумме ковалентных радиусов. Поскольку плоская форма органических радикалов связана с наличием в них π-связей, и этот же тип связи обуславливает тип соединения, их стали называть π -комплексами, а саму связь многоцентровой. Координационное число в соединении ферроцена равно 2.
Молекула ферроцена
Рис. 6.6
Под термином “клатратное соединение” понимается соединение двух или большее числа молекулярных соединений, в котором одна молекула большая, а вторая – небольшая, например
3C6H4(OH)2M, где М – SO2, H2S, HCN, HCl, HBr, HCOOH, CH3CN и др. В подобных соединениях оба типа молекул сохраняются (рис. 6.7). Одни из них в результате системы водородных связей образуют каркас с пустотами. В эти пустоты и попадают целиком небольшие молекулы другого вещества. Кристаллохимический подход к проблеме позволил выяснить не только формально-геометрические закономерности их строения, но и обнаружить и детально исследовать новые типы химического взаимодействия, которые ускользали от внимания исследователей, пока они пользовались в своей работе только препаративными химическими методами.
Два типа молекул в клатратных соединениях
Рис. 6.7
Вопросы к семинару по теме: Обобщенная кристаллохимия
•Конденсированные фазы с различной степенью упорядоченности. Дальний и ближний порядок. Кристаллы и квазикристаллы. Несоразмерные структуры. Многообразие мезофаз.
•Строение жидких кристаллов. Жидкокристаллические полимеры.
•Кристаллы с частичной неупорядоченностью. Ротационно-кристаллическое состояние.
•Микродвойникование, полисинтетические сростки. Доменные структуры.
•Элементы ближнего, среднего и дальнего порядка в жидкостях.
•Кластеры и их строение
•Биополимеры и их структура.
Строение кристаллов тернарных соединений и силикатов
•Опишите кристаллическую структуру K2PtCl6.
•В чем сходство и в чем различие структур кальцита и арагонита?
•Какие изменения в структуре BaTiO3 (тип перовскита) происходят при переходе в сегнетоэлектрическое состояние?
•Какой вариант структурного типа шпинели (нормальная, обращенная или промежуточная шпинель) следует ожидать для двойных оксидов NiFe2O4, ZnCr2O4, NiCr2O4?
•В чем заключается основное различие кристаллических структур алюмосиликатов и силикатов алюминия?
•Изобразите характерные кремнекислородные мотивы островных силикатов и укажите их составы.
•Изобразите характерные кремнекислородные мотивы цепочечных силикатов и укажите их составы.
•Приведите пример характерного расположения кремнекислородных тетраэдров в слоистых силикатах (требуется изобразить расположение кремнекислородных тетраэдров и указать состав слоя).
•Приведите примеры зависимости свойств силикатов от их структуры.
•Какие структурные особенности характерны для цеолитов?
•В чем состоит основное различие кристаллических структур силикатов и карбонатов?
•Каковы основные особенности кристаллических структур пентасилов?
Заключение
Кристаллохимия, возраст которой приближается к столетию, все еще молодая наука. Она продолжает бурно развиваться, испытывая сильное влияние со стороны квантовой химии и физики твердого тела, но, не сливаясь с ними. В свою очередь, кристаллохимия активно перерабатывает и затем вносит современное представление о строении вещества в сопредельные области знания – минералогию, геохимию, материаловедение и др. В последние годы кристаллохимия подошла вплотную к решению задач теоретического моделирования кристаллической структуры и свойств неорганического кристалла, исходя из поиска минимума энергии взаимодействия атомов. В таком подходе кристаллохимии, видны возможности прогнозирования, практического приложения и ближайшие перспективы развития самой науки.
Список литературы
Основная литература
•П.М. Зоркий. Симметрия молекул и кристаллических структур.– М.: Моск.ун-та, 1986,-232 с.
•Г.Б. Бокий. Кристаллохимия.–М.: Наука, 1971,-400 с.
•Т. Пенкаля Очерки кристаллохимии.–Л.: Химия, 1974,- 496 с.
•Г. Кребс Основы кристаллохимии неорганических соединений.–М.: Мир, 1971-304 с..
•Я.С. Уманский и др. Кристаллография, рентгенография и электронная микроскопия.–М.: Металлургия, 1982,-632 с.
Дополнительная литература
•И. Харгиттаи, М. Харгиттаи. Симметрия глазами химика.–М.: Химия, 1989216 с.
•А. Уэллс. Структурная неорганическая химия. 1987. Т. 1-3.
•В.С. Урусов. Теоретическая кристаллохимия.–М.: МГУ, 1987. –275 с.
•Молекулярные структуры. Прецизионные методы исследования/ Ред. А. Доменикано, И. Харгиттаи.
М., Мир. 1997,–235 с.
•П.М. Зоркий. Очерки истории кристаллохимии. Российский химический журнал. 1996, Т. XL, № 3.
С. 103-120.
Приложение
Таблица 1
Точечные группы низшей и средней категории
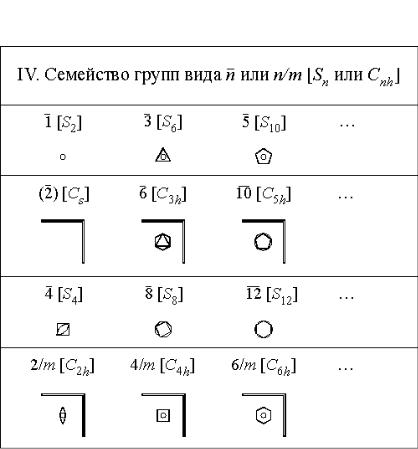
Таблица 2
Точечные группы низшей и средней категории
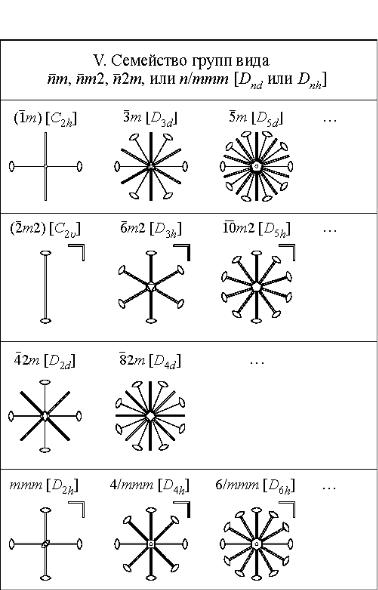
Таблица 3
Точечные группы низшей и средней категории
