

Электрохимические процессы.
При выполнении задания следует помнить, что участники потенциалопределяющей реакции находятся в стандартном состоянии, если относительные давления pi = 1 (для газов) и активности ai = 1 (для растворов).
1. Электрохимические процессы, гальванический элемент
Таблица 1.
Исходные данные к заданию 1
Номер |
Гальванический элемент |
m, г / V, мл |
варианта |
|
|
|
|
|
№ |
Zn Zn2+ Ag+ Ag |
24 г |
Пример выполнения 1.1. Для данного гальванического элемента (ГЭ) вашего варианта
определите анод и катод, (считать условия стандартными), составьте уравнения процессов, протекающих на каждом из электродов в работающем гальваническом элементе, запишите уравнение токообразующей (ТОР) реакции.
Заданный элемент состоит из двух металлических пластин цинковой и серебряной, погруженных в водные растворы своих солей. Считая условия стандартными, определяем по таблице, приведенной в приложении в конце пособия [1] или практикума [2], значения
стандартных электродных потенциалов Zn и Ag: EZn0 2 / Zn 0,763 В,
E0 |
|
/ Ag |
0,799 |
В. В гальваническом элементе электрод, с более |
Ag |
|
|
|
электроотрицательным значением потенциала является анодом. Т.к. EZn0 2 / Zn < EAg0 / Ag , серебряный электрод – катод, цинковый электрод –
анод. При работе ГЭ электроны по внешней цепи будут переходить от цинкового электрода к серебряному. При этом на цинковом аноде будет протекать реакция окисления:
A: |
Zn → Zn2+ + 2e. |
(23) |
Электроны направляются от |
цинкового электрода во внешнюю |
|
цепь, а в раствор выходят ионы цинка. При этом на серебряном катоде будет протекать реакция восстановления ионов серебра из раствора:
K: Ag+ + e →Ag |
(24) |
Алгебраическая сумма анодной и катодной реакций |
с учетом |
баланса электронов даёт суммарную реакцию, которая называется токообразующей (ТОР). Для заданного гальванического элемента ТОР:
Zn + 2Ag+ → Zn2+ + 2Ag. |
(25) |
1
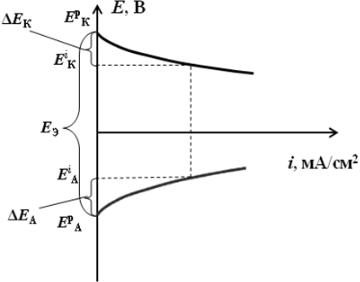
1.2. Покажите ход поляризационных кривых и объясните причину изменения значений равновесных электродных потенциалов анодного и катодного процессов при прохождении тока.
Зависимость потенциала электрода от плотности тока отражают поляризационные кривые. Плотность тока (i) – это ток, отнесенный к единице площади поверхности электрода. Потенциал электрода
определяется как |
разница потенциалов исследуемого электрода и |
|||||||
|
|
|
|
некоторого |
|
электрода |
||
|
|
|
|
сравнения |
(водородного, |
|||
|
|
|
|
каломельного и др.) в |
||||
|
|
|
|
отсутствии |
тока. |
На |
||
|
|
|
|
рисунке |
1 |
представлены |
||
|
U |
|
|
типичные поляризационные |
||||
|
+ I(r1 + r2) |
|
||||||
|
|
кривые |
двух |
электродов |
||||
|
|
|
|
|||||
|
|
|
|
|||||
|
|
|
|
|
цинк-серебряного |
|||
|
|
|
|
гальванического |
элемента. |
|||
|
|
|
|
Разность |
|
потенциалов |
||
|
|
|
|
положительного |
|
и |
||
|
|
|
|
отрицательного |
электродов |
|||
|
|
|
|
в отсутствии тока − это |
||||
|
|
|
|
ЭДС |
гальванического |
|||
Рис. 1. Поляризационные кривые для |
элемента |
|
(EЭ). |
В |
||||
электродов |
в |
гальваническом |
работающем |
|
ГЭ |
при |
||
элементе. |
|
|
|
прохождении |
|
тока |
(I) |
|
|
|
|
|
напряжение |
(U) меньше |
|||
ЭДС из-за явления поляризации катода ( EК), анода ( ЕА) и омического падения напряжения на сопротивлении (r1) в проводниках с электронной проводимостью (проводниках первого рода) и на
сопротивлении (r2) в электролите (проводнике второго рода) |
|
U = EЭ – I(r1 + r2) – EK – EA . |
(26) |
Поляризацией или перенапряжением называется алгебраическая разность между потенциалом электрода при заданной плотности тока (Ei) и потенциалом этого электрода без тока (Ep). Для катода: EК = EpК
– EiК, для анода: EК = EpА – EiА. Причины поляризации различны и определяются замедленностью отдельных стадий электрохимической реакции.
1.3. Рассчитайте стандартную ЭДС элемента при 298 К двумя способами, исходя из электрохимических и термодинамических данных.
Первый принцип термодинамики в электрохимии связывает ЭДС гальванического элемента с изменением энергии Гиббса токообразующей реакции:
2
– G = nFE или E = – G/nF , |
(27), |
где n – количество электронов, участвующих в ТОР (для реакции (25) n = 2), F – фундаментальная константа, называемая постоянной Фарадея (96487 Кл/моль или 26,8 Ач/моль).
ЭДС гальванического элемента: ЕЭ = ЕК – ЕА. |
(28) |
||
Таким образом, один способ расчета ЭДС – по разности |
|||
потенциалов катода и анода, а другой – через |
rG0298ТОР. |
|
|
Стандартное изменение энергии Гиббса ( |
rG0298) при протекании |
||
ТОР вычисляется по формуле |
|
|
|
rG0298 = ∑νi fG0298, продуктов – ∑νj |
fG0298, исх веществ. |
(5) |
|
Для расчета нужно из справочника |
[3] или из |
таблиц в |
|
приложении [1, 2] выписать термодинамические характеристики участников реакции (25).
Таблица 2.
Термодинамические характеристики веществ
Вещество |
f G0298, кДж/моль |
Zn |
0,00 |
Zn2+ |
–147,16 |
Ag |
0,00 |
Ag+ |
77,10 |
Согласно формуле (5) для реакции (25):
rG0298 = –147,16 – 2·77,10 = – 301,306 кДж. ( G 0, процесс может протекать самопроизвольно в прямом направлении)
Расчет Е0Э из значения rG0298 токообразующей реакции (25) нужно проводить по формуле (27), обращая внимание на размерность:
Е0Э = – (–301306/2·96500) = 1,561 В.
Расчет Е0Э другим способом по формуле (28) приводит практически к такой же величине: Е0Э = 0,799 – (– 0,763) = 1,562 В.
1.4. Рассчитайте максимальную электрическую работу, произведенную заданным гальваническим элементом, если известно, что при его работе в анодном процессе растворилось m г металла (в случае металлического анода) или поглотилось/выделилось V мл газа (в случае газового анода, при н.у.).
Электрическая работа, которую совершает система:
А = nFЕ0Э,
По определению постоянной Фарадея для того, чтобы на электродах претерпело превращение количество вещества 1 моль-экв, необходимо затратить 96500 А с.
По условию на аноде растворилось m = 24 грамма Zn, что соответствует количеству молей: m/MZn = 24/65 = 0,34 моль.
Количество электричества, которое тратится на растворение 0,34 моль цинка составит:
3
0,34· 96500 = 32810 А с.
Тогда максимальная электрическая работа, произведенная заданным гальваническим элементом при указанных условиях:
Амаx = nFЕ0Э = 2 ·32810·1,562 = 102,498 кДж.
1.5. Предложите способы увеличения напряжения вашего элемента.
Общий путь снижения всех составляющих поляризации и повышения напряжения гальванического элемента – увеличение удельной поверхности электродов, повышение температуры, изменение концентрации реагентов, перемешивание электролита, применение каталитически активных электродов. Для заданного цинк-серебряного элемента увеличить напряжение возможно за счет: повышения температуры, перемешивания электролита или его принудительной циркуляции, уменьшения расстояние между электродами, увеличения площади поверхности электродов, изменения активности (концентрации) потенциалопределяющих ионов. В данном случае нужно понизить концентрацию ионов Zn2+ и увеличить концентрацию ионов Ag+.
Литература
1.Коровин Н.В., Общая химия: учебник для вузов / Н.В. Коровин. – М: Академия, 2012. – 557 с.
2.Лабораторные работы по химии, лабораторный практикум, под редакцией профессора Н.В. Коровина – М: «Высшая школа», 2007.
–256 с.
3.Краткий справочник физико-химических величин. Под редакцией Равделя А.А., Пономаревой А.М. – М: Издательство.
Вербум, 2010. – 232 с
4
