
Задание 1 Химическая кинетика (таблица 1)
|
|
Исходные данные к заданию 1 |
Таблица 1 |
|||||
|
|
|
|
|
|
|
|
|
Номер |
|
Реакция |
с0А, моль/л |
|
υ0, |
|
сτВ, моль/л |
|
варианта |
|
|
моль/л·с |
|
|
|||
|
|
|
|
|
|
|
||
№ |
|
2А→ В+2С |
2,0 |
|
3,56·10–3 |
|
0,55 |
|
1.1. Задана химическая реакция (см. таблицу 1): |
|
|
||||||
|
|
|
2А → В + 2C |
(10) |
||||
По условию |
эта реакция |
элементарная, |
следовательно, порядок |
|||||
реакции совпадает со стехиометрическим коэффициентом реагента и равен 2.
Основное кинетическое |
уравнение для реакции второго порядка: |
||
υ |
= |
k c2 |
(11) |
0 |
|
A |
|
Размерность константы скорости для реакции второго порядка л / (моль с)
1.2. По условию начальная скорость реакции υ0 = 3,56·10–3 моль/л·с и начальная концентрация вещества с0А = 2,0 моль/л (таблица 2). Константу скорости и период полупревращения необходимо определять по формулам в соответствии с порядком реакции. Для реакции (10), имеющей второй порядок, константу скорости реакции можно найти из соотношения (11):
k |
|
0 |
|
3,56 10 3 |
8,9 10 4 |
л / (моль с) |
|
c2 |
22 |
||||||
|
|
|
|
||||
|
0 A |
|
|
|
|
||
Период полупревращения для реакции |
второго порядка вычисляется по |
||||||
уравнению: 1/ 2 |
|
1 |
|
|
|||
|
(12) |
||
|
|
k c0 |
|
Для заданной реакции (10) τ1/2 = 1/(8,9·10–4·2,0) = 561,8 с или 9,36 мин.
1.3. Находить концентрацию реагента A в момент времени когда концентрация продукта реакции В достигнет значения сτВ удобнее через таблицу материального баланса.
Таблица материального баланса для реакции (10)
Концентрация |
A |
B |
C |
начальная, с0, моль/л |
2,0 |
0 |
0 |
изменение, Δ, моль/л |
2x |
x |
2x |
в момент времени τ, сτA, моль/л |
2,0 – 2x |
0 + x |
0 + 2x |
По условию концентрация продукта В реакции (10) через некоторое время τ достигнет значения сτВ = 0,55 моль/л, следовательно x = 0,55. Тогда концентрация реагента А с учетом стехиометрии к заданному моменту времени: сτА = 2,0 – 2·0,55 = 0,9 моль/л.
Выражение для константы скорости реакции второго порядка:

1 1
Тогда время k c
|
|
|
|
|
|
|
|
1 |
|
1 |
|
|
1 |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
k |
|
|
|
c |
|
(13) |
|||||||||
|
|
|
|
c |
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
||
|
1 |
|
|
1 |
|
|
|
1 |
|
|
|
1 |
|
|
|
|
|||
|
|
|
|
|
|
|
|
686,64 |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
с или 11,44 мин. |
||||||
|
8,9 10 |
4 |
|
|
|
|
|
|
|||||||||||
|
c0 |
|
|
|
|
0,9 |
|
2,0 |
|
|
|
|
|||||||
Скорость реакции в этот момент времени рассчитывается по уравнению (11):
υτ = 8,9·10–4·0,92 = 7,21·10–4 моль/л·с.
Вывод: При уменьшении концентрации реагентов скорость реакции снижается. По мере протекания реакции (10) исходная концентрация реагента с0А = 2,0 моль/л уменьшается и через 11,44 минут составит сτА = 0,9 моль/л. При этом скорость реакции снижается от ее начального значения υ0 = 3,56·10–3 до значения υτ = 7,21·10–4 моль/л·с.
Задание 2.
Растворы электролитов (таблица 2)
Данные для выполнения задания приведены в таблице
Таблица 2
Исходные данные к заданию 2
|
Наименование вещества |
Концентрация |
|||
|
вещества |
||||
|
|
|
|
||
|
|
|
|
|
|
№ |
1 |
2 |
3 |
1а |
2а |
1 |
Ba(ОН)2 |
H2СO3 |
SrSO4 |
0,002 |
0,005 |
2.1. В таблице 2 (столбец 1а) даны молярные концентрации для растворов электролитов из столбца 1. Зная молярную концентрацию своего раствора,
определите молярную концентрацию эквивалента, массовую долю вещества и титр раствора, принимая его плотность равной единице.
Молярная концентрация эквивалента вещества (нормальная концентрация) сН – это отношение количества вещества эквивалента в
растворе к объему этого раствора. сН – связана с молярной концентрацией сМ соотношением
cH cM Z , где Z – эквивалентное число. (Расчет эквивалентного числа
для различных веществ см. в Приложении к разбору задания).
По условию см(Ba(ОН)2) = 0,002 моль/л
Эквивалентное число Z основания = n(ОН–), где n(ОН–) – число отданных в ходе реакции ионов ОН– (см. Приложение).
Для заданного основания Ba(ОН)2 Z = 2.Тогда молярная концентрация эквивалента будет равна
сН = 0,002·2 = 0,004 моль-экв/л.
Массовая доля вещества в – это отношение массы растворенного вещества к общей массе раствора.
Найдем массу растворенного вещества. По условию в 1 литре раствора содержится 0,002 моля Ba(ОН)2. Принимая плотность равной 1, считаем, что эти 0,002 моля содержатся и в 1000 граммах раствора. Тогда рассчитаем массу Ba(ОН)2 (m), соответствующую этому количеству молей.
m = n·M, где n – количество молей, M – молярная масса.
Молярная масса Ba(ОН)2 M = 137 + (16+1)·2 = 171 г. m = 0,002·171 = 0,342 г
Масса раствора при единичной плотности составит 1000 г. Тогда массовая
доля Ba(ОН)2 |
|
|
|
||
|
|
mв ва |
|
0,342 |
100% 0,034% |
|
|
||||
в ва |
|
mр ра |
1000 |
|
|
|
|
|
|||
Титр раствора – это отношение массы растворенного вещества (в граммах) к объему раствора (в мл).
T mв ва |
|
0,342 |
0,000342 г / мл |
|
|||
Vр ра |
|
1000 |
|
2.2. Рассчитайте массу электролита из пункта 2.1, необходимую для приготовления 800 мл водного раствора с молярной концентрацией ст.1а, принимая его плотность равной единице.
По условию в 1000 мл раствора содержится 0,002 моля Ba(ОН)2. Тогда в 800 мл количество молей Ba(ОН)2 составит 0,002 · 800 / 1000 = 0,0016 моль.
Рассчитаем массу Ba(ОН)2 (m), соответствующую этому количеству молей. m = n·M, где n – количество молей, M – молярная масса (считали выше).
m = 0,0016·171 = 0,274 г
2.3. Из 3-х веществ (столбцы 1 – 3) вашего варианта выберите сильные и слабые электролиты и составьте уравнение диссоциации их в водном растворе. Дайте определение сильных и слабых электролитов.
Основание Ba(ОН)2 относится к сильным электролитам. Сильные электролиты диссоциируют практически полностью (в растворе отсутствуют не распавшиеся на ионы частицы) и необратимо. Уравнение диссоциации для
Ba(ОН)2: |
|
|
|
2+ |
+ 2ОН |
– |
(14) |
Bа(ОН)2 → Bа |
|
Угольная кислота H2СO3 является слабым электролитом. Слабые электролиты диссоциируют частично (на ионы распадается только часть молекул) и этот процесс обратим. Молекулы многоосновных кислот и
оснований диссоциируют ступенчато. Уравнения для каждой ступени
диссоциации H2СO3: |
H2СO3 HСO3– + H+ |
|
1. |
(15) |
|
2. |
HСO3– СO32– + H+ |
(15’) |
Соль SrSO4 относится |
к сильным электролитам (все соли |
– сильные |
электролиты). Уравнение диссоциации для SrSO4:
→ Sr2+ + SO4 2–
Определение сильных и слабых электролитов – теоретический вопрос, ответ дать самостоятельно.
2.4. Для раствора электролита вашего варианта из столбца 1 (соответствующее значение концентрации приведено в ст. 1а) определите ионную силу раствора и активность катионов и анионов. Рассчитайте рН заданного раствора.
По условию молярная концентрация раствора c Ba(ОН)2 = 0,002 моль/л.
При расчете водородного показателя, необходимо помнить, что он определяется характером реакции раствора и соотносить значение полученного pH с природой заданного вещества. При 298 К для кислых растворов рН < 7, для нейтральных рН 7, для щелочных рН > 7.
Для сильных электролитов водородный показатель рассчитывается по формулам:
для кислот pH = – lgaH+ |
(16) |
для оснований (298 К) pH = 14 – pOH =14 + lgaOH– |
(17) |
где aH+ и aOH– – активности ионов H+ и OH–, соответственно. Выражения для нахождения активности:
ионов H+ |
aH+ = γH+ · cH+ |
(18) |
ионов OH– |
aOH– = γOH–· cOH– |
(18’) |
где γH+ и γOH– – коэффициенты активности ионов H+ и OH– в растворе, а cH+ и cOH– – относительные концентрации ионов H+ и OH– в растворе, численно равные молярной концентрации при условии полной диссоциации электролита. Коэффициент активности ионов γ определяется либо по приближенным формулам, либо по правилу ионной силы, согласно которому коэффициенты активности ионов одинакового заряда в растворах с одинаковой ионной силой равны по величине. Таблица приближенных коэффициентов активности отдельных ионов в зависимости от ионной силы приведена в приложениях к лабнику (Лабораторный практикум, стр.247). Ионная сила раствора I, рассчитывается как полусумма произведений
концентраций всех видов ионов в растворе (ci) на квадрат их заряда (zi): |
|
I = 1/2 ci zi2 |
(19) |
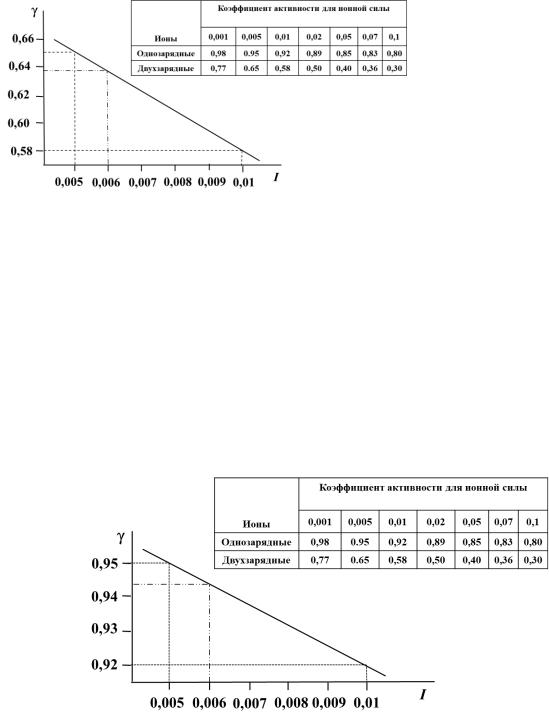
Зная величину I, определяем коэффициенты активности ионов γH+ или γOH–, затем их активность и вычисляем водородный показатель.
Для заданного электролита 0,002 М Ba(ОН)2, ионную силу раствора I определяем по формуле (19). Как видно из уравнения (14), концентрация ионов OH– (с учетом полного распада молекул на ионы) cOH– = 2·0,002 = 0,004 моль/л, т.к. из каждой молекулы Ba(ОН)2 при диссоциации образуются два иона OH–, а концентрация ионов бария cBa2+ = 0,002 моль/л. Ионная сила такого раствора, рассчитанная по (19): I = 1/2 (0,002·(+2)2 + 0,004·(–1)2) = 0,006.
Коэффициент активности γВа2+ найдем по правилу ионной силы из таблицы. В таблице приведены данные для коэффициентов активности однозарядных ионов при I = 0,01 и I = 0,005.
Коэффициент активности γВа2+ при I = 0,006 определяется методом интерполяции, предполагая линейную зависимость от I в данном интервале. Как видно из
графика, ионной силе 0,006 соответствует коэффициент активности γВа2+ ≈ 0,638. Тогда активность ионов Ва2+ в растворе, рассчитанная согласно формуле (18’):
aВа2+ = γВа2+ · c Ва2+ = 0,638·0,002 = 0,00128.
Коэффициент активности γOH– найдем по правилу ионной силы из таблицы. В таблице приведены данные для коэффициентов активности однозарядных ионов при I = 0,01 и I = 0,005. Коэффициент активности γOH– при I = 0,006 определяется методом интерполяции, предполагая линейную зависимость от I в данном интервале. Как видно из графика, ионной силе 0,006 соответствует коэффициент активности γOH– ≈ 0,944. Тогда активность
ионов OH– в растворе, рассчитанная согласно формуле (18’):
aOH– = γOH–· cOH–= 0,944·0,004 = 0,0038.
Для заданного электролита 0,002 М Ba(ОН)2, расчет pH нужно проводить по формуле (17):
pH = 14 + lg0,0038 = 11,58 (щелочная среда, рН > 7).
2.5. Дайте определение константы диссоциации. Напишите выражение для констант диссоциации раствора электролита вашего варианта из столбца 2 (соответствующее значение концентрации приведено в ст. 2а) по всем возможным ступеням. Рассчитайте степень диссоциации этого электролита по строгой и приближенной формуле Оствальда и сделайте вывод по полученным значениям. Рассчитайте рН заданного раствора.
Определение константы диссоциации – теоретический вопрос, ответ дать самостоятельно.
Молекулы многоосновных кислот и оснований диссоциируют ступенчато, и каждая стадия характеризуется своим значением КД. Значения констант диссоциации некоторых слабых электролитов при 298 К приведены в
таблице приложений в лабнике или учебнике. Слабая |
|
угольная кислота |
|||||
H2СO3 |
диссоциирует ступенчато, см. уравнения (15) и (15’). Выражение |
||||||
константы диссоциации для первой ступени: |
|
|
|||||
КД1 H2СO3 |
= [H+] [HСO3–]/ [H2СO3]; табличное значение КД1 = 4,5·10–7. |
||||||
Для второй ступени |
|
|
|
||||
КД |
2 |
H СO |
= [H+] [СO |
2–]/ [HСO –]; табличное значение КД |
2 |
= 4,8·10–11. |
|
|
2 |
3 |
3 |
3 |
|
||
|
|
Поскольку КД1 >> КД2, при расчете pH, как правило, учитывают только |
|||||
1-ю ступень диссоциации слабого электролита. |
|
|
|||||
|
|
Расчет водородного показателя слабых электролитов проводят по |
|||||
приближенным формулам, считая ≈ 1: |
|
|
|||||
|
|
|
|
|
для кислот pH = – lgcH+ |
|
(20) |
для оснований (298 К) pH = 14 – pOH =14 + lgcOH– (20’)
При этом равновесные концентрации ионов H+ и OH– рассчитывают исходя из соответствующих констант диссоциации (КД) слабых электролитов или степени диссоциации (α). Степень диссоциации – отношение числа молекул,
продиссоциировавших на ионы, к общему числу молекул электролита c0:
α = сдис / c0 |
(21) |
|
Связь между константой диссоциации и степенью диссоциации по |
||
соответствующей ступени выражается законом Оствальда: |
|
|
КД = α2·c0/(1 – α) |
(22) |
|
или для α << 1, |
КД = α2·c0 |
(22’) |
Рассчитаем степень диссоциации по строгой формуле закона |
||
Оствальда. По условию раствор H2СO3 |
имеет концентрацию c0 = 0,005 моль/л |
|
(см. таблицу 1, столбец 2а). |
|
|

|
KД |
KД2 |
4с0 KД |
|
4,5 107 |
(4,5 107 )2 4 0, 005 4,5 107 |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
0, 009449 |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
2c0 |
|
|
|
|
|
|
|
|
2 0, 005 |
||
|
Рассчитаем степень диссоциации по приближенной форме закона |
||||||||||||
Оствальда. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
K |
Д |
|
|
|
4,5 10 7 |
|
|
||||
|
|
|
|
|
|
|
|
|
0,0095 . |
||||
|
c0 |
0,005 |
|||||||||||
|
|
|
|
|
|
|
|
|
|||||
Расчет степени диссоциации по приближенной форме правомерен, т.к. значения получились одинаковые.
Концентрация ионов H+ рассчитывается в соответствии с (21) и
составит: cH+ = α·c0 = 0,0095·0,005= 4,75·10–5 моль/л.
Значение водородного показателя заданной кислоты определяется по формуле (20):
pH = – lgcH+= – lg(4,75·10–5) = 4,32 (кислая среда, рН < 7).
Приложение
Химическим эквивалентом (Э(В)) (по рекомендации ИЮПАК)
называется условная или реальная частица, равная или в целое число раз меньшая соответствующей ей формульной единице:
Э(В) |
1 |
В , |
(1) |
|
|
||||
Z (В) |
||||
|
|
|
где «В» – формульная единица вещества – реально существующая частица,
такая как атом (Cu, Na, C), молекула (N2, KOH, Al2(SO4)3, CO2), ион (OH–, SO42–, Cu2+), радикал (–NО2, С2Н5–), условные молекулы кристаллических веществ и полимеров и другие частицы вещества.
Эквивалентное число Z(B) показывает, какое число эквивалентов вещества «В» условно содержится в данной формульной единице этого
вещества. Величина обратная эквивалентному числу |
1 |
= fэкв. называется |
|
||
Z (В) |
фактором эквивалентности.
Эквивалентное число Z всегда больше или равно 1 и является безразмерной величиной; при Z=1 эквивалент соответствует формульной единице вещества.
Расчет эквивалентного числа различных формульных единиц представлен в таблице 1.
Таблица 1.
Расчет эквивалентного числа Z вещества
Частица |
Эквивалентное число Z |
|
Пример |
|
Элемент |
Z(Э) = В(Э), где |
Z(S)H2SO4 = 6 |
||
|
В(Э) – валентность элемента |
Z(C)CO = 4 |
||
|
|
|
2 |
|
Простое |
Z(в-ва) = n(Э)∙В(Э), где |
Z(O2) = 2∙2=4 |
||
вещество |
n(Э) – число атомов элемента |
|||
Z(Cl2) = 2∙1=2 |
||||
|
В(Э) – валентность элемента |
|||
|
|
|
||
Оксид |
Z(Э2Ох) = n(Э)∙В(Э), где |
Z(Н2О) = 2∙1=2 |
||
|
n(Э) – число атомов элемента |
Z(SО2) = 1∙4=4 |
||
|
В(Э) – валентность элемента |
Z(Al2О3) = 2∙3=6 |
||
Кислота |
Z(кислоты) = n(Н+), где |
Z(Н2SО4) = 1 – |
||
|
n(Н+) – число отданных в ходе |
основность равна 1 |
||
|
реакции ионов Н+ (основность |
Z(Н2SО4) = 2 – |
||
|
кислоты) |
основность равна 2 |
||
|
|
|
||
Основание |
Z(осн-я) = n(ОН–), где |
Z(Са(ОН)2 = 1 – |
||
|
n(ОН–) – число отданных в ходе |
|||
|
кислотность равна 1 |
|||
|
реакции гидроксид ионов ОН– |
Z(Са(ОН)2) = 2 – |
||
|
(кислотность основания) |
кислотность равна 2 |
||
|
|
|
||
Соль |
Z(соли) = n(Ме)∙В(Ме) = |
|
|
|
|
n(А)∙В(А), где n(Ме), В(Ме) – |
Z(Na2SО4) = 2∙1=1∙2=2 |
||
|
число атомов металла и его |
|||
|
Z(Al2(CO3)3) = 2∙3 = |
|||
|
валентность |
|||
|
= 3∙2 =6 |
|
||
|
n(А), В(А) – число кислотных |
|
||
|
|
|
||
|
остатков и их валентность |
|
|
|
Частица в |
Z(частицы) = nе, где |
SO42– +2H+ +2e → |
||
ОВР |
nе – число электронов, |
→ SO32– + H2O |
||
|
участвующих в процессе, на |
Z(SО42–) = 2, Z(H+) = 1 |
||
|
2Cl– – 2e → Cl2 |
|||
|
одну формульную единицу |
– |
) = 1, Z(Cl2) = 2 |
|
|
|
Z(Cl |
||
ион |
Z(иона) = n, где |
Z(SО42–) = 2 |
||
|
n – заряд иона |
|
|
|
Величины эквивалентного числа, а, следовательно, и эквивалента зависят от химической реакции, в которой участвует данное вещество.
Например, для реакции H3PO4 + 3KOH → K3PO4 + 3H2O эквивалентное число Z(H3PO4) = n(Н+) = 3, т.к. в реакции участвуют три иона Н+ фосфорной кислоты и, следовательно, эквивалентом H3PO4 будет являться условная частица 1/3H3PO4 (Э(H3PO4) = 1/3H3PO4).
В реакции H3PO4 + KOH → KН2PO4 + H2O замещается только один ион водорода Н+ и поэтому Z(H3PO4) = n(Н+) = 1, а эквивалентом кислоты является частица H3PO4 (Э(H3PO4)= 1H3PO4).
