
Вещество |
f Н0298, |
S0298, |
f G0298, |
Область Т,К |
||
кДж/моль |
Дж/(моль∙K) |
кДж/моль |
||||
|
|
|
||||
I2(к) |
|
0 |
116,73 |
0 |
298–385 |
|
H2S(г) |
|
– 20,17 |
205,60 |
– 33,01 |
298–1800 |
|
HI(г) |
|
25,94 |
206,30 |
1,30 |
298–2000 |
|
S(к) |
|
0 |
31,92 |
0 |
273–368 |
|
|
1.1.2. Тепловой эффект химической реакции rH рассчитывается |
|||||
как разность суммарной энтальпии продуктов реакции и суммарной энтальпии исходных веществ с учетом стехиометрических коэффициентов (νi,j) по табличным данным (см. таблицу 1). Для изобарно-изотермического процесса, протекающего в стандартных условиях тепловой эффект:
rH0298 = ∑νi |
f H0298 продуктов – ∑νj f H0298 исх. в-в |
(2) |
Для реакции (1): |
|
|
rH0298 = f H0298(H2S(г)) + |
f H0298(I2(к)) – ( f H0298(S(к)) +2·Δf H0298(HI(г)) = |
|
=(–20,17 + 0) – (0 + 2·25,94) = – 72,05 кДж/моль
Вывод: реакция экзотермическая ( rH0298 < 0), протекает с выделением тепла.
Изменение стандартной энтропии реакции rS0298, рассчитывается как разность суммарной энтропии продуктов реакции и суммарной энтропии исходных веществ с учетом стехиометрических коэффициентов (νi,j) по табличным данным (см. таблицу 1):
rS0298 = ∑νi S0298 продуктов – ∑νj S0298 исх. в-в |
(3) |
Для реакции (1):
r S0298 = S0298(H2S(г)) + S 0298(I2(к)) – (S 0298(S(к)) + 2· S 298(HI(г)) = (205, 60 +
+ 116,73) – (31,88 + 2·206,30) = – 122,15 Дж/моль·К
Вывод: энтропия системы в результате протекания реакции уменьшилась ( rS0298 < 0), система из менее упорядоченного состояния перешла в более упорядоченное, в данном случае – за счет уменьшения числа моль газообразных веществ.
1
1.1.3. Направление любого процесса определяется соотношением энтальпийного Н и энтропийного Т S факторов реакции. Для изобарно-изотермических процессов изменение энергии Гиббса при протекании реакции ∆G учитывает совместное влияние этих факторов:
∆G = ∆H – Т∆S |
(4) |
||
Однозначным |
критерием |
возможности |
самопроизвольного |
протекания процесса является условие ∆G < 0. В соответствии с (4) при |
|||
низких температурах |
знак ∆G |
определяется |
значением ∆H. Для |
рассматриваемого процесса при 298 К и стандартных состояниях всех веществ, участвующих в реакции (1), энтальпийный фактор будет способствовать протеканию реакции самопроизвольно в прямом направлении ( rH0298 < 0). В этих условиях энтропийный фактор не будет действовать в пользу прямого процесса, т.к. T rS0298< 0.
1.1.4. Один из способов расчета стандартной энергии Гиббса реакции при 298 К основан на следствии из закона Гесса, и вычисляется как разность между суммарной fG0298 продуктов и суммарной fG0298 исходных веществ с учетом стехиометрических коэффициентов (νi,j) по табличным данным (см. таблицу 1):
rG0298 = ∑νi |
fG0298, продуктов – ∑νj fG0298, исх веществ |
(5) |
rG0298 = fG0298(H2S(г)) + |
fG0298(I2(к)) – ( fG0298(S(к)) + 2·ΔfG0298(HI(г)) = |
|
=(– 33,01 + 0) – (2·1,30 + 0) = – 35,61 кДж/моль Расчет энергии Гиббса другим способом проводится с учетом
найденных значений rH0298 и rS0298 по уравнению (4).
rG0298 = – 72,05 + 298·122,15·10–3 = – 35,65 кДж/моль.
Вывод: Энергия Гиббса системы уменьшается (ΔrG0298 < 0), следовательно, реакция может протекать самопроизвольно в прямом направлении при стандартных состояниях всех веществ, участвующих
вреакции, и температуре 298 К.
1.1.5.Для определения температуры, при которой равновероятна
возможность протекания прямой и обратной реакций ( rG0T = 0) можно воспользоваться уравнением (4):
rG0T = rH0298 – T rS0298 = 0, откуда
T = rH0298/ rS0298 = (– 72,05·103)/(– 122,15) = 589,85 К
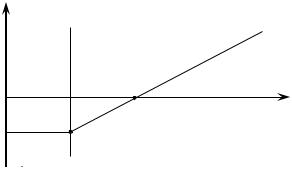
Температурный интервал определяется графически. Зная значение
|
|
rG, кДж/моль |
|
энергии |
Гиббса |
|
при |
||||||
|
|
|
температурах |
298 |
К |
||||||||
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
( rG0298 |
= |
– |
35,65 |
|
|
|
|
|
|
|
|
|
|
кДж/моль) и 589,85 К |
||||
|
|
|
298 |
|
589,85 |
|
|
||||||
|
|
|
|
( rG0589,85 |
= 0 кДж/моль) |
||||||||
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
T, K |
проведем |
на |
графике |
||
– 35,61 |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
зависимости |
rG |
от Т |
||||
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
прямую |
через |
эти |
две |
|
Рис. 1. Зависимость |
rG от Т. |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
точки (см. рис. 1). Условием самопроизвольного протекания реакции является уменьшение энергии Гиббса системы ( rG < 0). Как видно из графика на рисунке 1, реакция (1) может протекать самопроизвольно при стандартных условиях в интервале температур 298 ÷ 589,85 К. Однако максимальная температура при которой существуют все участники реакции (1) в стандартном состоянии составляет 368 К (S(к)) (см. таблицу 1). Следовательно, реальная область температур, в которой возможно самопроизвольное протекание процесса: 298 ÷ 368 К.
1. По условию стандартную энергию Гиббса предлагается вычислить при температуре T2 = 350 К. Значение стандартной энергии Гиббса при температуре 350 К рассчитывается по формуле (4):
rG0350 = – 72,05 + 350·122,15·10–3 = – 29,30 кДж/моль.
В случае, когда начальные парциальные давления газообразных веществ не равны единице (условия отличные от стандартных) rG350 нужно рассчитывать по уравнению изотермы Вант-Гоффа, которое для реакции (1) при заданной температуре имеет вид:
0 |
350 |
+ RTln[p̅ |
/ p̅ ], |
(6) |
rG350 = rG |
||||
|
|
|
2 |
|
|
|
(Н2S) |
(HI) |
|
где R – универсальная газовая постоянная (8,31 Дж/моль∙К);
под знаком ln – отношение произведения относительных парциальных давлений газообразных продуктов реакции к произведению относительных парциальных давлений газообразных исходных веществ в степени их стехиометрических коэффициентов.
Подставив полученное значение rG0350 в формулу (6), найдем rG350:
rG350 = –29,30·103 + 8,31·350·ln[10–3/(103)2] = – 89,57 кДж/моль.
Вывод: Как следует из расчетов, при 350 К и стандартном состоянии веществ реакция (1) может самопроизвольно протекать в прямом направлении ( rG0350 < 0). Если изменить начальные относительные парциальные давления газообразных компонентов как указано, то при заданной температуре направление процесса не изменится ( rG350 < 0) и реакция также сможет самопроизвольно протекать в прямом направлении.
1.2.Химическое равновесие
1.2.1.Для заданной обратимой химической реакции (1) выражение для констант равновесия имеет вид:
– для константы, выраженной через относительные равновесные
|
|
|
|
|
|
K p |
|
pH S |
|
парциальные давления газов: |
2 |
|
|||||||
|
|
|
|||||||
|
|
p 2 |
|||||||
|
|
|
|
|
|
|
|
HI |
|
– для константы, выраженной через относительные равновесные |
|||||||||
|
Kc |
cH |
2 |
S |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
концентрации: |
2 . |
|
|
|
|
||||
|
|
cHI |
|
|
|
|
|||
|
|
|
|
|
|
|
3 |
|
|

1.2.2.Стандартное изменение энергии Гиббса rG0Т при Т1 = 298К
итемпературе Т2 = 350 К рассчитывается по формуле (4).
rH0298 и rS0298 рассчитываются по формулам (2) и (3), соответственно. Для заданной реакции (1) rG0298 = – 35,65 кДж/моль, а
rG0350 = – 29,30 кДж/моль (см. расчет выше).
Константа равновесия Кр связана с изменением энергии Гиббса
химической реакции ∆rG0Т соотношением: ∆r G0Т = – RTlnKр , |
(7) |
откуда константа равновесия:
|
|
|
|
|
G |
0 |
|
|
|
|
|
||
|
|
|
|
r |
T |
|
K |
|
e |
RT |
|
||
|
|
|
||||
|
|
|
|
|
||
|
p |
|
|
|
|
|
,
(8)
где R – универсальная газовая постоянная (8,31 Дж/моль∙К). |
|
|||||
Тогда |
при |
298 |
К |
константа |
равновесия |
составит: |
35,65 103
K |
|
e |
|
|
8,31 298 |
|
p 298 |
|
1, 79 10 |
6 |
|
, а при 350 К:
29,30 103
K |
|
e |
|
|
8,31 350 |
|
p350 |
|
2, 4 10 |
4 |
|
.
Вывод: При увеличении температуры значение константы равновесия уменьшается, что объясняется отрицательным значением энтальпии реакции (ΔrН0Т < 0). Согласно принципу Ле Шателье для экзотермических реакций равновесие с повышением температуры смещается в сторону образования исходных веществ.
1.2.3.Увеличить выход продуктов химической реакции (1) можно следующими способами:
а) охладить систему, т.к. процесс экзотермический (∆rH0Т < 0);
б) увеличить парциальное давление (концентрацию) исходного
вещества HI(г), обеспечив дополнительный ввод газа;
в) понизить парциальное давление (концентрацию) продукта реакции H2S(г), выводя образующийся газ из зоны реакции;
г) повысить общее давление в системе, т.к. прямая реакция идет с уменьшением числа молей газообразных веществ.
1.2.4.Из области самопроизвольного протекания реакции выберем температуру 350К. Kp при этой температуре рассчитана в п.
1.2.2.Kp и Kс связаны через уравнение газового состояния:
Kс, = |
K p |
(9) |
|
RT |
|
||
|
|
|
|
где R – универсальная газовая постоянная (0,082 л∙атм/моль∙К);
∆ν – изменение числа молей газообразных веществ в ходе реакции, для реакции (1) ∆ν = 1 – 2= – 1.
Тогда Kc298 = 1,79∙106∙0,082∙298 = 4,3∙107, а Kc350 = 2,4∙104∙0,082∙350 = 6,9∙106.
Равновесные концентрации всех газообразных веществ при изохорном протекании реакции рассчитываем с учетом заданных значений исходных концентраций сисх.
Для заданной реакции (1) сA= 0,5 моль/л; сD = 0 моль/л.
4

Для расчета равновесных концентраций составим таблицу материального баланса:
Компонент |
HI(г) |
H2S(г) |
Исходные концентрации (сисх), моль/л |
0,5 |
0 |
|
|
|
Изменение концентрации ( с), моль/л, |
2х |
x |
Равновесные концентрации (сравн), моль/л, |
0,5 – 2x |
x |
|
|
|
Подставим равновесные концентрации в выражение для Кс (п.1.2.1):
|
|
|
c |
|
|
x |
|
|
|
6 |
K |
|
|
H2S |
|
|
|
|
6, 9 10 |
||
c |
c |
2 |
(0, 5 |
2x) |
2 |
|
||||
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|||
|
|
|
HI |
|
|
|
|
|
|
|
Решение квадратного уравнения относительно x имеет два действительных корня: x1 = 0,21 и x2 = 0,3.
По смыслу подходит значение корня x1, т.к. в случае x2 изменение концентрации НI (0,3·2 = 0,6) больше, чем ее исходное значение (0,5). Таким образом, равновесные концентрации:
сравнHI = 0,5 – 2·0,21 = 0,08 моль/л
сравнH2S = 0,21 моль/л
Задание 2
|
2.1. Химическая кинетика |
|
|||
|
Исходные данные к заданию 2 |
Таблица 2 |
|||
|
|
|
|
|
|
Номер варианта |
Реакция |
с0А, моль/л |
υ0, |
сτВ, моль/л |
|
моль/л·с |
|||||
|
|
|
|
||
№ |
2А→ В+2С |
2,0 |
3,56·10–3 |
0,55 |
|
1.Задана химическая реакция (см. таблицу 2):
2А → В + 2C |
(10) |
По условию эта реакция элементарная, следовательно, порядок |
|
реакции совпадает со стехиометрическим коэффициентом реагента и
равен 2. |
Основное кинетическое |
уравнение для |
реакции второго |
|
|
k c |
|
порядка: |
υ0 = |
2 |
(11) |
A |
Размерность константы скорости для реакции второго порядкал / (моль с)
2. По условию начальная скорость реакции υ0 = 3,56·10–3 моль/л·с и начальная концентрация вещества с0А = 2,0 моль/л (таблица 2). Константу скорости и период полупревращения необходимо определять по формулам в соответствии с порядком реакции. Для реакции (10), имеющей второй порядок, константу скорости реакции
можно найти из соотношения (11): |
|
|||||
k |
0 |
|
3,56 10 3 |
8,9 10 4 |
л / (моль с) |
|
c2 |
22 |
|||||
|
|
|
|
|||
|
0 A |
|
|
|
|
|
|
|
|
|
5 |
|
|

Период полупревращения для реакции второго порядка вычисляется по
уравнению:
Для заданной мин.
|
|
|
1 |
|
1/ 2 |
k c |
|||
|
|
|||
|
|
|
||
|
|
|
0 |
реакции (10) τ1/2
(12)
= 1/(3,56·10–3·2,0) = 140,45 с или 2,34
3. Находить концентрацию реагента A в момент времени когда концентрация продукта реакции В достигнет значения сτВ удобнее через таблицу материального баланса.
|
|
|
Таблица 3. |
Таблица материального баланса для реакции (10) |
|||
Концентрация |
A |
B |
C |
начальная, с0, моль/л |
2,0 |
0 |
0 |
изменение, Δ, моль/л |
2x |
x |
2x |
в момент времени τ, сτA, моль/л |
2,0 – 2x |
0 + x |
0 + 2x |
По условию концентрация продукта В реакции (10) через некоторое время τ достигнет значения сτВ = 0,55 моль/л, следовательно x = 0,55. Тогда концентрация реагента А с учетом стехиометрии к заданному моменту времени: сτА = 2,0 – 2·0,55 = 0,9 моль/л.
Выражение для константы скорости реакции второго порядка:
Тогда время
|
1 |
|
1 |
|
|
|
|
|
k |
|
c |
|
|
||
|
|
|
|
|
k |
1 |
|
1 |
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
c |
|
c |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
0 |
|
||
|
1 |
|
|
|
|
1 |
|
|
1 |
|
|
|
|
|
|
4 |
|
|
|||
|
c |
|
|
8,9 |
10 |
|
0,9 |
|
||
|
|
|
|
|
||||||
|
0 |
|
|
|
|
|
|
|
||
1 |
|
2,0 |
|
|
686,64
(13)
с или 11,44
мин.
Скорость реакции в этот момент времени рассчитывается по уравнению
(11): υτ = 8,9·10–4·0,92 = 7,21·10–4 моль/л·с.
Вывод: При уменьшении концентрации реагентов скорость реакции снижается. По мере протекания реакции (10) исходная концентрация реагента с0А = 2,0 моль/л уменьшается и через 11,44 минут составит сτА = 0,9 моль/л. При этом скорость реакции снижается от ее начального значения υ0 = 3,56·10–3 до значения υτ = 7,21·10–4 моль/л·с.
Литература 1. Краткий справочник физико-химических величин. Под
редакцией Равделя А.А., Пономаревой А.М. – М: Издательство.
Вербум, 2010. – 232 с
2. .Коровин Н.В., Общая химия: учебник для вузов / Н.В. Коровин. – М: Академия, 2012. – 557 с.
6
