
11 Защита 1
.docФедеральное государственное бюджетное образовательное учреждение
высшего образования
«Кировская государственная медицинская академия»
Министерства здравоохранения Российской Федерации
Кафедра химии
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ ДЛЯ ВНЕАУДИТОРНОЙ ПОДГОТОВКИ СТУДЕНТОВ
I КУРСА ЛЕЧЕБНОГО И ПЕДИАТРИЧЕСКОГО ФАКУЛЬТЕТОВ
Занятие № 11
«Химия»
Тема : Защита разделов «Термодинамика, химическая кинетика, свойства растворов электролитов»
Цель занятия: проверить уровень формирования образовательных и культурных компетенций студентов, усвоения теоретических знаний и овладения практическими навыками по изученным разделам
Работа включает темы:
Химическая термодинамика»
Химическая кинетика».
Химическое равновесие».
Коллигативные свойства растворов».
Свойства растворов электролитов.
Буферные растворы.
Окислительно-восстановительные реакции.
Комплексные соединения.
Произведение растворимости.
I. В билет входят задачи и теоретические вопросы из числа тех, которые приводятся к каждому занятию или рассматриваются на лекции.
II. Для подготовки к контрольной работе можно прорешать задачи со стенда «Общая химия» (аналогичные задания приведены в пособии «Общая химия. Контрольные вопросы и задания, рекомендуемые для подготовки к экзамену»):
№№ 3.1, 3.3, 3.5, 3.6, 4.1, 4.2, 4.3, 5.1, 6.3, 6.4, 7.1, 7.3, 8.1, 9.1, 9.2, 10.1, 11.1, 11.2
ЛИТЕРАТУРА:
Конспекты лекций
Беляев А.П. Физическая и коллоидная химия. М. : ГЭОТАР-Медиа, 2014. 752с.
Ленский А.С. Биофизическая и бионеорганическая химия: учебное пособие для студентов медицинских ВУЗов. МИА, 2008. – 408с.
Общая химия. Биофизическая химия. Химия биогенных элементов: учебник для медицинских вузов./ Ю.А.Ершов, В.А.Попков, А.С.Берлянд и др.. - Под ред. - Ю.А.Ершова. - М.: Высшая школа. – 2007. – 559с.
ПРИМЕРНЫЙ БИЛЕТ ЗАЩИТЫ РАЗДЕЛА
1. Рассчитайте калорийность порции картофельного пюре (150г), имеющей состав:
белки – 2%, жиры – 0,1%, углеводы – 39,4%.
2. . Определите возможность самопроизвольного протекания реакции при 80°С
 O2(г)
+ 2NO(г)
2NO2(г)
O2(г)
+ 2NO(г)
2NO2(г)
Какой фактор – энтальпийный или энтропийный - оказал решающее влияние?
3. Реакция А + 2В С + D имеет первый порядок по веществу А и В. Какая это реакция: простая или сложная? Запишите кинетическое уравнение и рассчитайте ее начальную скорость, если исходные концентрации вещества А 0,02 моль/л, В - 0,04 моль/л, константа скорости 0,4 л/ моль·с.
4. Для двух обратимых реакций даны константы равновесия при некоторой температуре:


 1) HF
H+
+ F
Кр = 6·10-4
1) HF
H+
+ F
Кр = 6·10-4
2) H2 + Cl2 2HCl Кр = 2·103
В какой реакции равновесие смещено в сторону продуктов, напишите для этой реакции выражение Кравн.
5. В какой раствор помещен эритроцит на рисунке?
Н2О
Сколько граммов
глицерина (М = 92 г/моль) следует растворить,
чтобы получить 310 мл этого раствора
при 370С?



6. Из приведенных кислот: H2CO3 (pКа = 6.4), HF (pКа = 3.4) - для самой слабой напишите уравнение диссоциации
7. Приведите состав и механизм действия аммиачного буферного раствора.
8. Рассчитайте значение кислотной буферной ёмкости буферного раствора, если при добавлении 4 мл 0,1М раствора соляной кислоты к 40 мл его рН изменяется от 8,0 до 7,2?
9. Для окислительно-восстановительной реакции:
N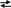 aJ
+ NaNO2
+ H2SO4
J2
+ NO
+ Na2SO4
+ H2O
aJ
+ NaNO2
+ H2SO4
J2
+ NO
+ Na2SO4
+ H2O
а) выпишите из таблицы значение ОВ-потенциалов,
б) укажите окислитель и восстановитель,
в) рассчитайте величину ЭДС,
г) расставьте коэффициенты,
д) укажите направление протекания реакции
10. Для комплексного соединения хлорид гексаакваникеля (II) приведите:
а) формулу с указанием внешней и внутренней сферы, состав внутренней сферы;
б) тип комплекса по заряду внутренней сферы
в) первичную диссоциацию;
г) вторичную диссоциацию и выражение константы нестойкости.
Заведующий кафедрой химии
д.м.н., профессор Цапок П.И.
