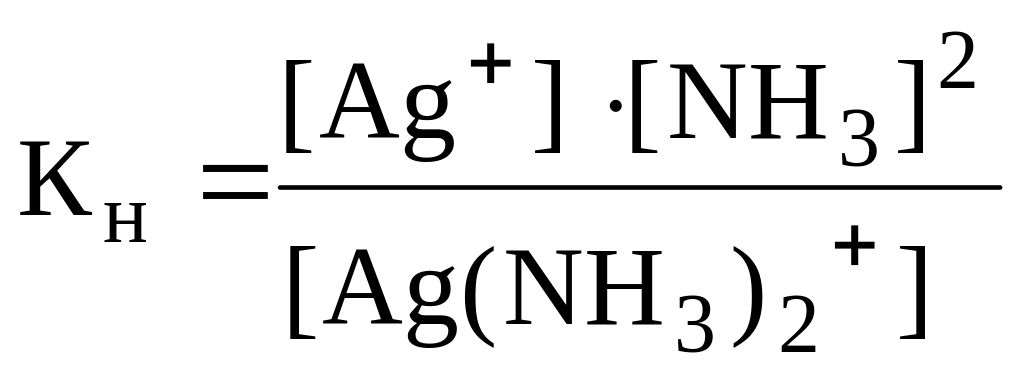9 Комплексные соединения
.docФедеральное государственное бюджетное образовательное учреждение
высшего образования
«Кировская государственная медицинская академия»
Министерства здравоохранения Российской Федерации
Кафедра химии
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ ДЛЯ ВНЕАУДИТОРНОЙ ПОДГОТОВКИ СТУДЕНТОВ
I КУРСА ЛЕЧЕБНОГО И ПЕДИАТРИЧЕСКОГО ФАКУЛЬТЕТОВ
Занятие № 9
«Химия»
Тема «Комплексные соединения»
Значение темы
Комплексные соединения играют большую роль в процессах жизнедеятельности. В живых организмах присутствуют комплексные соединения многих биогенных металлов с белками, витаминами и другими веществами, играющими роль ферментов и выполняющими специфические функции в обмене веществ. На комплексообразовании основано выведение токсических веществ. Комплексообразование используют для консервации донорской крови и т.д.
Цель занятия
Закрепить знания по структуре КС, природе химической связи в них и диссоциации КС. Изучить значение в химии и медицине.
Получить некоторые КС и показать их отличие от простых и двойных солей.
Теоретические вопросы:
Основные положения координационной теории Вернера.
Какие соединения называют комплексными?
Дать определение понятию «центральный атом – комплекообразователь».
Что такое лиганд? Приведите примеры ионов и молекул, выполняющих роль лигандов в КС.
Дать определение понятию «координационное число центрального атома». Какое значение оно обычно принимает.
Как классифицируют КС в зависимости от заряда их внутренней сферы? Как определяется заряд внутренней сферы?
Как классифицируют КС в зависимости от природы лиганда? Что такое хелаты?
Дайте определения понятиям «первичная и вторичная диссоциация КС».
В каких случаях возможно образование и разрушение КС? Какими реактивами можно разрушить: а) гидроксокомплексы; б) амиачные комплексы?
Приведите примеры комплексов, играющих важную роль биологическую роль или применяемых в медицине.
Выполните письменно задания:
1. Для приведенных комплексных соединений: Na2[PdJ4]; [Cu(Н2О)4](NO3)2; [Pt(NH3)4Cl2]
укажите внутреннюю и внешнюю сферы
напишите уравнение первичной диссоциации
охарактеризуйте состав внутренней сферы по плану:
а) заряд внутренней сферы и тип комплексной частицы по этому заряду
б) комплексообразователь и его степень окисления
в) лиганды и их заряд
г) координационное число
назовите комплексное соединение
2. Напишите формулы комплексных соединений
а) гексанитрокобальтат (III) калия б) бромид гексааминжелеза (III) в) трифторотриаквахром
Задания 1 и 2 выполните в виде таблицы по образцу
Формула к.с. и название |
Внутренняя сфера |
Внешняя сфера |
Уравнение по 1 и 2 ступени диссоциации и Кн |
|||
заряд |
централь-ный атом |
к.ч. |
лиганды и их заряд |
|||
[Ag(NH3)2]Cl хлорид диамминсеребра
|
[Ag(NH3)2]+ |
Ag+ |
2 |
2NH3 |
Cl |
1.[Ag(NH3)2]Cl [Ag(NH3)2]++ Cl 2.[Ag(NH3)2]+Ag++ +2NH3
|
ЛАБОРАТОРНАЯ РАБОТА
«Получение комплексных соединений и изучение их устойчивости».
ЦЕЛЬ РАБОТЫ
Получить комплексные соединения никеля и цинка.
Изучить условия разрушения КС.
Опыт 1.
а) В пробирку налейте 1 мл раствора сульфата никеля (II) Добавьте по каплям концентрированный раствор аммиака. Наблюдайте выпадение осадка основной соли (NiOH)2SO4. Добавьте к нему избыток аммиака. Что наблюдается?
х у
Изобразите схему происходящих превращений А В С, учитывая, что в аммиачном комплексе к.ч.(Ni2+) = 6. Укажите изменение окраски.
б) К полученному раствору по каплям добавьте раствор серной кислоты.
Напишите уравнение реакции в ионном виде и объясните причину разрушения аммиачного комплекса Ni(II) под действием кислоты.
Опыт 2.
а) В пробирку налейте 1 мл сульфата цинка и добавьте к нему по каплям раствор гидроксида натрия до появления осадка. Затем добавляйте щелочь до полного его растворения. Напишите уравнение реакции образования КС, учитывая, что к.ч.(Zn2+) = 4.
б) К полученному раствору 3-4 капли раствора серной кислоты. (Пробирку не вынимать из штатива!) Напишите уравнение реакции в ионном виде.
Какие условия получения и разрушения аммино- и гидроксокомплексов
ЛИТЕРАТУРА:
Конспект лекций
Беляев А.П. Физическая и коллоидная химия. М. : ГЭОТАР-Медиа, 2014. 752с.
Ленский А.С. Биофизическая и бионеорганическая химия: учебное пособие для студентов медицинских ВУЗов. МИА, 2008. – 408с.
Общая химия. Биофизическая химия. Химия биогенных элементов: учебник для медицинских вузов./ Ю.А.Ершов, В.А.Попков, А.С.Берлянд и др.. - Под ред. - Ю.А.Ершова. - М.: Высшая школа. – 2007. – 559с.
Заведующий кафедрой химии
д.м.н., профессор Цапок П.И.