
Учебное пособие 800266
.pdfε0 = Е 0к – Е0А = E |
E |
= 0,34- (-0,40) = 0,74 В. |
Cu 2 / Cu |
Cd 2 |
/ Cd |
Движущей силой каждой химической реакции является убыль изобарно-изотермического потенциала G (энергия Гиббса). С другой стороны, убыль энергии Гиббса определяет максимальную работу химической реакции. Работа, производимая системой, равна работе электрического тока:
Aэл= I∙U∙τ =Q∙U, (2)
где τ - время (с), I - ток (А), U- падение напряжения (В), Q - количество электричества (Кл).
Максимальную работу ГЭ совершает, если реакция протекает обратимо в равновесных условиях (элемент замкнут на бесконечно большое сопротивление и ток равен нулю). При этом напряжение элемента равно его разности потенциалов ε
(U = ε и максимальная работа Amax = Q∙ε ). В стандартных условиях:
Q = n∙F и G = -n∙F∙U, |
(3) |
где F- число Фарадея (96485 Кл).
Во время работы ГЭ происходит изменение потенциала анода и катода. По различным причинам тормозятся анодный и катодный процессы, в результате потенциал анода становится положительным (анодная поляризация), а на катоде накапливается избыток электронов, и потенциал катода становится отрицательным - катодная поляризация. В результате напряжение работающего элемента всегда меньше, чем теоретическое значение. Для устранения поляризации применяют вещества, называемые деполяризаторами. Это окислители, которые принимают электроны у катода, препятствуя поляризации
(Сu² , Cr2O7² , МnО-4 и другие вещества, содержащие элемент в высшей степени окисления).
19
3.1. Лабораторная работа № 7 «Гальванические элементы»
Цель работы:
1.Ознакомиться с работой гальванического элемента, используя значения стандартных электродных потенциалов (анодного и катодного).
2.Проследить за влиянием поляризации на работу гальванического элемента. Определить величину напряжения цепи ГЭ.
Опыт 1. Гальванический элемент с деполяризатором катионом металла. Гальванический элемент Даниэля – Якоби
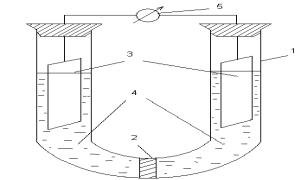
Опыты проводят в приборе, представленном на рис. 2.
Рис. 2. Схема гальванического элемента: электролитическая ячейка - U- образная трубка (1) с пористой перегородкой (2), электроды (3) представляют собой исследуемые металлы, опущенные в растворы электролитов (4), вольтметр
(5) для измерения напряжения Выполнение опыта
Одно отделение U-образной трубки заполните 1 М раствором сульфата цинка, другое - 1 М раствором сульфата меди. В первый раствор опустите цинковую пластинку, во вторую
20
медную. Замкните цепь и измерьте напряжение с помощью вольтметра. Через пять минут после замыкания вновь измерьте вольтметром напряжение работающего гальванического элемента. Таким образом, через примерно равные промежутки времени, измеряя напряжение, получите три опытных значения напряжения ε. Составьте схему гальванического элемента, напишите уравнения химических реакций, протекающих на электродах, и суммарное уравнение реакции, в результате которой возникает напряжение в цепи и электрический ток в данном элементе. Вычислите теоретическое значение ε элемента и сравните её с опытными величинами. Является ли изучаемый гальванический элемент поляризующимся?
Опыт 2. Гальванический элемент с водородной поляризацией. Гальванический элемент Вольта.
Деполяризация гальванического элемента Выполнение опыта
Составьте гальванический элемент (рис. 2), заменив раствор сульфата меди на 1 M раствор серной кислоты. Проводники от цинковой и медной пластинок присоедините к вольтметру и наблюдайте за его показаниями. Почему падает напряжение? Составьте схему гальванического элемента и напишите уравнения химических реакций, протекающих на электродах, и суммарное уравнение химической реакции, в результате которой возникает электрический ток. Вычислите теоретическое значе-
ние ε и сравните его с опытными значениями (Е˚2Н /Н ,Сu = + 0,2 В). Является ли исследуемый гальванический элемент поляризующимся?
Добавьте в кислоту несколько кристаллов бихромата калия (K2Cr2O7) и размешайте стеклянной палочкой. Как изменяется напряжение? Какова роль бихромата калия? Какие вещества могут служить катодными деполяризаторами?
Вопросы для подготовки
1. Рассчитайте электродный потенциал железа в 0,001 М растворе соли FеSO4 (стандартный электродный потенциал
21
Е° Fе² / Fe = - 0,44 В).
2.Составьте схему магниево-цинкового ГЭ. Какой металл
вГЭ является анодом? Укажите процессы, протекающие на электродах, при работе элемента. Определите напряжение цепи этого элемента при стандартных условиях.
3.Приведите пример гальванического элемента, в котором имеет место водородная поляризация. Каким способом можно ее уменьшить?
4. ЭЛЕКТРОЛИЗ ВОДНЫХ РАСТВОРОВ ЭЛЕКТРОЛИТОВ
Теоретические основы электролиза
Электролизом называют совокупность окислительновосстановительных процессов, которые происходят под действием электрического тока, как правило, постоянного, на электродах, погруженных в расплав или раствор электролита. На катоде, подключенном к отрицательному полюсу внешнего источника тока, идет реакция восстановления, а на аноде, который подключен к положительному полюсу источника тока -
окисление.
Для того, чтобы происходил электролиз и через электролитическую ячейку проходил ток, надо приложить определенное напряжение U, которое слагается из разности равновесных потенциалов анода и катода ε, перенапряжения анода (ηА) и катода (ηк), а также омического падения напряжения (IR):
U = ε + ηА + ηК + I (r1 + r2), |
(4) |
где I - общий ток, протекающий через электролитическую ячейку, r1 – сопротивление электролита, r2 – сопротивление проводников 2-го рода.
Для осуществления на катоде разряда какого-либо вещества, необходимо повышать напряжение до тех пор, пока потенциал катода не станет отрицательнее окислительно-
22
восстановительного потенциала разряжающегося вещества. В анодном процессе соотношение потенциала электрода и разряжающегося вещества обратное. Таким образом, необходимым условием для разряда катионов на катоде является:
ЕК < E (Ox/Red)к, |
(5) |
а анионов на аноде: |
|
ЕА> Е (Ox/Red)А, |
(6) |
где ЕК и ЕА - потенциал катода и анода; E(Ox/Red)к - потенциал восстанавливающегося вещества на катоде; Е (Ox/Red)А- потенци-
ал окисляющегося вещества на аноде; Ох - окислительная форма вещества; Red - восстановительная форма вещества.
Обеспечение условий (5) и (6) не всегда является достаточным для того, чтобы электродный процесс проходил с требуемой скоростью. Скорость электродной реакции зависит от природы разряжающихся частиц, концентрации и скорости их диффузии, материала электрода, состояния его поверхности. Особенности электрохимических процессов проявляются в зависимости от потенциала электрода. Скорость процесса опре-
деляется величиной плотности тока (катодной iк |
и анодной iА): |
||||||
iк = |
I |
; |
iА = |
I |
; |
(7) |
|
|
S |
|
|||||
|
Sk |
|
A |
|
|
||
|
|
|
|
|
|
|
|
где SK и SА - поверхности катода и анода.
Для того, чтобы реакция разряда происходила с заданной скоростью, потенциал катода должен быть смещен на величину ηк в отрицательную сторону, а потенциал анода - на величину ηА в положительную сторону от равновесных значений. Указанные смещения потенциалов требуют дополнительного увеличения напряжения на электродах. Большое влияние на протекание процессов на катоде и аноде оказывает перенапряжение водорода и кислорода.
Закономерности электродных процессов
Катодный процесс. При наличии нескольких видов катионов металлов в растворе электролита на катоде, прежде
23
всего, происходит восстановление частицы с положительным значением потенциала.
Условно все металлы можно разделить на 3 группы:
1. Катионы металлов, расположенных в ряду напряже-
ний после водорода, восстанавливаются на катоде по схеме:
Men+ + ne = Me0 .
2. Катионы активных металлов (от Li до Al включительно) не восстанавливаются на катоде. В кислой среде вместо них восстанавливается водород из катионов водорода, а в нейтральной и щелочной средах восстанавливаются молекулы воды с выделением водорода:
2 Н + 2 е = Н2↑ (кислая среда, рН<7), 2Н2О+2 = Н2↑+2ОН- (нейтральная и щелочная среда, рН≥7).
3. В случае металлов средней активности (после Al до H) на катоде одновременно восстанавливаются катионы металлов и молекулы воды (или ионы водорода) с выделением газооб-
разного водорода:
Men+ + ne = Me0
2 Н + 2 е = Н2↑ или 2 Н2О + 2е = Н2 +2ОН-.
Анодный процесс. При наличии в прианодном пространстве нескольких видов анионов и молекул, в первую очередь на аноде окисляется частица, имеющая отрицательное значение потенциала. Аноды могут быть инертными (уголь, графит, платина и другие вещества) и активными (растворимыми), изготовленными из металла. В зависимости от этого процессы на аноде могут различаться.
1. Инертные аноды:
а) анионы бескислородных кислот, таких как Сl‾, Br‾, J‾, Se²‾, S2- и другие анионы , кроме F‾, окисляются на аноде, образуя простые вещества, например: 2Cl- - 2e = Cl2.
|
|
б) |
|
анионы |
|
кислородосодержащих кислот таких как |
|||
|
6 |
2 |
|
5 |
3 |
, |
5 |
|
|
S O4 |
|
, P O4 |
|
NO3 |
|
и другие кислородосодержащие |
|||
|
|
|
|
|
|
|
|
|
|
анионы, имеющие элемент в высшей степени окисления, фто-
24

рид ионы при электролизе водных растворов не разряжаются. Вместо них на аноде в кислой и нейтральной средах окисляются молекулы воды, а в щелочной среде – гидроксид анионы:
2 H2O - 4е = О2 + 4Н (кислая и нейтральная среда), 4OH- - 4e = O2 + 2H2O (щелочная среда).
2. Активные аноды:
В этом случае окисляется металл анода по схеме:
Me – ne = Men+.
Законы Фарадея
1.Массы веществ, выделившихся на электродах при электролизе, прямо пропорциональны количеству электричества, прошедшего через электролит.
2.Для выделения на электроде одного эквивалента любого вещества необходимо затратить одно и то же количество электричества, а именно, 96495 Кл.
В математической форме оба эти закона могут быть выражены соотношением:
m |
mЭ |
I , |
(8) |
|
|||
|
F |
|
|
где m - масса вещества, г; mЭ - эквивалентная масса вещества, г/моль; I - сила тока, А; τ - время, с;
mЭ - электрохимическая эквивалентная масса, г/моль·Кл.
F
Об эффективности процессов на электродах судят по выходу вещества по току (ВТ):
ВТ |
mпракт. |
100% , |
(9) |
|
|||
|
mтеорет. |
|
|
где mпракт. - масса выделившегося при электролизе вещества, г;
mтеорет. - масса вещества, теоретически рассчитанная по закону Фарадея при данных I и τ.
Напряжение разложение электролита – минимально необходимое напряжение для начала процесса электролиза при
25
токе равном нулю равно разности потенциала анода и потенциала и катода:
Е0разл. = Е0А - Е0к. |
(10) |
4.1. Лабораторная работа № 8 «Электролиз водных растворов солей»
Цель работы:
1.Провести электролиз растворов электролитов и убедиться в превращении электрической энергии в химическую форму.
2.Установить особенности разряда ионов на катоде и на аноде в зависимости от состава электролита и материала анода.
3.Познакомиться с показателем эффективности процесса электролиза - выходом по току.
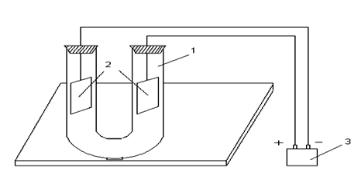
Опыты проводят в приборе, представленном на рис. 3.
Рис. 3. Прибор для электролиза:
1 – электролитическая ячейка; 2 - электроды; 3 - источник постоянного тока
26
Опыт 1. Электролиз раствора соли, образованной малоактивным металлом и бескислородной кислотой, на примере раствора хлорида меди с угольными электродами
Выполнение опыта
Электролитической ячейкой является U - образная трубка, которую на 1/2 объема заполните раствором хлорида меди. В раствор опустите угольные электроды, предварительно промытые дистиллированной водой. Электроды подсоедините к источнику постоянного тока при помощи медных проводников. Убедившись в правильности собранной установки, включите источник тока в сеть. Через несколько минут прекратите электролиз. Какие изменения происходят на катоде? Что происходит на аноде? Какой газ выделяется? Напишите уравнения электродных реакций.
Опыт 2. Электролиз раствора соли, образованной малоактивным металлом и кислородосодержащей кислотой, на примере раствора хлорида меди с медным анодом
Выполнение опыта
Заполните электролитическую ячейку раствором сульфата меди. В раствор опустите медные электроды, предварительно зачищенные и промытые дистиллированной водой. Электроды присоедините к источнику постоянного тока при помощи медных проводников. Включите его в сеть и проводите электролиз в течение 3 - 5 минут. Какие изменения происходят с катодом? Что наблюдается на аноде?
Поменяйте полярность на электродах. Что наблюдается на аноде? Изменяется ли катодный процесс? Напишите уравнения реакций, происходящих на электродах.
Опыт 3. Электролиз раствора соли, образованной активным металлом и кислородосодержащей кислотой, на примере раствора сульфата натрия с угольными электродами
27
Выполнение опыта
В электролитическую ячейку (рис. 3) налейте раствор сульфата натрия. Погрузите в раствор угольные электроды, присоедините их к клеммам постоянного источника тока, добавьте в катодное пространство 2 - 3 капли фенолфталеина, а в анодное - такое же количество метилоранжа. Включите ток и пропускайте его в течение 2 - 5 минут. Напишите уравнения катодного и анодного процессов, протекающих при электролизе раствора сульфата натрия. Какие вещества выделяются на катоде и аноде? Объясните изменение окраски индикатора в катодном и анодном пространствах.
Опыт 4. Электролиз раствора соли, образованной металлом средней активности и кислородосодержащей кислотой на примере сульфата никеля с угольными электродами
Выполнение опыта
Заполните электролитическую ячейку (рис. 3) раствором сульфата никеля. В раствор поместите угольные электроды и присоедините их к источнику постоянного тока, добавьте в анодное пространство 2 - 3 капли метилоранжа. Включите его в сеть и проводите электролиз в течение 3 - 5 минут. Какие изменения происходят с катодом? Что наблюдаете на аноде? Напишите уравнения реакций, происходящих на электродах. Объясните изменение окраски индикатора в анодном пространстве.
Опыт 5. Электролиз раствора соли, образованной малоактивным металлом и бескислородной кислотой, на примере раствора йодида калия с угольными электродами
Выполнение опыта
Заполните электролитическую ячейку раствором KJ. Опустите в раствор угольные электроды и подключите их к источнику тока, добавьте в катодное пространство 2 - 3 капли фенолфталеина, а в анодное - такое же количество крахмала. Какие изменения наблюдаются на аноде и катоде? Чем объясняет-
28
