
Семинар_05_МВА_Эксергия_тепла_1
.pdfСеминар по ТТД №05.
MVA
Эксергия термодинамических систем (постоянная и переменная температура
источника теплоты).
Второй закон термодинамики.
Рассмотрим несколько определений 2-го закона термодинамики. 1°. Любой реальный самопроизвольный процесс – необратимый.
2°. Оствальд В.Ф. (нобелевская премия по химии 1909 г.) предложил термин «вечный двигатель второго рода» – это тепловой двигатель, действующий циклически и имеющий один источник тепла. Планк М. (Планк Макс Карл Эрнст Людвиг, нобелевская премия по физике 1918 г.): вечный двигатель второго рода невозможен.
3°. Р. Клаузиус (Рудольф Юлиус Эмануэль Клаузиус): теплота не может сама собой (в самопроизвольном процессе) переходить от холодного тела к горячему.
Математическая запись второго закона термодинамики для всей термодинамической системы:
TdS ≥ dQ, кДж, (5-1)
где S – энтропия системы, кДж/кг.
В (5-1) неравенство относится к необратимым процессам, равенство – к обратимым. Для удельных величин (на 1 кг; s – удельная энтропия, кДж/(кг·К)):
Tds ≥ dq, кДж/кг. |
(5-2) |
Если объединить уравнение первого и второго законов термодинамики (1-22) и (5-2) для |
|
обратимого процесса, то будет получено термодинамическое тождество: |
|
dq = Tds = du + p·dv, Дж/кг. |
(5-3) |
Термодинамическое тождество с использованием формы(1-26): |
|
dq = Tds = dh – v·dp, Дж/кг. |
(5-4) |
Полный дифференциал энтальпии h = f(p, T): |
|
dh = (∂h/∂T)p·dT + (∂h/∂p)T·dp. |
(5-5) |
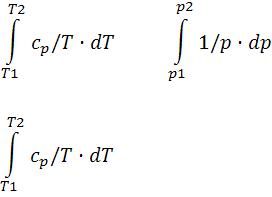
Изобарная теплоемкость в общем случае (см. (5-4)): |
|
cp = (∂q/ ∂T)p = T·(∂s/∂T)p = (∂h/∂T)p; кДж/(кг·К). |
(5-6) |
(5-5) с учетом (5-6) можно переписать: |
|
dh = cp·dT + (∂h/∂p)T·dp. |
(5-7) |
Для ИГ энтальпия есть функция только температуры h = f(T). Поэтому (∂h/∂p)T = 0. (5-7) для ИГ:
dh = cp·dT. |
(5-8) |
Следует заметить, что для ИГ cp тоже функция только температуры cp = φ(T). Тождество (5-4) для ИГ запишется:
Tds = cp·dT – v·dp. |
(5-9) |
Уравнение (5-9) позволяет рассчитать удельную энтропию. Подставим из уравнений Клапейрона
– Менделеева p·v = R·T в (5-9) и проинтегрируем получившееся дифференциальное уравнение:
(5-10)
Уравнение (5-10) – дифференциальное уравнение с разделяющимися переменными, интегрировать его можно по любому пути между точками 1 и 2. Поэтому интегрируем его по следующему пути: а) от T1 до T2 при p = const; потом б) от p1 до p2 при T = const:
s(p2, T2) – s(p1, T1) = |
– R· |
. |
(5-11) |
Правый интеграл – натуральный логарифм:
s(p2, T2) – s(p1, T1) = |
– R·ln(p2/p1) . |
(5-12) |
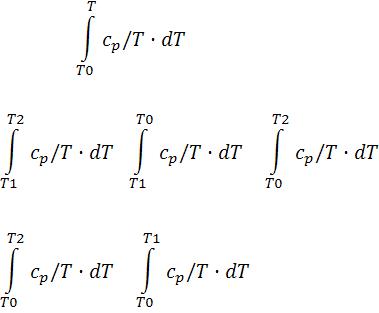
Левый интеграл (5-11) можно аналитически проинтегрировать только для одноатомного газа. Поскольку у одноатомного газа при умеренных температурах cp = const. Для двух и более атомного газа cp – сложная функция температуры. Температурную зависимость теплоемкости дает колебательная степень свободы.
Введем функцию s°(T):
s° (T) = |
|
, кДж/(кг·К). |
|
(5-13) |
Тогда интеграл от T1 до T2 |
равен сумме интегралов от T1 |
до T0 |
и от T0 до T2: |
|
|
= |
+ |
. |
(5-14) |
Или применив свойство определенного интеграла:
– |
= s°(T2) – s°(T1) . |
(5-15) |
(5-12) можно записать:
s(p2, T2) – s(p1, T1) = s°(T2) – s°(T1) – R·ln(p2/p1) |
(5-16) |
Функция s°(T) (5-13) называется стандартной энтропией. Это энтропия, отнесенная к стандартному давлению p0. Обычно p0 равно 1 бар или 1 атм (в зависимости от справочника). T0 – некоторая температура, в принципе, ее можно взять любой. Функция s°(T) для данного ИГ табулирована в таблицах как функция температуры.
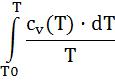
Если взять термодинамическое тождество (5-3),то по аналогичному алгоритму можно получить:
s(v2, T2) – s(v1, T1) = sv°(T2) – sv°(T1) + R·ln(v2/v1) , |
(5-17) |
где
sv° (T) = |
, кДж/(кг·К) , |
(5-18) |
где T0 – некая константа, ее значение можно взять любым. Данная функция табулирована в таблицах Александрова А.А и др. в части ИГ.
Начало отсчета энтропии. Обычно, в технических задачах произвольно задается точка
p0,T0, в которой энтропия равна нулю: |
|
s0 = s(p0,T0) = 0 |
(5-19) |
Например, p0 = 1 бар; t0 = 0°С, или что-то иное. Тогда согласно (5-16): |
|
s(p, T) – s(p0, T0) = s°(T) – s°(T0) – R·ln(p/p0), |
(5-20) |
С учетом (5-19): |
|
s(p, T) = s°(T) – s°(T0) – R·ln(p/p0). |
(5-21) |
С помощью (5-21) можно получить энтропию точки, если задать начало отсчета (5-19). |
|
Изоэнтропный процесс.
Обратимый адиабатный процесс согласно 2-го закона термодинамики (5-2) будет проходить при s = const. Процесс при s = const называется изоэнтропным процессом.
Если заданы параметры 1-й точки изоэнтропного процесса s(p2, T2) = s(p1, T1) и задано давление в точке 2, то можно найти и остальные параметры в точке 2 по (5-16):
s°(T2) = s°(T1) + R·ln(p2/p1), |
(5-22) |
или если известно изменение объема (удельного объема) в данном процессе: |
|
sv°(T2) = sv°(T1) – R·ln(v2/v1), |
(5-23) |
Есть еще один способ нахождения второй точки в изоэнтропном процессе. С помощью |
|
безразмерного давления (если известно изменение давления в процессе): |
|
p2/p1 = π0(T2)/π0(T1) = π02/π01, |
(5-24) |
либо безразмерного объема θ0(T), если известно изменение объема (удельного объема) в данном процессе:
V2/V1 = v2/v1 = θ0(T2)/θ0(T1) = θ02/θ 01, |
(5-25) |
Значения s°(T) табулированы в таблицах Ривкина и Александрова; sv°(T) – только в таблицах Александрова; функции π0(T) и θ0(T) табулированы в таблицах Ривкина.
Эксергия тепла.
Рассмотрим эксэргию теплового источника бесконечной емкости. Температура его отличается от окружающей среды. Температура источника Tист при теплообмене не будет меняться.
Имеется два тепловых источника: тепловой источник с Tист и окружающая среда с TОС. Для того чтобы получить работу между ними необходимо подключить тепловую машину. Самой эффективным тепловым двигателем является обратимый цикл Карно. Подключим именно эту тепловую машину. В этом случае работа будет максимальной, при прочих равных условиях. Эксергия при использовании тепла теплового источника в количестве Q:
Ex = Q·ηКарно = Q·(1 – TОС/ Tист) , кДж. |
(5-26) |
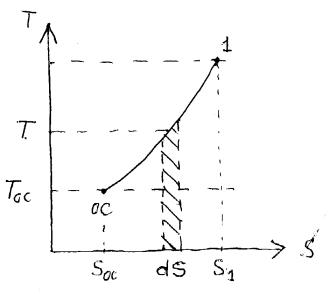
Рассмотрим теперь обратимый цикл Карно, у которого верхний источник тепла, по мере отбора от него энергии в форме теплоты, понижает температуру.
На рис. 5.1 представлена T, s- диаграмма процесса охлаждения источника теплоты. Охлаждение источника осуществляется обратимой машиной Карно, у который верхний источник имеет переменную температуру. Осуществим весь процесс охлаждения 1 – ОС с помощью бесконечной совокупности элементарных циклов Карно. Один из таких элементарных циклов заштрихован. Поскольку забирается бесконечно малое количество энергии от источника тепла, можно считать, что температура не меняется при подводе тепла к циклу, и весь процесс передачи тепла происходит при постоянной
Рисунок 5.1. |
температуре T. |
|
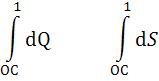
Эксергия тепла в таком элементарном процессе запишется как для источника тепла с постоянной температурой (5-26):
dEx = dQ·ηКарно = dQ·(1 – TОС/T) , кДж. |
(5-27) |
Для обратимого процесса согласно 2-го закона термодинамики (5-1) теплоту dQ можно записать:
dQ = T·dS, кДж. |
(5-28) |
(5-27) и (5-28): |
|
dEx = dQ – TОС·dQ/T = dQ – TОС·dS , кДж. |
(5-29) |
Для того, чтобы получить эксергию источника тепла нужно просуммировать всю совокупность бесконечного числа работ элементарных циклов Карно от точки 1 до точки ОС. Это значит, что нужно проинтегрировать выражение (5-29). Учитывая, что TОС константа, получим:
Ex = |
+TОС· |
= QОС_1 – TОС·(S1 – SОС) , кДж. |
(5-30) |
При написании уравнения (5-30) следует учитывать следующее обстоятельство. Рис. 5.1 отражает процессы источника тепла, а нам необходимо записать уравнение для рабочего тела. Процесс передачи тепла для них диаметрально отличаются, если от источника тепла энергия в форме теплоты забирается (минус у теплоты), то рабочее тело это тепло получает (плюс у теплоты). Поэтому по сравнению с рис. 5.1 знаки должны быть противоположными (у dQ), что и отражено в формуле (5-30) – изменены пределы интегрирования.
Теорема Гюи – Стодолы. Потеря эксергии. |
|
ΔEx = TОС·ΔSсист , кДж, |
(5-31) |
где sсист – изменение энтропии системы (включая окружающую среду, если с нею происходит теплообмен).
Задача №22 (7.23).
Определить эксергию 100 кДж теплоты при температуре 700°С. Температура среды 0°С. Определить потерю эксергии этой теплоты, если последняя будет передана тепловому источнику с температурой 500°С.
Задача №23 (7.27).
Определить эксергию 1 кг горячих газов в котельном агрегате. Известно, что температура пламени равна 1500°С, давление газов близко к атмосферному. Параметры окружающего воздуха: pОС=0,1 МПа и tОС=10°С. Принять, что термодинамические свойства газов аналогичны свойствам воздуха. Задачу решить с помощью таблиц Ривкина.
Задача №24.
Рассчитать изменение энтропии 14 кг ИГ CO2, если параметры меняются от p1 = 8 бар, t1 = 30°C
до p2 = 45 бар, t2 = 250°C.
Задача №25 (7.25).
Определить эксергию количества теплоты, которое получается в результате сгорания на воздухе 1 кг топлива с теплотой сгорания QРН = 25,0 МДж/кг, температура горения 1500°С; температура окружающей среды tОС = 20°С. Теплоемкость продуктов сгорания принять постоянной.

Задача №22 (7.23).
Определить эксергию 100 кДж теплоты при температуре 700°С. Температура среды 0°С. Определить потерю эксергии этой теплоты, если последняя будет передана тепловому источнику с температурой 500°С.
T1 = 700 + 273,15 = |
K; |
T2 = 500 + 273,15 = |
K; |
||
TОС = 0 + 273,15 = |
K; |
|
|
|
|
ηКарно = (1 –T |
/T ) = |
|
ηКарно = (1 –T |
/T ) = |
|
1 |
ОС 1 |
|
2 |
ОС 2 |
|
SI = –Q/T1 = |
|
кДж/К; |
SII = Q/T2 = |
|
кДж/К; |
Sсист = SI + |
|
SII = |
кДж/К; |
||
Ex |
1 |
= Q·ηКарно |
1 |
= |
кДж; |
|
|
|
|
||
Ex |
2 |
= Q· ηКарно |
= |
кДж; |
|
|
|
2 |
|
|
|
Ex = Ex1 – Ex2 = |
кДж; |
||||
2-й способ, Гюи – Стодола: |
|
||||
Ex = TОС· Sсист = |
кДж; |
||||
34753 – Q2
