
Контрольные вопросы
1. На чем основаны потенциометрические методы анализа?
Потенциометрический метод анализа основан на измерении электродвижущей силы (э.д.с.) обратимых гальванических элементов. Гальванический элемент состоит из двух электродов, индикаторного и электрода сравнения, погруженных в один раствор (цепь без переноса), либо в два различающихся по составу раствора, связанных жидкостным контактом (цепь с переносом).
2. Какая зависимость выражается уравнением Нернста?
Потенциал индикаторного электрода связан с активностью и концентрацией веществ, участвующих в электродном процессе, уравнением Нернста:
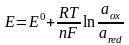 =
=
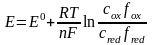 ,
(1.1)
,
(1.1)
где E0 – cтандартный потенциал редокс-системы; R – универсальная газовая постоянная; Т – абсолютная температура; F – постоянная Фарадея; n – число электронов, принимающих участие в электродной реакции; aox,, ared – активности окисленной и восстановленной форм редокс-системы; сox,, сred – их молярные концентрации; fox,, f red – коэффициенты активности.
3. Какие функции выполняют индикаторные электроды и электроды сравнения?
Индикаторным называют электрод, потенциал которого определяет активность анализируемого иона в соответствии с уравнением Нернста.
Электродом сравнения называют электрод, потенциал которого постоянен и не зависит от концентрации ионов в растворе. Солевой мостик служит для предотвращения смешивания анализируемого раствора и раствора электрода сравнения.
индикаторные электроды подразделяют на электроды первого и второго рода. Электроды первого рода представляют собой металлическую пластинку или проволоку, погруженнyю в раствор хорошо растворимой соли этого металла, например, серебряную проволоку, опущенную в раствор нитрата серебра; медную пластинку, погруженную в раствор сульфата меди.
Электроды второго рода состоят из металла, покрытого слоем его малорастворимого соединения (соли, оксида или гидроксида) и погруженного в раствор, содержащий тот же анион, что и в труднорастворимом соединении. С помощью электродов второго рода измеряют концентрацию ионов, не участвующих непосредственно в пpоцессе переноса электрона. Например, потенциал серебряного электрода будет правильно отражать концентрацию хлорид-ионов в растворе, насыщенном хлоридом серебра. Эти электроды широко используются и как электроды сравнения, по отношению к которым измеряют потенциалы других электродов.
4. Как устроен стеклянный электрод? Как с его помощью определяют рН раствора? Какие достоинства и недостатки он имеет?
Стеклянный электрод — это обычно стеклянный шарик с толщиной стенок 0, 06-0, 1 мм., наполненный раствором кислоты или соли, в который для контакта погружена платиновая проволочка. Поверхность стекла такого шарика в растворе приобретает потенциал, величина которого зависит от концентрации водородных ионов в растворе.
Индикаторный стеклянный электрод в форме трубки с тонкостенным шариком на конце, из особого электропроводящего боросиликатного стекла, включается по сути в электрическую цепь. Перемещение внутри такого стекла положительных ионов Н+ позволяет использовать его (катионы внутри стекла перемещаются относительно полианиона кремниевой кислоты).
Достоинства стеклянного электрода:
простота работы
быстрое установление равновесия
на точность определения pH не влияет присутствие окислителей или восстановителей;
на электрод не действуют яды, коллоиды и другие вещества, искажающие точность определений pH;
позволяет работать с кислыми и щелочными растворами в широком диапазоне pH (от 0 до 12 – 13).
работает от 0º до 95ºС
Недостатки стеклянного электрода:
хрупкость
нельзя использовать обычную потенциометрическую установку вследствие большого сопротивления электрода;
для усиления тока электродной пары со стеклянным электродом необходимо использовать струнные или зеркальные гальванометры или ламповые усилители;
возможна погрешность в определении стандартного значения
при работе обнаруживается явление – «потенциал асимметрии стеклянного электрода»( Когда обе поверхности стеклянного электрода соприкасаются с растворами, концентрации водородных ионов в которых одинаковы, на внутренней и внешней поверхностях электрода возникают разные потенциалы. Это свидетельствует о различии в свойстве внутренней и внешней поверхностей стеклянного электрода из легкоплавкого стекла с большой электропроводностью, очень тонкими стенками и периодическим выдерживанием в воде, в слабощелочном буфере и в буфере с pH, равным pH внутреннего раствора стеклянного шарика. Чем больше потенциал асимметрии, тем менее устойчивы показания p
