
Лабораторные / ЛР-7
.docxМИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ АВТОНОМНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ
«Национальный исследовательский ядерный университет «МИФИ»
Обнинский институт атомной энергетики –
филиал федерального государственного автономного образовательного учреждения высшего образования «Национальный исследовательский ядерный университет «МИФИ»
(ИАТЭ НИЯУ МИФИ)
Инженерно-физический институт биомедицины
Отделение биотехнологий
Кафедра биологии
Отчет по лабораторной работе №7
На тему: «Определение актуальной и обменной кислотности почвы потенциометрическим методом»
Работу выполнил: Студент курса гр.
Проверил:
Оценка:
Оглавление
Цель работы 3
Основные понятия 3
Потенциометрическое определение кислотности почвы 5
Посуда и оборудование 5
Выполнение работы 5
Обсуждение результатов 6
Выводы 6
Цель работы
Освоить потенциометрический метод определения кислотности почвы.
Основные понятия
Кислотность почвы имеет более широкий смысл, чем кислотность обычного раствора. В зависимости от того, в каком состоянии находятся в почве ионы водорода, различают следующие виды кислотности: актуальную (почвенного раствора) и потенциальную с подразделением последней на обменную и гидролитическую (Рис.2).
Актуальная кислотность – это кислотность почвенного раствора, которая характеризуется величиной рН, равной
–lg[H+], где [H+] – активность ионов водорода в почвенном растворе, в молях Н+ на литр почвенного раствора. рН < 7 соответствует кислой реакции раствора; рН> 7 – щелочной. В почвоведении принято называть нейтральными почвы со значениями рН от 6,5 до 7 .
КИСЛОТНОСТЬ
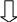
ПОТЕНЦИАЛЬНАЯ КИСЛОТНОСТЬ
АКТУАЛЬНАЯ КИСЛОТНОСТЬ


ОБМЕННАЯ КИСЛОТНОСТЬ
ГИДРОЛИТИЧЕСКАЯ КИСЛОТНОСТЬ

Рис.2 Виды кислотности в почве
Потенциальная кислотность – способность твердой фазы почвы проявлять себя как слабая кислота при взаимодействии с растворами солей вследствие появления в растворе дополнительного количества ионов Н+, вытесняемых из почвенно–поглощающего комплекса. Наиболее сильно на кислотность почвы оказывают влияние катионы алюминия, вытесняемые из ППК.
Катионы водорода присутствуют не только в растворе, но и на участках обмена катионами твердой фазы почвы, и тогда говорят об обменной кислотности, как части потенциальной, которую также измеряют в единицах рН.
Природа обменной кислотности обусловлена составом и свойствами почвенных коллоидов кислота. Источником обменного водорода могут служить органические кислоты и угольная кислота. Катионы водорода этих кислот внедряется в диффузный слой почвенных коллоидов, занимая место оснований, выщелачивающихся или выпадающих в осадок:
[ППК2 – ] Са2+ + R(СООН)2= [ППК2 – ]2Н+ +R(СОО – )2Са,
[ППК2 – ] Са2+ + Н2СО3=[ППК2 – ]2Н++ СаСО3 .
Обменную кислотность определяют по концентрации титруемых ионов Н+ в вытяжке 1н раствора хлористого калия. При взаимодействии нейтральной соли с почвенно – поглощающим комплексом обменные ионы водорода и алюминия вытесняются в почвенный раствор:
![]() .
.
Далее хлорид алюминия – соль слабого основания и сильной кислоты – подвергается гидролизу, причем гидролиз в обычных условиях идет, в основном, по 1 – ой ступени:
AlCl3+HOH = AlOHCl2 + HCl ,
AlOHCl2+HOH= Al(OH)2Cl +HCl ,
Al(OH)2Cl+ HOH = Al(OH)3 + HCl
Гидролитическая кислотность равна величине потенциальной кислотности почвы, которая формируется при взаимодействии почвы с раствором гидролитически щелочной соли (соли сильного основания и слабой кислоты).
Кислотность почвы – величина не постоянная. подкисление почв происходит в результате
абсорбции почвенным раствором из атмосферы СО2 ;
воздействия кислотных дождей;
изменения состава ППК за счет выщелачивания обменных Са2+ и Mg2+ потоком воды просачивающихся через почву осадков;
выветривания алюмосиликатных минералов, входящих в состав почвообразующей породы, при этом соли алюминия попадают в почву и подвергаются кислотному гидролизу, в результате которого ионы Н+ поступают в почвенный раствор;
применения физиологически кислых минеральных удобрений (аммиачной селитры, калийной соли и др.);
выделения органических кислот при разложении растительных остатков, корневой деятельности растений и микроорганизмами.
С увеличением кислотности почв увеличивается подвижность и доступность для растений ионов тяжелых металлов, увеличивается количество обменного алюминия, в результате чего фосфаты выпадают в осадок.
Для суждения о кислотности почвы определяют рН водного и солевого растворов (водная и солевая вытяжка). Величина рН водного раствора характеризует актуальную кислотность, а солевого – обменную кислотность почвы. Обычно рН солевой вытяжки ниже рН водной вытяжки, так как обменные катионы водорода вытесняются нейтральной солью с поверхности почвенных частиц в раствор.
Величину рН можно определить с помощью индикаторов в прозрачных и бесцветных растворах и потенциометрическим методом в суспензиях. Электрохимическими методами можно определять рН в прозрачных и мутных растворах и непосредственно в почвенных суспензиях. В настоящее время, в основном, пользуются потенциометрическим методом, так как он прост, определение требует немного времени, что важно при массовых анализах.
Потенциометрическое определение кислотности почвы
Метод потенциометрии основан на измерении электродвижущей силы (ЭДС), возникающей при опускании в почвенную суспензию, в водную или солевую вытяжку двух разных электродов (индикаторного и электрода сравнения).
Применяемые в практике приборы откалиброваны в единицах рН. Потенциал одного электрода – электрода сравнения – не зависит от значения рН испытуемого раствора. В качестве электрода сравнения используется хлорсеребряный электрод. Потенциал второго электрода – индикаторного – зависит от рН раствора. В качестве индикаторного используется стеклянный электрод. Разность потенциалов между электродами прямо пропорциональна рН.
Перед измерением калибруют рН – метр по буферным растворам и проводят измерение в соответствии с инструкциями изготовителя прибора.
Посуда и оборудование
Потенциометр рН – 121; индикаторный электрод – стеклянный; электрод сравнения – хлорсеребряный; технические весы; фарфоровая ложка; стаканы стеклянные (V=100 мл) – 2 шт.; мерные цилиндры (V=50 мл) – 2 шт.; промывалка.
Выполнение работы
Подготовка образца почвы осуществляется в лаб. работе № 1.
На технических весах берут две навески по 10 г подготовленного образца почвы в стеклянные стаканы.
Готовят водную вытяжку из почвы, приливая к навеске 50 мл дистиллированной воды (соотношение почва : вода = 1: 5).
Готовят солевую вытяжку из почвы, приливая к навеске 50 мл 1 н раствора KCl (из расчета почва : раствор = 1:5).
Погружают электроды последовательно в первый и второй стаканы; проводят измерения на рН – метре водной и солевой вытяжек, предварительно включив магнитную мешалку. Измеренное значение рН в течение 5 сек не должно изменяться более, чем на 0.02.
после каждой пробы электроды промывают и высушивают фильтровальной бумагой.
Записывают результаты измерений в таблицу 12.
Таблица 12
Результаты потенциометрического определения кислотности почвы
Наименование пробы |
Значения измерений рН в водной вытяжке |
Значения измерений рН в солевой вытяжке |
№6 |
8,1 |
6,5 |
Актуальная кислотность |
Обменная кислотность |
Обсуждение результатов
В ходе проведенного исследования мы установили, что почвенный образец, взятый в ***, по показателям актуальной кислотности равен pH=8,1, что соответствует щелочной среде (нейтральная среда в значениях от 6,5 до 7).
В зависимости от обменной кислотности почвы со средним содержанием гумуса ( 2 - 3 %) подразделяют по степени нуждаемости в известковании следующим образом: при рН=4,5 и ниже - нуждаемость сильная, от 4,6 до 5,0 - средняя, от 5,1 до 5,5 - слабая и при рН выше 5,5 - почва в известковании не нуждается. Наш же образец имеет обменную кислотность pH=6,5, что свидетельствует о том, что почва не нуждается в известковании.
Выводы
В ходе Лабораторной работы №7 «Определение актуальной и обменной кислотности почвы потенциометрическим методом». Повышенная кислотность почвы негативно сказывается на росте большинства культурных растений за счёт уменьшения доступности ряда макро- и микроэлементов, и наоборот, увеличения растворимости токсичных соединений марганца, алюминия, железа, бора и др., а также ухудшения физических свойств. Для снижения кислотности прибегают к известкованию.
