
4219
.pdf21
концентрацию нуклеиновой кислоты в пробе. Оптическая плотность D = 1 A соответствует приблизительно 50 мкг/мл двухцепочечной ДНК. Соотношение экстинкции 260/280 нм позволяет судить о чистоте нуклеиновой кислоты. Коэффициент отношения волн 260/280 нм для чистых препаратов ДНК должен укладываться в переделы 1,7 – 2,0. Коэффициент отношения волн 230/260 нм должен быть в переделах 0,3 – 0,9. Выход за параметры этих значений будет свидетельствовать о чрезмерном загрязнении образцов примесями (белки, фенолы, соли и др.). Привести концентрации проб к оптимальному значению путем разбавления водой.
3.4. Протокол постановки ПЦР
Подготовить необходимые компоненты ПЦР-смеси. В штатив с хладагентом поместить пробирки, предназначенные для проведения ПЦР. Рассчитать общее количество компонентов. Навести суммарную смесь в одной пробирке и разнести поровну в остальные. Добавить в каждую пробирку соответствующую ДНК-матрицу и довести водой до конечного объёма.
Состав ПЦР-смеси на 25 мкл: 2,5мкл 10х ПЦР-буфера, 2,5мкл 25мМ MgCl2, 1мкл 10мМ смесь дНТФ (дезоксинуклеотид трифосфаты), 1 ед. Taq- ДНК-полимеразы, по 1мкМ прямого и обратного праймеров, ДНК-матрицы (её объем зависит от концентрации полученной ДНК), деионизованной воды до 25мкл. Перемешать, поместить в амплификатор, запустить необходимую программу.
Классический вид программы ПЦР для амплификатора (стадии со 2 по 4 повторяются циклически в количестве 25-40):
1.Первичный прогрев 95 °С - 5 мин
2.Денатурация 90–95 °С - 15 с. Происходит расщепление двухцепочечной молекулы ДНК.
3.Отжиг 20 с (температура отжига зависит от длины и нуклеотидного состава праймера и устанавливается оптимизированной для используемых праймеров (40–60 °С)).
4.Элонгация 72 °С - 40 с
5.Конечная элонгация 72 °С - 5 мин
6.Хранение 4 °С - ∞
Состав смеси и программа ПЦР могут варьировать и подбираются экспериментально.
3.5. Протокол постановки электрофореза в агарозном геле
Приготовить агарозный гель (сварить) необходимого состава и объёма. Состав 2 % агарозного геля: агароза 2 %,трис-ацетатный буфер 2 % (pH 8,5, 2М трис, 0,5М ЭДТА, уксусная кислота, дистиллированная вода), вода до конечного объема. Необходимый объём геля выбирается, исходя из
22
вместимости заливочного столика электрофоретической камеры. Собрать заливочный столик. После охлаждения геля до температуры 55 °С добавить бромистый этидий (0,01 % от объёма геля), хорошо перемешать и залить в заливочный столик. Вставить гребёнку. Застывший гель переместить в электрофоретическую камеру. Смешать краситель с пробами (их соотношение зависит от кратности красителя, указанной на упаковке). Закрыть камеру и включить источник питания. После окончания электрофореза поместить гель в систему гель-документации для анализа результата.
3.6. Протокол выделения и очистки ампликона из агарозного геля
(на примере наборов Eurugen Cleanup Mini)
Вырезать фрагменты проб из агарозного геля. Поместить вырезанные фрагменты геля в микроцентрифужные пробирки. Взвесить фрагменты геля.
К каждой пробе добавить три объёма (в данном случае объём приравнивается к массе фрагмента геля) «Связывающего раствора». Инкубировать пробы при 53 °С до полного растворения геля, перемешивая. Весь объём пробы перенести в собранные колонки. Центрифугировать колонки с пробами при 13 000 g 30 секунд. Слить жидкость из собирательной пробирки и добавить в каждую пробу по 700 мкл «Промывочного раствора». Центрифугировать колонки с пробами при 13 000 g 30 секунд. Удалить жидкость из собирательной части колонки. Центрифугировать колонки при 13 000 g 60 секунд. Колонки переместить в чистые микроцентрифужные пробирки. Нанести дозатором на мембрану колонки 12 мкл «Элюирующего раствора». Центрифугировать колонки с пробами при 13 000 g 30 секунд.
3.7. Протокол постановки секвенирующей ПЦР
Концентрация ДНК-матрицы для расчета количества, используемого на секвенирующую реакцию, определяется спектрофотометрически (см. п. 2.3).
В микроцентрифужную пробирку внести 10 мкл реакционной смеси
(Terminator Ready Reaction Mix, праймер (3 мкМ р-р), ДНК-матрица,
деионизованная вода). Соотношение компонентов подбирается эмпирически. Программа амплификации:
1. Первичная денатурация 95 °С - 1 мин Затем 25 - 30 циклов:
1.Денатурация 95 °С - 10 с
2.Отжиг 50 °С - 10 с
3.Элонгация 60 °С - 4 мин
Охлаждение реакционной смеси до 4 °С - 5 мин Хранение 4 °С - ∞
После секвенирующей ПЦР необходимо провести очистку продукта от непрореагировавших компонентов.
23
3.8. Протокол очистки продуктов секвенирующей ПЦР набором BigDye® XTerminator Purification Kit
Добавить к пробам по 45 мкл буфера «SAMSolution». Тщательно промешать на вортексе «XTerminatorSolution» и быстро добавить к пробам по 10 мкл. Перемешивать в течение 30 минут. Центрифугировать пробы на 1 000 g 2 минуты. Отобрать не менее 10 мкл супернатанта в пробирки для последующего определения нуклеотидной последовательности.
3.9. Протокол определения структуры ДНК на генетическом анализаторе ABI PRISM 310
Электрофоретический анализ и детекцию провести на секвенаторе ABI PRISM 310 в соответствии с прилагаемой к прибору инструкцией.
1 Подготовка прибора к работе.
Установка ячейки. Открыть двери прибора. В промытую1 dH20 и высушенную ячейку вкрутить три чистые ферулы (верхняя, нижняя, капиллярная). Вставить ячейку в прибор по направляющим металлическим штырям.
Установка шприца. В чистый сухой шприц2 медленно набрать полимер (max 0,8 мл). Протереть шприц. Отвернуть лапку привода шприца на приборе влево. Вкрутить шприц в ячейку (правая верхняя).
Установка капилляра3. Открыть дверцу печки. Поместить конец капилляра в перекрестье каналов ячейки и закрепить боковой ферулой. Второй конец капилляра пропустить в отверстие шайбы крепления электрода и закрепить так, чтобы конец капилляра выступал на пол миллиметра. Расположить просвет капилляра напротив окна детектора, совместив метки и закрыть крышку. Окончательно закрепить капилляр термо-скотчем и закрыть дверцу печки. Поместить свободный конец капилляра в буфер.
2 Запуск прибора.
Включение прибора и заполнение ячейки. Включить прибор. Включить ПК. Запустить ПО – Data collection. Закрыть клапан буферной ячейки: Window>>Manual control>>Function>>Buffer valve close >>Execute. Закрутить верхнюю ферулу и открутить нижнюю. Продавить полимер до выхода из отверстия нижней ферулы: Data collection>>Window>>Manual control>>Function>>Syringe down>>указать Value (для более короткого шага использовать shift down)>>Execute. Закрутить нижнюю и открутить верхнюю ферулу. Продавить полимер до выхода из отверстия верхней ферулы. Закрутить верхнюю ферулу и открыть клапан: Window>>Manual control>>Function>>Buffer valve open>>Execute. Продавить полимер до выхода из отверстия клапана. Закрыть клапан.
3 Калибровка и диагностика.
Калибровка автосемплера: Data collection>>Window>>Manual control>>Autosample colabration>>Tray>>Снимаем адаптер>>Фиксируем капилляр на точке в соответствии с изображением на экране>>Start>>Page up
24
поднимаем автосемплер вверх (shift up – более мелкие шаги), когда закончилось позиционирование, нажать set (нужно обращать внимание, какой текст отображается в диалоговом окне)>>Resume.
Диагностика детектора: Date collection>>File>>New Injection list>>SeQuensingtestsens, sss>>Modute>>Test CCD 4-colour>>Run.
Установка проб. Закрепить пробы на мягких септах. Нажать Tray. Собрать сендвидж и установить его в автосемплер. Нажать Tray. Закрыть дверцы прибора.
Включение печки: Data collection>>Window>>Manual control>>Temperature set>>Value 50>>Execute>>Window>>Status.
Запуск секвенирования: Data collection>>File>>New>>Sequence sample sheet на 96 образцов>>Sample name (назвать образцы, согласно занимаемому месту в штативе)>>Save as>>Закрыть все диалоговые окна для обновления полученной информации>>File>>New>>Injection list>>Выбирать созданный sample sheet (в дальнейшем будет пониматься, как матрикс)>>Выбрать module>>Задать условия электрофореза>>Run.
4 Завершение работы.
Открыть дверцы прибора. Изъять образцы: Tray>>Разобрать и промыть сендвидж>>Tray. Закрыть и выключить прибор.
Примечание:
1 Промывание ячейки. Отсоединить чашку с буфером и капилляр от ячейки, вынуть её из прибора. Последовательно промыть каналы ячейки dH20 через все ферулы пластиковым шприцем. Продуть каналы ячейки воздухом из шприца и дать высохнуть при комнатной температуре.
2Промывание шприца. Отвернуть лапку привода шприца на приборе влево. Data collection>>Window>>Manual control>>Function>>Syring home>>Execute. Открутить шприц, избавить от остатка полимера и десять раз промыть dH20. При необходимости, перед промывкой можно разобрать шприц. Дать высохнуть при комнатной температуре.
3Капилляр вне упаковки и прибора хранить погруженными концами в деионизованной воде.
3.10. Протокол анализа результатов секвенирования
Использование программного обеспечения SeqA6. Запустить SeqA6. Загрузить данные: File>>AddSample(s)…>> в диалоговом окне выделить файлы сырых данных секвенирования с именами образцов, лежащих в папке с именем-датой в директории «Runs»1 >>нажать кнопку «Add Selected Samples»>>Ok. В открывшемся окне выбрать содержимое ячейки «DeySet/Primer» – подходящий набор химии и капилляр. Установить галочку в ячейке «Show». Нажать кнопку > (play). Во вкладке «Sequense» появится нуклеотидная последовательность образца. После анализа (см. инструкцию к ПО) сохранить последовательности образцов.
Использование BLAST. Открыть в браузере страницу http://www.ncbi.nlm.nih.gov. Выбрать он-лайн приложение BLAST или
25
перейти по ссылке > http://blast.ncbi.nlm.nih.gov/Blast.cgi?PROGRAM=blastn&PAGE_TYPE=BlastS earch&LINK_LOC=blasthome. Скопировать последовательность образца из SeqA6 в соответствующее окно ресурса. Запустить анализ>>нажать
<BLAST>.
Примечание:
1 Директория «Runs» обычно расположена по пути: <Корневой каталог>:\AppliedBio\310\Runs.
4. Биотехнология in vitro в лесокультурной практике
Для плантационного лесовыращивания необходимы эффективные и надежные методы получения высококачественного посадочного материала с гарантированным сохранением ценных свойств исходных материнских деревьев.
Разработанная технология микроклонального размножения ценных генотипов тополя, березы и ольхи обеспечивает возможность ускоренного и в массовом количестве получения качественного посадочного материала от лучших экземпляров деревьев, которые плохо или совсем не размножаются черенкованием (традиционным способом), а ее применение позволит перейти на сортовую основу лесовыращивания ценных генотипов.
Для использования данных методических рекомендаций на других близкородственных лиственных породах необходимо провести адаптацию отдельных этапов культивирования с учетом видовой специфики объектов. Особой тщательности подбора питательных сред и условий культивирования требуют этапы получения первичных культур и регенерации растений, а также отработка оптимальных режимов адаптации растений-регенерантов к нестерильным условиям почвы.
4.1.Технологическая схема производства посадочного материала ценных генотипов тополя, березы и ольхи методом
in vitro для создания плантационных культур
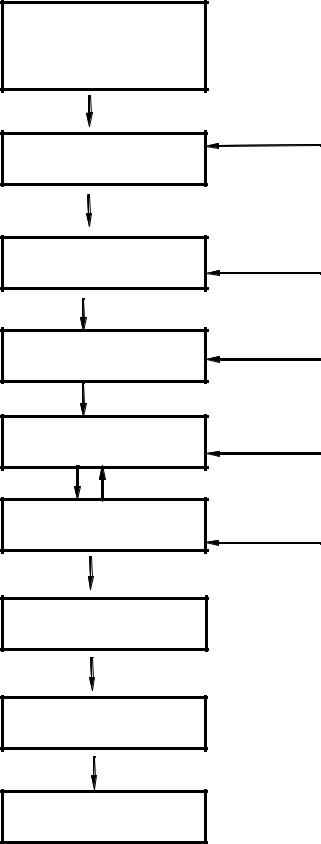
Основные этапы микроклонального размножения тополя сереющего и технологическая схема производства посадочного материала ценных генотипов тополя сереющего представлены на рис. 6.
26
Неодревесневшие летние побеги
взрослых деревьев
Узловые
сегменты
Основной пазушный побег
Регенерация растений
Микрочеренкование
Укоренение
Адаптация
растений
Теплица
Плантационные
культуры
WPM
6-БАП 0,5 мг/л +
ГК 0,2 мг/л
1/2 WPM или
1/2 MS
без гормонов
1/2 WPM или
1/2 MS
без гормонов
1/2 WPM или
1/2 MS
без гормонов
1/2 WPM или
1/2 MS
без гормонов
Рис. 6. Технологическая схема производства посадочного материала тополя сереющего методом in vitro для создания плантационных культур
27
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
Основная литература
1.Лутова, Л. А. Биотехнология высших растений [Текст] : учеб. /
Л. А. Лутова. – СПб., 2010. – 240 с.
2.Нечаева, М. Ю. Биотехнология в лесном хозяйстве [Текст] : учеб. пособие / М. Ю. Нечаева. – Воронеж, 2006. – 143 с.
Дополнительная литература
3. |
Братилова, |
Н. |
П. Культура ткани [Текст] : |
учеб. |
пособие |
/ |
Н. П. Братилова. – Красноярск, 2010. – 72 с. |
|
|
|
|||
4. |
Егорова, Т. |
Е. |
Основы биотехнологии [Текст] |
: учеб. |
пособие |
/ |
Т. Е. Егорова, М. С. Клунова, Е. А. Живухина. – М. : Академия, 2003. – 208 с.
5.Калашникова, Е. А. Получение посадочного материала древесных, цветочных и травянистых растений с использованием методов клеточной и генной инженерии [Текст] : учеб. пособие / Е. А. Калашникова, А. Р. Родин. –
М., 2001. – 73 с.
6.Машкина, О. С. Методические рекомендации по выращиванию посадочного материала сортов тополя сереющего с использованием
технологии in vitro [Текст] / О. С. Машкина, А. И. Сиволапов, Т. М. Табацкая. – Воронеж, 2011. – 30 с.
7.Нечаева, М. Ю. Практикум по биотехнологии для лабораторных занятий по специальности 260400 (250201) – Лесное хозяйство [Текст] / М. Ю. Нечаева, О. А. Землянухина. – Воронеж, 2008. – 41 с.
8.Сельскохозяйственная биотехнология [Текст] : учеб. / под ред. В. С. Шевелухи. – М. : Высш. шк., 2003. – 468 с.
|
|
28 |
|
|
Приложение 1 |
|
Список оборудования для ДНК-аналица |
|
№ |
Наименование |
Использование |
1 |
Автоматические дозаторы |
Для автоматического дозирования жидкостей |
2 |
Амплификатор (термоциклер) |
Для проведения полимеразной цепной реакции |
|
|
(ПЦР) |
3 |
Весы электронные |
Для взвешивания образцов и химических |
|
|
реактивов |
4 |
Вортекс |
Для перемешивания содержимого пробирок |
5 |
Генетический анализатор |
Для определения нуклеотидной |
|
|
последовательности участков ДНК |
6 |
Камера электрофореза с источником |
Для электрофоретического разделения |
|
питания |
наработанных продуктов ПЦР |
7 |
Мешалка магнитная |
Для перемешивания компонентов раствора |
8 |
Морозильная камера |
Для длительного хранения образцов и |
|
|
химических реактивов (от -20 до -80°С) |
9 |
ПЦР-бокс |
Рабочее место со стерильными условиями |
10 |
Рециркулятор воздуха и УФ- |
Для стерилизации рабочего помещения |
|
стерилизатор |
|
11 |
рН-метр |
Для измерения рН-среды растворов |
12 |
Система гель-документации |
Для получения электрофореграмм гелей |
13 |
Система очистки воды |
Для получения ультрачистой деионизованной |
|
|
воды |
14 |
Спектрофотометр |
Для качественных и количественных |
|
|
измерений в растворах |
15 |
Термостат твердотельный |
Для инкубации содержимого пробирок при |
|
|
постоянной необходимой температуре |
16 |
Термо-шейкер |
Для перемешивания и инкубации содержимого |
|
|
пробирок при заданной температуре |
17 |
Холодильная камера |
Для хранения образцов и химических |
|
|
реактивов (от 2 до 8°С) |
18 |
Центрифуга |
Для разделения компонентов смесей на |
|
|
фракции по массе |
19 |
Шкаф сухожаровый |
Для стерилизации стеклянной посуды |
29
Приложение 2 Список химических реактивов и пластиковой посуды на
различных этапах работ для ДНК-анализа
№ |
Этапы работ |
Наименование |
|
п/п |
|||
|
|
||
1 |
Выделение нуклеиновых |
Наконечники для автодозаторов |
|
|
кислот |
Пробирки типа эппендорф объемом 2 мл и 1,5 мл |
|
|
|
Трис(гидроксиметил)аминометан, С4Н11NO3 |
|
|
|
Бромидцетилтриметиламмония(CTAB), С14Н29N(СН3)3Br |
|
|
|
ЭДТА, С10Н14N2Na2O8·2H2O |
|
|
|
Хлористый натрий, NaCl |
|
|
|
Меркаптоэтанол-2 (β) (Тиоэтиленгликоль) |
|
|
|
Этанол, C2H5OH |
|
|
|
Хлороформ, CHCl3 |
|
|
|
Пропанол-2, С3Н7ОН |
|
|
|
Изобутилкарбинол (изоамиловый спирт), |
|
|
|
(CH3)2CHCH2CH2OH |
|
2 |
Полимеразная цепная |
Наконечники для автодозаторов |
|
|
реакция |
Пробирки типа эппендорф объемом на 0,2 мл |
|
|
|
Taq полимераза + буфер + Mg2+ |
|
|
|
Дезокситрифосфаты |
|
|
|
Праймеры |
|
3 |
Электрофоретическое |
Наконечники для автодозаторов |
|
|
разделение продуктов |
Уксусная кислота (ледяная), СН3СООН |
|
|
амплификации |
Агароза[C12H14O5(OH)4]n |
|
|
|
Трис(гидроксиметил)аминометан, С4Н11NO3 |
|
|
|
ЭДТА, С10Н14N2Na2O8·2H2O |
|
|
|
Краска для нанесения на гель |
|
|
|
Бромид этидия, С21Н20N3Br |
|
|
|
Маркер длин фрагментов |
|
|
|
|
|
4 |
Выделение и очистка |
Наконечники для автодозаторов |
|
|
продуктов амплификации |
Пробирки типа эппендорф объемом 1,5 мл |
|
|
из геля |
Набор для выделения ДНК из агарозного геля |
|
|
|
Этанол, C2H5OH |
|
5 |
Секвенирующая |
Наконечники для автодозаторов |
|
|
полимеразная цепная |
Пробирки типа эппендорф объемом на0,2 мл |
|
|
реакция |
BigDye® Terminator Cycle Sequencing Kit |
|
|
|
|
|
|
|
Праймеры |
|
|
|
|
|
6 |
Очистка продуктов |
Наконечники для автодозаторов |
|
|
секвенирующей |
Пробирки |
|
|
полимеразной цепной |
BigDye® XTerminatorPurificationKit |
|
|
реакции |
|
|
7 |
Определение |
310 GeneticAnalyzerCapillary, |
|
|
нуклеотидной |
POP денатурирующая разделительная матрица |
|
|
последовательности |
Буфер для генетического анализатора 310 с ЭДТА (10X) |
30
Алексей Иванович Сиволапов Игорь Юрьевич Исаков Владимир Алексеевич Сиволапов
БИОТЕХНОЛОГИЯ
Методические указания по организации и прохождению учебной практики для студентов по направлению подготовки
35.04.10 – Ландшафтная архитектура
