
2824
.pdf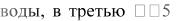
21
восстановительных реакций, учитывая, что в первом случае образуется свободный йод и сульфат марганца (II); во втором случае − сульфат марганца и кислород. Сделайте вывод об окислительно-восстановительной способности перманганатов.
Опыт 5. Влияние среды на характер восстановления перманганата калия
В три пробирки внесите по 3-4 капли раствора перманганата калия. В первую пробирку добавьте 2-3 капли раствора разбавленной серной кислоты, во 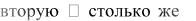 -6 капель раствора гидроксида натрия. Затем во все три пробирки прилейте по каплям раствор сульфита натрия до исчезновения фиолетово-малинового окрашивания. Наблюдайте изменение цвета растворов в каждой из пробирок.
-6 капель раствора гидроксида натрия. Затем во все три пробирки прилейте по каплям раствор сульфита натрия до исчезновения фиолетово-малинового окрашивания. Наблюдайте изменение цвета растворов в каждой из пробирок.
Запись данных опыта. Составьте уравнения окислительновосстановительных реакций ионно-электронным методом, учитывая, что в первой пробирке образуются сульфаты натрия и марганца (II); во второй пробирке − сульфат натрия и оксид марганца (IV); в третьей − сульфат натрия и манганаты калия и натрия. Сделайте вывод о характере восстановления перманганата калия в зависимости от реакции среды.
Вопросы для самоконтроля и повторения
1.Положение галогенов в периодической системе, строение их атомов.
2.Галогеноводородные кислоты и их соли.
3.Кислородные соединения хлора.
4.Кислородсодержащие кислоты галогенов и их соли.
5.Общая характеристика металлов подгруппы марганца.
6.Соединения марганца (II), (III), (IV): оксиды, гидроксиды.
7.Соединения марганца (VI), (VII): оксиды, кислоты, соли.
8.Применение марганца и его соединений.
9.Окислительно-восстановительные свойства соединений галогенов и марган-
ца.
Лабораторная работа № 8
Тема: ЭЛЕМЕНТЫ VIII ГРУППЫ ПЕРИОДИЧЕСКОЙ СИСТЕМЫ Д.И. МЕНДЕЛЕЕВА
Цель работы: ознакомить студентов с химическими свойствами соединений железа, никеля и кобальта.
22
Приборы, посуда и реактивы
Разбавленные растворы с молярной концентрацией эквивалента 2 моль/дм3: серной кислоты, гидроксида натрия. Концентрированный раствор гидроксида аммония (ω=25 %). Растворы солей с молярной концентрацией эквивалента
0,5 моль/дм3: гексацианоферрата (II) калия, гексацианоферрата (III) калия, хлорида железа (III), роданида аммония (или калия), иодида калия, карбоната натрия, нитрата никеля (II), нитрата кобальта (II). Кристаллические соли: сульфит натрия и соль Мора. Раствор пероксида водорода с массовой долей H2O2 3%.
Универсальная индикаторная бумага. Пробирки объемом 20 см3.
Порядок выполнения работы
Опыт 1. Характерные реакции на ионы Fe2+ и Fe3+
а) действие на соли железа (II) гексацианоферрата (III) калия
Приготовьте в пробирке раствор соли Мора (NH4)2SO4·FeSO4·6H2O (для приготовления раствора в пробирку поместите несколько кристалликов этой соли и растворите ее в небольшом количестве воды) и добавьте 1 каплю раствора гексацианоферрата (III) калия (красной кровяной соли K3[Fe(CN)6]). Отметьте цвет образовавшегося осадка (турнбулева синь), укажите химическое
название и формулу полученного вещества. Данная реакция является характерной на ион Fe2+.
Напишите молекулярное и ионное уравнения реакции.
б) действие на соли железа (III) гексацианоферрата (II) калия
Поместите в пробирку 2 – 3 капли раствора хлорида железа (III) и добавьте 1 каплю раствора гексацианоферрата (II) калия (желтой кровяной соли
K4[Fe(CN)6]). Что наблюдается? Данная реакция является характерной на ион
Fe3+.
Запись данных опыта. Напишите уравнение реакции в молекулярной и ионной форме. Отметьте цвет образовавшегося осадка (берлинская лазурь), укажите химическое название полученного вещества.
в) действие на соли железа (III) роданида аммония (или калия)
Поместите в пробирку 5 – 6 капель раствора хлорида железа (III) и добавьте 1 каплю раствора роданида аммония (или калия). Такой же опыт проделайте со свежеприготовленным раствором соли Мора.
23
Запись данных опыта. Напишите уравнение реакции с получением Fe(CNS)3, придающего раствору ярко-красную окраску. Отметьте, что окраска характерна только для соли железа (III).
Опыт 2. Окислительные свойства соединений железа (III)
а) окисление иодида калия
В пробирку с 3 – 4 каплями раствора FeCl3 добавьте 1 – 2 капли раствора иодида калия. В какой цвет и почему окрашивается раствор? Напишите уравнение реакции.
б) окисление сульфита натрия
В пробирку с 3 – 4 каплями раствора FeCl3 добавьте несколько кристалликов сульфита натрия. При этом вначале появляется буро-красное окрашивание вследствие образования малоустойчивого сульфита железа (Ш), которое исчезает при нагревании.
Убедитесь в восстановлении железа до степени окисления +2. Какой реактив следует для этого применить?
Запись данных опыта. Напишите уравнение реакции окисления сульфита натрия хлоридом железа (III), учитывая, что в реакции принимает участие вода.
Опыт 3. Комплексные соединения кобальта и никеля
а) получение комплексного роданида кобальта
Поместите в пробирку 5 капель раствора соли кобальта (II) и добавьте 5 – 6 капель раствора роданида аммония или калия; учтите, что при этом образуется раствор комплексной соли (NH4)2[Co(CNS)4]. Комплексные ионы [Co(CNS)4]2+ окрашены в синий цвет, а гидратированные ионы [Со(Н2О)6]2+ — в розовый. Отметьте цвет полученного раствора.
Запись данных опыта. Опишите наблюдаемые явления. Напишите: а) уравнение протекающей реакции; б) уравнение диссоциации комплексной соли кобальта;
в) уравнение, диссоциации комплексного иона; г) выражение константы нестойкости комплексного иона; д) название комплексной соли.
24
б) получение амминокомплекса никеля
К 5 – 10 каплям раствора соли никеля (II) добавляйте по каплям 25%-ный раствора аммиака до полного растворения выпадающего в начале осадка гидроксида. Как изменяется цвет раствора?
Запись данных опыта. Напишите уравнения реакций:
а) образования амминокомплекса никеля (координационное число никеля равно 6);
б) диссоциации комплексного соединения и комплексного иона.
Опыт 4. Гидроксиды кобальта (II) и никеля (II)
а) получение гидроксида кобальта (II) и его окисление
Выполнение работы. В две пробирки поместите по 5 капель раствора соли кобальта и добавляйте по каплям раствор щелочи; сначала появляется синий осадок основной соли, который затем становится розовым, что указывает на образование гидроксида кобальта (II). Осадок в одной пробирке тщательно размешайте стеклянной палочкой, а в другую прибавьте 2 – 3 капли 3%-ного раствора пероксида водорода. В какой из пробирок наблюдается окисление гидроксида кобальта?
Напишите уравнения протекающих реакций.
б) получение гидроксида никеля (II) и его окисление
В две пробирки поместите по 5 капель раствора соли никеля и добавьте по каплям раствор щелочи до выпадения осадка гидроксида никеля (II). В первой пробирке осадок тщательно размешайте стеклянной палочкой, во вторую добавите 2—3 капли 3%-ного раствора пероксида водорода. Наблюдается ли изменение цвета осадка? Происходит ли окисление гидроксида никеля (II) кислородом воздуха и пероксидом водорода?
Запись данных опыта. Напишите уравнения реакций. Сравните восстановительные свойства гидроксидов кобальта и никеля в степени окисления +2, используя значения стандартных окислительно-восстановительных потенциалов.
Вопросы для самоконтроля и повторения
1.Электронное строение атомов элементов триады железа.
2.Способы получения железа, кобальта и никеля.
3.Свойства простых веществ элементов триады железа.
4.Основные соединения железа, кобальта и никеля, их свойства и применение.
5.Комплексообразующие свойства соединений железа, кобальта и никеля.
25
Библиографический список
Основная литература
1. Мартынова Т. В. Неорганическая химия [Электронный ресурс] : рек. в качестве учебника для студентов высших учебных заведений / Т. В. Мартынова, И. И. Супоницкая, Ю. С. Агеева. — М. : ИНФРА-М, 2017. — 336 с. + Доп. материалы [Электронный ресурс; Режим доступа http://www.znanium.com]. - ЭБС"Знаниум.
Дополнительная литература
1.Саргаев П. М. Неорганическая химия [Текст] : доп. М-вом сел. хоз-ва РФ в качестве учеб. пособия для студентов вузов / П. М. Саргаев. - изд. 2-е, испр. и доп. - СПб.; М.; Краснодар : Лань, 2013. - 384 с.- Электронная версия в ЭБС "Лань".
2.Неорганическая и аналитическая химия [Электронный ресурс] : практикум / Новосиб. гос. аграр. ун-т. Агроном. фак.; сост.: Г. А. Маринкина. – Новосибирск, 2012. – 113 с. - ЭБС "Знаниум".
26
Дмитренков Александр Иванович Бельчинская Лариса Ивановна Новикова Людмила Анатольевна
Неорганическая химия
Методические указания к лабораторным работам для бакалавров по направлению подготовки 19.03.01 - «Биотехнология»
профиль – Промышленная экология
|
|
Редактор |
Подписано в печать |
|
Формат 60х90 /16. Объем п.л. |
Усл.печ.л. |
Уч.-изд. л. |
Тираж экз. Заказ № |
ФГБОУ ВО «Воронежский государственный лесотехнический университет имени
Г.Ф. Морозова»
РИО ФГБОУ ВО «ВГЛТУ». 394087, г. Воронеж, ул. Тимирязева, 8. Отпечатано в УОП ФГБОУ ВО «ВГЛТУ»
394087, г. Воронеж, ул. Докучаева, 10.
