
2674
.pdfМинистерство образования и науки Российской Федерации Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
«Воронежская государственная лесотехническая академия»
ПОЛИМЕРНЫЕ КОМПОЗИЦИОННЫЕ МАТЕРИАЛЫ
Методические указания к лабораторным работам с элементами УИРС для студентов по направлению подготовки 250400 – Технология лесозаготовительных и деревоперерабатывающих производств
Воронеж 2014
2
УДК 541+66.095.26+547.9+674
Ткачева, О. А. Полимерные композиционные материалы [Текст] : методические указания к лабораторным работам с элементами УИРС для студентов по направлению подготовки 250400 – Технология лесозаготовительных и деревоперерабатывающих производств / О. А. Ткачева, Л. А. Новикова ; М-во образования и науки РФ, ФГБОУ ВПО «ВГЛТА». – Воронеж, 2014. – 43 с.
Печатается по решению учебно-методического совета ФГБОУ ВПО «ВГЛТА» (протокол № 6 от 28 февраля 2014 г.)
Рецензент заведующий кафедрой ВМС и коллоидов ФГБОУ ВПО «ВГУ» д-р хим. наук, проф. Г.В. Шаталов
3
Оглавление
Введение………..………..………..………..………..………..………..………..……..……… |
4 |
Лабораторная работа № 1. Поликонденсация фенола с формальдегидом……………… |
5 |
Лабораторная работа № 2. Поликонденсация карбамида с формальдегидом………….. |
10 |
Лабораторная работа № 3. Глифталевые смолы …………………………………………. 14
Лабораторная работа № 4. Крашение полимеров, красители (с элементами УИРС) …. |
17 |
|
Лабораторная работа № 5. |
Крашение древесины, красители (с элементами УИРС) …. |
21 |
Лабораторная работа № 6. |
Определение вязкости и молекулярной массы полимеров |
26 |
Лабораторная работа № 7. Определение содержания свободного формальдегида в |
31 |
|
карбамидных смолах ………………………………………………………………………… |
|
|
Лабораторная работа № 8. |
Определение степени набухания полимеров .…..…..…..…. |
33 |
Лабораторнаяработа№9. Определениетемпературыразмягченияпометоду«кольцо-шар» |
34 |
|
Лабораторная работа № 10. Качественные реакции на некоторые природные полимеры |
36 |
|
Лабораторная работа № 11. Качественное определение растворимости полимеров…... |
38 |
|
Библиографический список………………………………………………………………...... 41

4
Введение
Методические указания содержат лабораторные работы по курсу «Полимерные композиционные материалы». При изучении данной дисциплины студент должен приобрести знания об особенностях строения и свойствах полимеров, методах получения природных синтетических и искусственных полимеров, усвоить понятие «композиционный материал», знать состав композиций и назначение отдельных компонентов. В процессе выполнения лабораторных работ он должен освоить методы синтеза полимерных связующих для композиционных материалов, изучить их свойства, проанализировать взаимосвязь свойств и строения, сделать вывод и рекомендации о путях возможного применения композиционных материалов, в том числе в мебельной и деревообрабатывающей промышленности.
По объемам производства древесные композиционные материалы (ДКМ) занимают в мировой экономике одно из первых мест. Они включают в себя большую группу разнообразных по свойствам и методам производства материалов. К концу ХХ века мировое производство ДКМ в объемных единицах уже превосходило производство сталей, пластмасс и алюминия.
При самостоятельной подготовке студент должен составить конспект лабораторной работы, изучить теоретический материал по рекомендуемой литературе для получения допуска к лабораторной работе и ответить на вопросы по порядку выполнения опытов. После выполнения экспериментальной части студент должен записать в тетрадь свои наблюдения и выводы. По каждой лабораторной работе студент должен сдать отчет по теоретической части на оценку.
5
Лабораторная работа № 1
Поликонденсация фенола с формальдегидом
Цель работы: ознакомиться с методом синтеза и свойствами фенолоформальдегидных смол различной структуры: новолаков, резолов, резитов.
Теоретическая часть
Поликонденсацией называется реакция образования высокомолекулярных соединений из низкомолекулярных (мономеров), содержащих не менее двух функциональных групп, способных реагировать друг с другом с выделением простых веществ (аммиака, воды, галоидоводорода и т. д.).
Поликонденсация фенола с формальдегидом в зависимости от условий (соотношение реагентов, типа катализаторов – кислых или щелочных) приводит к получению либо термопластичной смолы – новолака, либо термореактивной – резола, либо смолы сшитой структуры – резита. При избытке фенола (соотношение фенол : формальдегид = 1 : 0,8-0,9) в присутствии кислых катализаторов (соляная, серная, щавелевая кислоты) образуется линейная растворимая термопластичная смола с молекулярной массой 600-1200 у.е. – новолак.
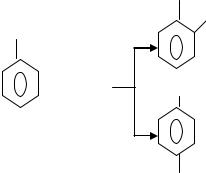
На первой стадии взаимодействия фенола с формальдегидом происходит образование монометилольных производных фенола (фенолоспиртов). Процесс идет по типу электрофильного замещения атомов водорода в орто- и параположениях по фенольному гидроксилу:
|
OH |
орто-метилолфенол |
ОН |
CH2OH |
|
|
|
|
+ CH2=О |
OH |
|
CH2OH пара-метилолфенол
Дальнейшая конденсация орто- и парафенолоспиртов с отщеплением воды дает линейный полимер.
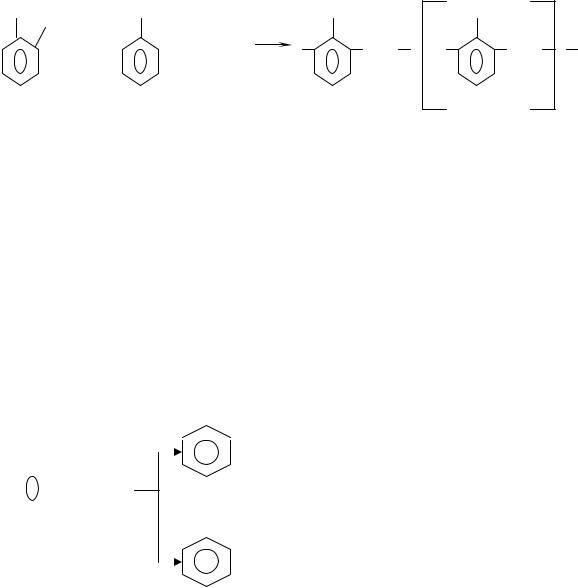
|
|
6 |
|
OH |
OH |
OH |
OH |
|
CH2OH |
|
|
|
/ |
CH2 |
CH2 |
|
+ n |
+ n CH2=О -nH2O |
|
новолак n
Новолачная фенолоформальдегидная смола является термопластичным полимером. Она плавится при нагревании и затвердевает при охлаждении без изменения химической структуры полимера. Легкорастворима в различных растворителях.
По-другому идет реакция в присутствии щелочных катализаторов. В щелочной среде (катализаторы – аммиак, едкий натр, едкий барий) при избытке формальдегида на начальной стадии образуются диметилольные производные фенола:
ОН
ОН |
НОСН2 |
СН2ОН 2,6-диметилолфенол |
 + 2СН2 =О
+ 2СН2 =О
ОН
СН2ОН
2,4 – диметилолфенол
СН2ОН
При нагревании диметилолфенолы конденсируются с выделением воды за счет гидроксида метилольных групп и подвижных атомов водорода бензольного кольца с образованием резола. При этом рост цепи может происходить линейно (с увеличением длины боковых ответвлений за счет свободных метилольных групп в n–положении по отношению к фенольному гидроксилу).
Полученная таким образом резольная смола является термореактивным полимером.
Термореактивные резольные смолы отверждаются, то есть превращаются в трехмерный пространственный полимер – резит при нагревании их до 80-2000 С. Реакция идет с выделением воды за счет свободных метилольных групп.
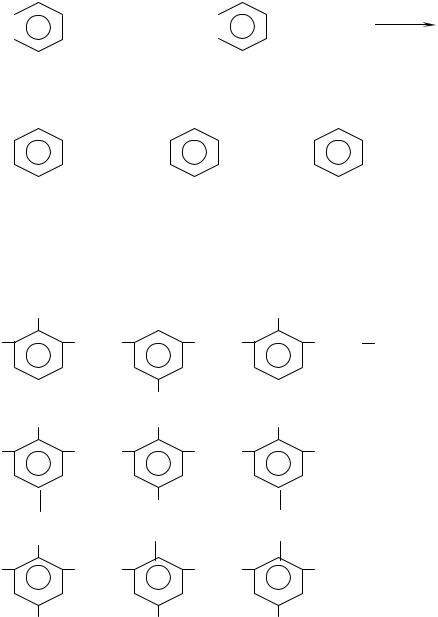
|
|
|
|
|
|
|
|
|
|
|
|
|
7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ОН |
|
|
|
ОН |
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
n НОСН2 |
|
|
|
СН2ОН |
|
|
|
|
|
СН2ОН |
|||||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
-n H2O |
|||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СН2ОН |
|
|
|
|
|
|
|
||||
|
|
|
|
ОН |
|
|
|
|
|
|
ОН |
|
|
|
|
|
ОН |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
…- |
|
|
|
|
|
|
СН2 |
|
|
|
|
|
|
|
|
СН2 |
|
|
|
|
|
|
|
|
СН2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
n |
|
|
|
|
|
|
|
m |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
СН2ОН |
|
СН2ОН |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
Резит может быть получен также из новолака при нагревании его в щелочной среде с дополнительной порцией формальдегида:
|
ОН |
|
ОН |
|
|
СН2 |
СН2 |
СН2 |
… + n СН2О → |
|
|
ОН |
|
|
|
ОН |
СН2 … |
ОН |
|
|
СН2 |
СН2 |
… |
|
|
|
|
||
|
|
ОН |
|
резит |
|
СН2 |
ОН |
СН2 |
|
… |
СН2 |
СН2 |
СН2 … |
|
|
ОН |
СН2 … |
ОН |
|
Отверженная смола не разлагается при нагревании до 200 0С и не набухает в растворителях, обладает хорошими диэлектрическими свойствами, механической прочностью и твердостью, стойкостью к воздействию воды, растворителей и разбавленных кислот.
Фенолоформальдегидные смолы (ФФС) находят широкое применение в производстве различных видов пластмасс (фенопласты). Большие количества резольных смол применяют для производства слоистых пластиков из ткани и бумаги. ФФС – основа спиртовых лаков, политур, применяемых при отделке изделий из дерева. Для них характерна высокая скорость отверждения.
8
Резольные ФФС используют для изготовления электроизоляционных и химически стойких лаков. Широкое применение нашли клеи на основе резольных фенолоформальдегидных смол в технологии деревообработки. Они используются для склеивания конструкций из древесины, металлов и пластмасс с древесиной, для изготовления фанеры. Клеи на основе резольных смол обладают высокими диэлектрическими показателями, водостойкостью, химической стойкостью.
Новолачные ФФС используются в качестве связующего при производстве пресспорошков, из которых изготавливаются различные строительные детали в виде арматуры, плит, труб.
Экспериментальная часть
Опыт 1.1. Получение новолачной ФФС
Помещают в пробирку 2,5 г фенола, 2 мл 40 % формалина, вносят кипятильный камешек. Нагревают смесь с холодильником до образования однородной жидкости и осторожно кипятят ее 1-2 мин. Затем вливают из пипетки или из другой пробирки 0,2 мл (несколько капель) концентрированной соляной кислоты (катализатор). При встряхивании горячая смесь начинает кипеть без подогревания через 1-2 мин. Жидкость мутнеет и внизу отслаивается тяжелое, непрозрачное масло. Если кипение прекращается, снова подогревают смесь на открытом огне 1-2 мин. Сливают верхний мутный слой и добавляют в пробирку примерно такой же объем воды, сливают воду, а смолу с остатками воды выливают на часовое стекло. Остывшую светло-сиреневую смолу снимают со стекла, высушивают в фильтровальной бумаге, снимают комочек и взвешивают. При хранении она постепенно твердеет и делается хрупкой тем быстрее, чем дольше продолжалось кипячение.
Опыт 1.2. Получение резольной ФФС
Помещают в пробирку 3 г фенола и 10 мл 40 % формалина. Смесь нагревают с холодильником на водяной бане до полного растворения фенола. Осторожно в слегка остывшую смесь вводят 3 мл концентрированного раствора аммиака (NH4OH – катализатор) и продолжают нагревание на горячей водяной бане (t = 80-90 0С) еще 10-15 мин. По окончании реакции происходит расслое-
9
ние смеси на верхний водный слой и нижний слой (прозрачная желтокоричневая смола). Резольная смола образуется несколько медленнее новолачной и в меньшем количестве.
Водный слой сливают, смолу вливают в пробирку и проводят опыт 1.3.
Примечание: необходимо тщательно проводить нагрев, так как при недостаточной продолжительности нагревания смола в опытах 1.1, 1.2 получается липкой и почти не твердеет.
Опыт 1.3. Резит из резольной смолы
Часть полученной в опыте 1.2 смолы осторожно нагревают на открытом огне в сухой пробирке, держа пробирку горизонтально. При этом удаляется избыток воды, а смола при продолжительном нагревании вспучивается и затвердевает. Образуется неплавкий и нерастворимый резит.
Вопросы и задания
1.Какие вещества используются в качестве мономеров при поликонденсации? Приведите пример.
2.Что такое функциональность мономера? Чему равна функциональность фенола, формальдегида?
3.Что такое олигомеры?
4.Напишите реакцию поликонденсации фенола с избытком формальдегида в кислой среде, выделите элементарное звено. Назовите полученную смолу.
5.К чему приводит нагревание новолачной ФФС в присутствии формальдегида? Напишите реакцию.
6.Чем отличаются термореактивные полимеры от термопластичных?
7.Напишите реакцию образования новолачной смолы из n-крезола и формальдегида.
8.Какой из трех изомерных диоксибензолов наиболее активен в реакции конденсации с формальдегидом?
9.Напишите реакцию резорцина с формальдегидом:
а) в кислой среде, б) в щелочной среде. 10.Каковы особенности реакции поликонденсации?
11.Как проявляется ступенчатый характер поликонденсации при реакции фенола с формальдегидом?

10
Лабораторная работа № 2
Поликонденсация карбамида с формальдегидом
Цель работы: ознакомиться с особенностями синтеза карбамидоформальдегидных (мочевиноформальдегидных) смол, влиянием различных факторов на процесс поликонденсации.
Теоретическая часть
Одной из важнейших реакции поликонденсации, нашедшей широкое техническое применение, является реакция карбамида (мочевины) с формальдегидом. Характер и скорость взаимодействия карбамида с формальдегидом в водном растворе зависят от условий реакции: катализатора, рН среды, температуры, соотношения исходных веществ, а также их концентрации в реагирующей среде. При этом влияние рН среды на молекулярную массу и структуру карбамидоформальдегидных смол (КФС) является определяющим. Рассмотрим влияние отдельных факторов на эту реакцию.
Влияние pH среды. В нейтральной или слабощелочной среде при температуре, не превышающей 40 оС, в зависимости от соотношения карбамида и формальдегида образуется преимущественно моноили диметилолкарбамид. При молярном соотношении карбамида и формальдегида 1:1 образуется преимущественно монометилолкарбамид.
NH2 |
|
NHCH2OH |
|
NHCH2OH |
|
|
|
NH4OH |
|
NH4OH |
|
CO + |
CH2O |
CO |
+ |
CH2O |
CO |
|
|
|
|
|
|
NH2 |
|
NH2 |
|
|
NHCH2OH |
мочевина |
формаль- |
монометилол- |
|
формаль- |
диметилол- |
(карбамид) |
дегид |
мочевина |
|
дегид |
мочевина |
Метилолкарбамиды растворяются в воде и образуют вязкие растворы. При нагревании этих растворов при 100о в слабощелочной среде в присутствии NH4OH происходит поликонденсация монометилолкарбамида с отщеплением воды и образованием макромолекул линейного строения (полиметиленкарбамиды):
