
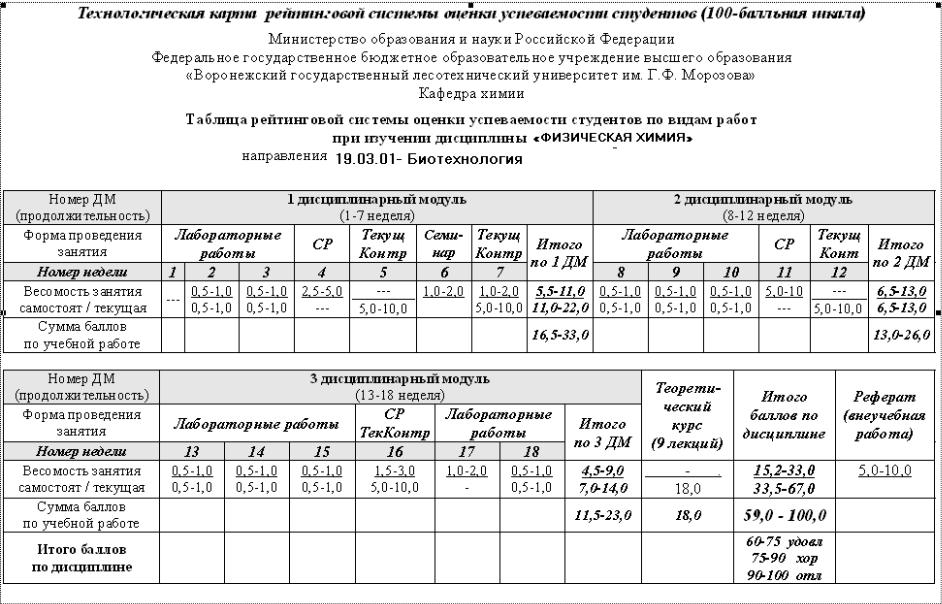
2376
.pdf
11
4.3.Перечень занятий, проводимых в интерактивной форме
Втаблице 3 представлены темы и краткое содержание лекций по соответствующим разделам курса химии.
|
|
Таблица 3 |
|
|
|
№ п/п |
Тема занятия |
Форма прове- |
|
|
дения |
|
|
|
1 |
2 |
3 |
|
|
|
1 |
Термодинамические свойства растворов электро- |
Публичная пре- |
|
литов (лекция) |
зентация |
2 |
Основные понятия и определения химической ки- |
Лекция «пресс- |
|
нетики (лекция) |
конференция» |
3 |
Каталитические реакции и их классификация (лек- |
Проблемная |
|
ция) |
лекция |
4 |
Электропроводность растворов (лабораторная ра- |
Проект |
|
бота) |
|
5 |
Термодинамическая теория ЭДС (лабораторное |
Проект |
|
занятие) |
|
6Химические превращения в электрохимических Коллоквиум системах (лабораторное занятие)
5.ЛЕКЦИОННЫЕ, ЛАБОРАТОРНЫЕ И ПРАКТИЧЕСКИЕ
ЗАНЯТИЯ
5.1. ЛЕКЦИИ
Таблица 4
№ |
№ раздела дисци- |
Наименование лекционных занятий |
п/п |
плины |
|
1 |
2 |
3 |
1 |
Раздел 1 |
Законы термодинамики |
2 |
Раздел 2 |
Термодинамические потенциалы |
3 |
Раздел 3 |
Химическое равновесие |
4 |
Раздел 4 |
Фазовое равновесие |
5 |
Раздел 5 |
Растворы. |
6 |
Раздел 6 |
Электрохимия. |
5.2 ЛАБОРАТОРНЫЕ РАБОТЫ
В таблице 5 приводится перечень наименований лабораторных занятий с указанием номера раздела, к которому относится данное лабораторное занятие.
|
|
12 |
|
|
|
Таблица 5 |
|
|
|
|
|
№ |
№ раздела дисци- |
Наименование лабораторных работ |
|
п/п |
плины |
|
|
1 |
2 |
3 |
|
1 |
Раздел 1 |
Техника безопасности и правила работы в химиче- |
|
|
|
ской лаборатории. |
|
|
|
Лабораторная работа № 1. Агрегатное состояние ве- |
|
|
|
ществ. Определение плотности и молярного объема. |
|
|
|
Построение изотерм по опытным данным |
|
|
|
Лабораторная работа № 2. Определение вязкости |
|
|
|
растворов |
|
|
|
|
|
2 |
Раздел 3 |
Лабораторная работа № 3. Изучение влияния темпе- |
|
|
|
ратуры на константу диссоциации слабых электроли- |
|
|
|
тов |
|
|
|
|
|
3 |
Раздел 4 |
Лабораторная работа № 4 Определение констант и |
|
|
|
термодинамических функций многоатомных молекул |
|
|
|
по данным инфракрасных спектров поглощения. |
|
4 |
Разделы 1,3,4 |
Контроль № 1: законы термодинамики, химическое и |
|
|
|
фазовое равновесия и контроль самостоятельной ра- |
|
|
|
боты. |
|
5 |
Раздел 5 |
Лабораторная работа № 5. Электропроводность рас- |
|
|
|
творов электролитов |
|
6 |
Раздел 6 |
Лабораторная работа № 6. Гальванические элементы. |
|
|
|
направление окислительно-восстановительных реак- |
|
|
|
ций. |
|
|
|
Контроль № 2 : растворы, электрохимия и контроль |
|
|
|
самостоятельной работы. |
|
5.3 Практические занятия |
|||
|
|
|
|
№ |
№ раздела дисци- |
Наименование лабораторных работ |
|
п/п |
плины |
|
|
1 |
2 |
3 |
|
1 |
Раздел 1 |
Температурная зависимость теплового эффекта. |
|
|
|
Уравнение Кирхгофа в дифференциальной и инте- |
|
|
|
гральной формах |
|
|
|
|
|
|
|
13 |
|
|
|
2 |
Раздел 2 |
Энергия Гельмгольца и энергия Гиббса как критерии |
|
|
направленности процесса и равновесия в закрытых |
|
|
системах |
|
|
|
3 |
Раздел 3 |
Уравнение Клапейрона. Температурная зависимость |
|
|
давления насыщенного пара. |
4 |
Разделы 4 |
Правило фаз Гиббса. р- V-Т диаграмма фазовых рав- |
|
|
новесий и ее проекции. Фазовые переходы первого и |
|
|
второго рода. |
5 |
Раздел 5 |
Использование законов Рауля и Генри для термоди- |
|
|
намического описания свойств предельно разбавлен- |
|
|
ных растворов. |
|
|
Уравнение Аррениуса. Энергия активации. |
6 |
Раздел 6 |
Современные типы электрохимических источников |
|
|
тока и топливных элементов. Электрохимические |
|
|
сенсоры |
Перечень вопросов к текущему контролю № 1
1.Термодинамические системы и термодинамические параметры. Функции состояния и процесса. Внутренняя энергия, энтальпия, теплота и работа.
2.Формулировки первого начала термодинамики. Математическое выражение первого начала термодинамики.
3.Тепловой эффект. Закон Гесса. Связь тепловых эффектов при постоянном объеме и при постоянном давлении.
4.Применение следствий из закона Гесса к вычислению тепловых эффектов химических реакций и физико-химических процессов.
5.Зависимость теплового эффекта химической реакции от температуры, уравнение Кирхгофа, его интегрирование.
6.Термодинамически обратимые и необратимые процессы. Самопроизвольные и несамопроизвольные процессы. Формулировки второго начала термодинамики.
7.Математическое выражение второго закона термодинамики. Энтропия как критерий направления самопроизвольного процесса в изолированных системах.
8.Третий закон (начало) термодинамики (постулат Планка). Понятие о термодинамической вероятности состояния системы. Уравнение Больцмана - Планка. Статистическая интерпретация второго начала термодинамики.
9.Вычисление абсолютной энтропии вещества. Расчет изменения энтропии в ходе химической реакции (при 298К).
14
10.Энергия Гельмгольца и энергия Гиббса как критерии направления и предела протекания процессов.
11.Зависимость энергии Гельмгольца от параметров состояния. Уравнение Гиббса-Гельмгольца (вывод и анализ).
12.Зависимость энергии Гиббса от давления, стандартная энергия Гиббса. 13.Зависимость энергии Гиббса от температуры. Уравнение Гиббса-
Гельмгольца (вывод и анализ).
14.GРасчет 0 и КР химических реакций при 298 К.
15.GВычисление 0 и констант равновесия химических реакций методом Темкина-Шварцмана.
16.GВычисление 0 и констант равновесия химических реакций с помощью приведенной энергии Гиббса.
17.Системы с переменным составом. Химический потенциал. Зависимость химического потенциала от давления и температуры. Условия равновесия и самопроизвольного протекания процесса, выраженные через химический потенциал.
18.Реальные газы. Сжимаемость. Уравнения состояния реальных газов: в вириальной форме и Ван-дер-Ваальса. Приведенные параметры. Принцип соответственных состояний.
19.Реальные газы. Фугитивность (летучесть), коэффициент фугитивности (летучести).
20.Закон действующих масс. Способы выражения константы химического равновесия. Связь между эмпирическими константами равновесия для гомогенных реакций.
21.Константа равновесия химической реакции КР, еѐ выражение через степень превращения и равновесное давление в реакционной системе.
22.Уравнение изотермы химической реакции (вывод и анализ). Химическое сродство.
23.Константы химического равновесия. Влияние общего давления и добавок индифферентных газов на сдвиг равновесия.
24.Особенности химического равновесия в гетерогенных системах. Примеры выражения константы химического равновесия для гетерогенных реакций.
25.Влияние температуры на константу равновесия. Уравнение изобары и изохоры химической реакции (изобары и изохоры Вант-Гоффа).
26.Фаза, составляющее систему вещество, компонент, число степеней свободы. Правило фаз Гиббса.
27.Диаграмма фазовых равновесий однокомпонентной системы в координатах Р=f(Т). Тройная и критическая точки.
28.Фазовые переходы первого рода, энантиотропные и монотропные фазовые переходы. Понятие о фазовых переходах второго рода.
29.Фазовые диаграммы воды и оксида углерода (в области умеренных давлений), применение к ним правила фаз Гиббса.
15
Перечень вопросов к текущему контролю № 2
1.Зависимость давления насыщенного пара от температуры. Вывод и анализ уравнения Клапейрона-Клаузиуса.
2.Уравнение Клапейрона-Клаузиуса, его интегрирование в предположени-
ях: 1) f(T),2) Н=const
3.Применение уравнения Клапейрона-Клаузиуса для расчета изменения термодинамических функций в фазовых переходах.
4.Растворы, классификации растворов, физическая и химическая теории растворов.
5.Идеальные (совершенные), регулярные и атермальные растворы.
6.Термодинамические свойства идеальных растворов. Химический потенциал компонента идеального раствора.
7.Равновесие "идеальный раствор-пар". Закон Рауля, его графическая интерпретация.
8.Неидеальные растворы. Положительные и отрицательные отклонения от закона Рауля.
9.Предельно разбавленные растворы. Законы Рауля и Генри для термодинамического описания свойств предельно разбавленных растворов.
10.Т Понижение температуры замерзания растворов нелетучих веществ (вывод выражения для зам).
11.Т Повышение температуры кипения растворов нелетучих веществ (вы-
вод выражения для кип).
12.Коллигативные свойства. Эбуллиоскопия. Эбуллиоскопическое определение коэффициента активности, молярной массы и степени диссоциации растворенного вещества.
13.Коллигативные свойства. Криоскопия. Криоскопическое определение коэффициента активности, молярной массы и степени диссоциации растворенного вещества.
14.Осмос, уравнение Вант-Гоффа для осмотического давления. Определение молярной массы растворенного вещества. Обратный осмос.
15.Парциальные молярные величины. Уравнения Гиббса-Дюгема. 16.Парциальные молярные величины. Методы определения парциальных
молярных величин.
17.Неидеальные растворы. Активность и коэффициент активности. Стандартные состояния компонентов раствора.
18.Растворимость газов в жидкостях, закон (уравнение) Генри. Влияние давления, температуры, природы газа и природы растворителя. Совместная растворимость нескольких газов. Влияние электролитов на растворимость газов в жидкостях.
19.Растворимость твердых тел в жидкостях. Дифференциальное уравнение для растворимости. Зависимость растворимости твердых тел от температуры, уравнение Шредера, его вывод и анализ.
16
20.Равновесие “жидкость-пар” в двухкомпонентных системах. Диаграммы “давление-состав”, “температура-состав”, “состав пара-состав жидкости”. Первый закон Гиббса-Коновалова.
21. х". Правило рычага. Изменение вида диаграмм в зависимости от типа отклонений от закона Рауля. х" и "Т Диаграммы "Р
22.Азеотропия, второй закон Гиббса-Коновалова.
23.Анализ диаграммы кипения бинарных смесей с экстремумом. Азеотропные смеси и возможности их разделения на чистые компоненты.
24.Физико-химические основы перегонки и ректификации.
25.Равновесие “жидкость-пар” для практически нерастворимых друг в друге жидкостей. Температура кипения таких систем. Перегонка с водяным паром.
26.Двухкомпонентные системы с ограниченной растворимостью в жидком состоянии с верхней критической температурой растворения. Определение состава критической точки. Правило Алексеева.
27.Термический анализ. Метод построения диаграммы плавкости с простой эвтектикой по кривым охлаждения. Определения состава эвтектики по треугольнику Таммана.
28.Изоморфизм. Твердые растворы. Диаграммы плавкости систем с неограниченной растворимостью в твердой фазе.
29.Диаграммы плавкости неизоморфно-кристаллизующихся систем (с простой эвтектикой).
30.Диаграммы плавкости систем, образующих конгруэнтно плавящееся химическое соединение.
31.Диаграммы плавкости систем, образующих инконгруэнтно плавящееся химическое соединение.
32.Диаграммы плавкости неизоморфно-кристаллизующихся веществ с ограниченной растворимостью компонентов в твердом состоянии.
33.Представление составов и свойств трехкомпонентной системы на концентрационном треугольнике. Методы Гиббса и Розебома.
34.Взаимная растворимость трех жидкостей (диаграммы состояния). 35.Фазовая диаграмма состояния для трех жидких компонентов, две из кото-
рых ограниченно растворимы друг в друге. Правило Тарасенкова. 36.Распределение растворенного вещества между двумя несмешивающими-
ся растворителями. Коэффициент распределения. Закон распределения. Экстракция и еѐ практическое использование.
17
7. Методические рекомендации по организации самостоятельного изучения дисциплины.
Самостоятельная работа студентов
Лекции аудиторно читаются не в полном объеме дисциплины, поэтому на самостоятельное изучение студентам выносятся разделы, которые сообщаются студентам преподавателем и отображаются в рабочем плане.
Организация учебного процесса предполагает достижение основной цели высшего образования – повышения качества подготовки специалистов. Организация самостоятельной работы студентов является составной частью управления качеством обучения. Роль организации самостоятельной работы возрастает в виду изменения форм и методов обучения, которые трансформируются и за счет внедрения информационных технологий.
Итак, самостоятельная работа студентов на современном этапе развития высшей школы является одной из основных форм обучения студентов.
По дисциплине “Физическая химия” имеются следующие виды самостоятельной работы:
составление конспекта по выполняемой лабораторной работе с использованием методических указаний по лабораторному практикуму дисциплины “Физическая химия”
освоение теоретического материала по теме лабораторной работы по конспектам лекций и учебнику;
освоение теоретического материала по темам дисциплины “Физическая химия”, вынесенным для самостоятельного изучения, с использованием учебной литературы и конспектов лекций для самостоятельной работы студентов;
отчет по самостоятельной работе – сдача допуска к лабораторным работам;
отчет по самостоятельной работе – решение и отчет по задачам и по индивидуальным заданиям по дисциплине “Физическая химия”
отчет по самостоятельной работе – текущие контроли по основным разделам курса и отчетов по лабораторным работам, сдача коллоквиума;
освоение теоретического материала для проведения лабораторной работы по УИРС.
Контроль за самостоятельной работой по данной дисциплине осуществляется поэтапно:
1 этап – включение отдельных вопросов, изучаемых студентами самостоятельно, в традиционные контрольные работы;
2 этап – организация письменного итогового контроля по всем разделам, выносимым на самостоятельную работу, проводимую по группам или на всем потоке.

18
Оценка по самостоятельной работе суммируется с экзаменационной оценкой и выводится средний балл.
В табл. 7 приведены темы и вопросы, выносимые для самостоятельного изучения дисциплины «Физическая химия».
|
|
Таблица 6 |
|
|
|
№ п/п |
Тема самостоятельно работы |
Номер источника |
|
|
|
1 |
2 |
3 |
|
|
|
1 |
Расчет тепловых эффектов химических реакций. |
осн. с.206-210 |
|
|
|
2 |
Теплоемкость, расчеты теплоты |
осн. с 184-189 |
|
|
|
3 |
Расчет зависимости тепловых эффектов от тем- |
доп. с 22-36 |
|
пературы по закону Кирхгофа. |
|
4 |
Расчет изменения энтропии в различных про- |
осн. с 170-183 |
|
цессах |
|
5 |
Расчет термодинамических потенциалов в раз- |
осн с 216-238, доп с 25- |
|
личных процессах |
34, |
|
|
|
|
|
|
6 |
Расчет константы равновесия и степени диссо- |
осн с. 309-315 |
|
циации |
|
7 |
Расчет равновесного состава смеси. |
осн с. 229-230 |
|
|
|
8 |
Зависимость константы равновесия от темпера- |
осн с. 233234 |
|
туры |
|
9 |
Расчет фазового равновесия в однокомпонент- |
осн с. 239-245 |
|
ных системах |
|
10 |
Расчет парциальных молярных величин |
осн с. 239-245 |
|
|
|
11 |
Расчет состава растворов |
доп с. 130-146 |
|
|
|
12 |
Расчет свойств предельно-разбавленных раство- |
осн с. 249-263 |
|
ров. |
|
13 |
Вычисление электропроводности растворов |
доп с. 155-164 |
|
электролитов. |
|
14 |
Расчет процесса электролиза с использованием |
доп с 164-173 |
|
законов Фарадея. |
|
20
8. Перечень вопросов для итогового контроля - экзамена
ПРИМЕРНЫЕ ВОПРОСЫ К ЭКЗАМЕНУ ПО ДИСЦИПЛИНЕ «ФИЗИЧЕСКАЯ ХИМИЯ»
1. Введение. Предмет и задачи физической химии. Основные понятия и определения.
2.Разделы физической химии. Взаимосвязь физических и химических явлений.
3.Закон сохранения и формы передачи энергии. Теплота и работа.
4.Различные виды процессов и их работа.
5.I Закон термодинамики. Понятие о внутренней энергии.
6.Закон Гесса. Следствия из закона Гесса.
7.Истинная и средняя теплоемкости тела. Зависимость срот температуры.
8.Зависимость теплового эффекта от температуры. Уравнение Кирхгоффа.
9.Термодинамические функции. Их взаимосвязь.
10. II Закон термодинамики. Понятие об энтропии.
11.Критерии самопроизвольности направления процесса.
12.III Закон термодинамики.
13.Правило фаз Гиббса. Диаграмма состояния воды.
14.Двухкомпонентные системы. Виды диаграмм состояния.
15.Кривые охлаждения. Построение диаграмм состояния. Их анализ.
16.I закон Коновалова. Перегонка, ректификация.
17.II закон Коновалова. Азеотропные растворы.
18.Трехкомпонентные системы. Методы определения состава трехкомпонентных систем.
19.Объемная диаграмма состояния трехкомпонентных систем. Изотермическое сечение.
20.Закон распределения. Экстракция.
21.Химическое равновесие. Уравнение изобары и изохоры Вант - Гоффа.
22.Принцип динамического равновесия Ле - Шателье. Влияние различных факторов на положение равновесия. 23. Основной постулат химической кинетики. Физический смысл константы скорости химической реакции.
24.Кинетическая классификация химических реакций.
25.Простые и сложные реакции.
26.Зависимость скорости химической реакции от температуры. Уравнение Вант - Гоффа.
