
2320
.pdf
|
|
Практические занятия |
|
|
|
Таблица 6 |
|
|
|
|
|
№ |
Раздел |
Наименование практического занятия |
|
|
|
|
|
1 |
2, 3 |
Знакомство с модульно-рейтинговой системой оценки знаний студен- |
|
|
|
тов. Номенклатура и изомерия углеводородов |
|
2 |
4, 6 |
Номенклатура и изомерия кислород- и азотсодержащих органических |
|
|
|
соединений |
|
3 |
2, 3 |
Способы получения и химические свойства углеводородов |
|
|
|
|
|
4 |
1, 2, 3 |
Отчет по самостоятельной работе (сдача индивидуальных заданий) |
|
|
|
Текущий контроль № 1. «Углеводороды» |
|
5 |
4 |
Способы получения и химические свойства спиртов, фенолов, альдеги- |
|
|
|
дов и кетонов |
|
6 |
4, 6 |
Способы получения и химические свойства карбоновых кислот, аминов, |
|
|
|
аминокислот |
|
7 |
4, 6 |
Отчет по самостоятельной работе (сдача индивидуальных заданий) |
|
|
|
Текущий контроль № 2. «Кислород- и азотсодержащие органические |
|
|
|
соединения» |
|
8 |
5, 7, 8 |
Семинар «Углеводы. Компоненты древесины. Высокомолекулярные со- |
|
|
|
единения» |
|
9 |
5, 7, 8 |
Текущий контроль № 3. «Углеводы. Высокомолекулярные соединения» |
|
|
|
|
|
6. ВОПРОСЫ К ТЕКУЩЕМУ КОНТРОЛЮ
I контроль
Вопросы к темам «Основные понятия и законы химии», «Химическая термодинамика», «Химическая кинетика», «Строение атома», «Химическая связь»
1.Основные понятия и законы химии.
2.Понятие о нанотехнологиях и наноматериалах.
3.Химическая термодинамика. Термодинамические системы, их параметры и свойства.
4.Первый закон термодинамики. Внутренняя энергия.
5.Термохимия. Тепловые эффекты реакций. Закон Гесса.
6.Энтальпия. Стандартная энтальпия образования вещества. Следствие из закона Гесса.
7.Закон Лавуазье-Лапласа.
8.Понятие об энтропии. Второй закон термодинамики. Изменение энтропии в химических процессах и фазовых переходах.
9.Энергия Гиббса и ее изменение в химических процессах. Критерии направления самопроизвольного протекания химических процессов.
10.Определение скорости химической реакции. Скорость реакций в гомогенных и гетерогенных системах.
11.Зависимость скорости химической реакции от природы реагирующих веществ.
12.Зависимость скорости химических реакций от концентрации реагирующих веществ. Закон действия масс.
13.Зависимость скорости реакции от температуры. Правило Вант-Гоффа.
14.Зависимость скорости реакции от давления и от степени дисперсности.
15.Катализаторы, каталитические системы. Гомогенный и гетерогенный катализ.
16.Понятия об адсорбции, десорбции, абсорбции, хемосорбции.
17.Обратимые и необратимые реакции. Условия необратимости реакций.
18.Химическое равновесие, условия его смещения. Принцип ЛеШателье.
19.Основные сведения о строении атома.
20.Состав атомных ядер. Изотопы. Изобары.
21.Исторические этапы создания теории строения атома. Двойственная природа электрона. Уравнение де Бройля.
22.Характеристика энергетического состояния электрона квантовыми числами. Главное, побочное, магнитное, спиновое квантовые числа.
23.Распределение электронов по энергетическим уровням в соответствии с принципом Паули, правилами Клечковского и Гунда.
24.Радиусы атомов и ионов. Энергия ионизации, энергия сродства к электрону, электроотрицательность.
25.Периодический закон Д.И. Менделеева. Положение элементов в периодической системе. Периоды. Группы. Подгруппы.
26.Периодическая система в свете строения атома. s-, p-, d-, f-элементы. Проскок электронов.
27.Условие образования химической связи. Типы химической связи. Химическая связь и валентность.
28.Количественные характеристики химической связи: длина связи, энергия связи, валентные углы.
29.Ковалентная связь. Метод валентных связей. Свойства ковалентной связи: насыщаемость, направленность, поляризуемость связи. Полярные и неполярные молекулы. Донорно-акцепторный механизм образования связи.
30. Гибридизация атомных орбиталей.
31. Ионная связь и ее свойства. Ионные кристаллические решетки.
32.Металлическая связь и ее особенности. Металлические решетки.
33.Водородная связь, ее свойства. Комплементарность.
II контроль
Вопросы к темам «Растворы», «Окислительно-восстановительные процессы», «Электрохимические системы»
1.Понятия «раствор» и «растворитель». Классификация растворов. Термодинамика растворения.
2.Способы выражения концентрации растворов: массовая доля и мольная доля, молярная, нормальная (эквивалентная) и моляльная концентрации.
3.Тепловые эффекты при растворении. Растворимость веществ.
4.Диффузия и осмос. Осмотическое давление растворов. Закон Вант-Гоффа.
5.Давление пара растворов. Первый закон Рауля.
6.Понижение температуры замерзания и повышение температуры кипения растворов. Второй закон Рауля.
7.Растворы электролитов. Изотонический коэффициент.
8.Электролитическая диссоциация. Степень диссоциации, константа диссоциации. Сильные и слабые электролиты.
9.Ионные уравнения реакций.
10.Произведение растворимости.
11.Ионное произведение воды. Водородный показатель рН.
12.Индикаторы. Потенциометрический способ определения рН растворов.
13.Гидролиз солей. Типичные случаи гидролиза солей.
14.Химия воды. Жесткость воды. Методы водоподготовки.
15.Окислительно-восстановительные процессы. Степень окисления.
16.Окислители и восстановители. Окисление и восстановление.
17.Типы окислительно-восстановительных реакций.
18.Методы составления уравнений окислительно-восстановительных реакций.
19.Электрохимические процессы: определение, классификация.
20. Электрод. Стандартный электродный потенциал. Уравнение Нернста. 21. Гальванические элементы. ЭДС и ее измерение.
22. Химические источники тока. Аккумуляторы.
23. Электролиз. Определение, практическое применение электролиза. 24. Катодные и анодные процессы. Законы Фарадея.
25.Понятие о коррозии металлов. Основные виды коррозии металлов. Химическая и электрохимическая коррозия. Механизм коррозии.
26.Методы защиты металлов от коррозии.
7. ПРИМЕРНЫЕ ВАРИАНТЫ ЗАДАНИЙ К ТЕКУЩЕМУ КОНТРОЛЮ
ХИМИЯ, ч. 1
Текущий контроль № 1
1.Энтропия. Второй закон термодинамики.
2.Зависимость скорости реакции от температуры (правило Вант-Гоффа).
3.В системе H2O (г) + СО (г) ↔ Н2 (г) + СО2 (г) , ∆Н<О установилось химическое равновесие. Какими факторами можно сместить равновесие в сторону образования водорода?
4.Составьте электронную формулу химического элемента с порядковым номером 33. Укажите его валентность в стационарном и возбужденном состоянии
5.Какой тип связи в следующих веществах: N2, H2O, (Zn)n, NaCl, (HF)n ?
Вопрос по самостоятельной работе
6.Закон объемных отношений. Написать формулу для определения эквивалента основания.
Текущий контроль № 2
1.Первый закон Рауля.
2.Напишите уравнение гидролиза соли Na2CO3 в молекулярном и ионном виде, укажите реакцию среды.
3.Методом электронного баланса расставьте коэффициенты в уравнении реак-
ции: PbO2 + Mn(NO3)2 + HNO3 = Pb(NO3)2 + HMnO4 + H2O.
Укажите окислитель и восстановитель.
4.Составьте схему электролиза раствора KNO3. Где применяется электролиз?
5.Какой металл может служить катодной защитой для железа? Какие преимущества и недостатки у этого метода защиты?
Вопрос по самостоятельной работе
6.Жесткость воды. Способы устранения временной жесткости воды.

ХИМИЯ, ч. 2 Текущий контроль № 1
1. Назовите вещества по международной номенклатуре:
а) СН2 - СН3 |
б) |
СН3 |
в) |
|
СН3 - С - СН2 - СН2 - СН3 ; СН3 - СН = СН - С - СН3 ; СН3 – СН2 – С С – СН – СН3
СН3- СН - СН3 СН3 СН3
2. Получение каких углеводородов можно ожидать при взаимодействии:
|
|
–– |
|
|
|
СН3 - СН2I + 2Na + CH3 - CH - CH3 |
|
Назовите полученные соединения |
I |
|
по международной номенклатуре. |
|
||
|
|
3. Напишите реакцию присоединения брома к пентадиену -1,3. 4. Закончите реакцию СН3 - С С - СН3 + Н2О → … 5. Сколько изомеров имеет углеводород С5Н10 ?
Текущий контроль № 2
1.Напишите структурные формулы всех изомерных спиртов состава С4Н9ОН. Назовите их по международной номенклатуре. Отметьте, какие из них являются первичными, вторичными и третичными.
2.Какие продукты получаются при каталитическом гидрировании:
а) пентанона-2; б) 2-метил бутаналя ? Назовите полученные вещества.
3.Напишите уравнения реакций внутримолекулярной и межмолекулярной дегидратации пропанола -2.
4.Напишите уравнение реакции между фенолятом натрия и хлорэаном.
5.Осуществите последовательно следующие превращения, назовите вещества.
- НОН |
|
+ НОН |
[О] |
СН3 – СН – СН2 – СН2 – ОН |
A |
B |
C |
CH3 |
|
|
|
8.ВОПРОСЫ К ИТОГОВОМУ КОНТРОЛЮ
8.1Вопросы к зачету, Химия, ч. 1
1.Основные понятия химии. Основные законы химии.
2.Термохимия. Экзо- и эндотермические реакции. Термохимические уравнения.
3.Законы термохимии: закон Гесса и Лавуазье-Лапласа.
4.Первый закон термодинамики.
5.Внутренняя энергия и энтальпия.
6.Стандартная энтальпия образования вещества. Закон Гесса. Следствие из закона Гесса.
7.Понятие об энтропии. Второй закон термодинамики. Изменение энтропии в химических реакциях.
8.Понятие об изобарно-изотермическом потенциале (энергия Гиббса).
9.Влияние энтальпийного и энтропийного факторов на направление реакции.
10.Стандартная энергия Гиббса образования. Условие самопроизвольного протекания химического процесса.
11.Скорость химических реакций и методы ее регулирования. Гомогенные и гетерогенные системы.
12.Зависимость скорости химических реакций от концентрации реагирующих веществ. Закон действия масс.
13.Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Понятие об энергии активации.
14.Катализаторы и каталитические системы. Гомогенный и гетерогенный катализ. Понятия об адсорбции, десорбции, абсорбции, хемосорбции.
15.Обратимые и необратимые реакции. Условие химического равновесия.
16.Смещение химического равновесия. Принцип Ле Шателье.
17.Фазовое равновесие. Правило фаз.
18.Основные сведения о строении атома. Состав атомных ядер. Изотопы. Изобары.
19.Квантово-механическая модель атома. Двойственная природа электрона. Уравнение де Бройля.
20.Характеристика состояния электрона в атоме квантовыми числами. Главное, побочное, магнитное, спиновое квантовые числа.
21.Правила и порядок заполнения атомных орбиталей. Принцип Паули, правила Клечковского и Гунда.
22.Связь строения атома с периодической системой элементов. Свойства атомов и ионов.
23.Периодический закон и периодическая система Д.И. Менделеева.
24.Условие и механизм образования химической связи. Химическая связь и валентность.
25.Количественные характеристики химической связи: длина связи, энергия связи, валентные углы.
26.Типы химической связи: ковалентная, ионная, металлическая. Их свойства. Водородная связь и межмолекулярное взаимодействие. Комплементарность.
27.Классификация дисперсных систем. Истинные растворы. Растворимость и растворение веществ. Термодинамика растворения.
28.Способы выражения концентрации растворов.
29.Диффузия и осмос. Осмотическое давление растворов. Закон Вант-Гоффа. 30.Давление пара растворов. Первый закон Рауля.
31.Понижение температуры замерзания и повышение температуры кипения растворов. Второй закон Рауля.
32.Растворы электролитов. Изотонический коэффициент. 33.Электролитическая диссоциация. Степень диссоциации. Константа диссо-
циации. Сильные и слабые электролиты. Ионные уравнения реакций. 34.Произведение растворимости.
35.Ионное произведение воды. Водородный показатель рН. Индикаторы. 36.Гидролиз солей. Типичные случаи гидролиза солей.
37.Коллоидные растворы.
38.Окислительно-восстановительные процессы. Степень окисления. Окислители и восстановители. Окисление и восстановление.
39.Типы окислительно-восстановительных реакций. Эквивалент окислителя и восстановителя.
40.Определение и классификация электрохимических процессов. Понятие об электродных потенциалах.
41.Стандартный электродный потенциал. Потенциалы металлических электродов. Уравнение Нернста.
42.Гальванические элементы. ЭДС и ее измерение.
43.Понятие электролиза. Последовательность катодных и анодных процессов. 44.Электролиз с нерастворимым и растворимым анодами.
45.Законы Фарадея. Практическое применение электролиза.
46.Коррозия металлов. Виды коррозии. Методы защиты металлов от коррозии.
8.2Вопросы к экзамену, Химия, ч. 2
1.Предмет органической химии. Органическая химия и проблемы экологии
и охраны окружающей среды.
2.Теория строения органических соединений А.М.Бутлерова. Понятие об изомерии и гомологии органических соединений.

3.Классификация органических соединений по рядам и классам.
4.Классификация органических реакций.
5.Алканы: гомологический ряд, изомерия, номенклатура. Строение алканов,
sp3-гибридизация электронов. -связь и ее свойства, следствия sp3- гибридизации. Природные источники алканов. Способы получения алканов. Химические свойства алканов.
6.Алкены: гомология, изомерия, номенклатура. sp2-гибридизация на примере этилена. Определение -связи и ее свойства. Следствия sp2-гибридизации. Способы получения. Химические свойства алкенов. Правило Марковникова.
7.Алкины. Гомологический ряд, номенклатура, изомерия. Строение алкинов. sp-гибридизация, следствия sp-гибридизации. Способы получения алкинов. Химические свойства алкинов.
8.Алкадиены: номенклатура, изомерия. Методы получения важнейших диенов: дивинила, изопрена. Особенности строения и химических свойств диеновых углеводородов с сопряженными двойными связями. Полимеризация.
9.Алициклические углеводороды. Номенклатура, изомерия. Теория устойчивости циклов. Способы получения и химические свойства циклов.
10.Ароматические углеводороды, понятие об ароматичности. Бензол, изомерия и номенклатура в ряду бензола. Строение бензола. Получение ароматических углеводородов. Химические свойства.
11.Правила замещения в ароматическом ряду. Ориентанты I и II рода. Согласованная и несогласованная ориентация.
12.Спирты и фенолы. Одноатомные спирты и фенолы. Изомерия и номенклатура спиртов. Способы получения спиртов. Химические свойства спиртов.
13.Многоатомные спирты: этиленгликоль, глицерин. Химические свойства многоатомных спиртов.
14.Карбонильные соединения. Изомерия, номенклатура, способы получения альдегидов и кетонов. Химические свойства альдегидов и кетонов.
15.Карбоновые кислоты. Предельные одноосновные кислоты: строение, изомерия, номенклатура, способы получения, химические свойства.
16.Производные карбоновых кислот: соли, галогенангидриды, амиды, нитрилы, сложные эфиры. Высшие жирные кислоты, жиры, масла.
17.Углеводы. Распространенность в природе. Химия фотосинтеза. Классификация и номенклатура углеводов.
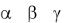
18.Моносахариды: классификация, изомерия, стереоизомерия и таутомерия. Химические свойства моноз. Глюкоза, фруктоза, рибоза.
19.Дисахариды: восстанавливающие и невосстанавливающие, их строение и свойства. Мальтоза, целлобиоза, сахароза.
20.Полисахариды. Крахмал, строение амилозы, амилопектина. Синтез и свойства крахмала.
21.Целлюлоза. Общее представление. Строение и свойства.
22.Амины жирного и ароматического рядов: номенклатура, изомерия, способы получения, химические свойства.
23.Аминокислоты, классификация и номенклатура. Строение, синтез амино-
кислот. Химические свойства. Особые свойства -, -, -аминокислот.
24. Белки. Общая характеристика, состав, распространенность в природе. Структура белковых молекул. Важнейшие свойства белков.
9. МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ОРГАНИЗАЦИИ ИЗУЧЕНИЯ ДИСЦИПЛИНЫ
9.1 Самостоятельная работа студентов
При изучении дисциплины «Химия» особое внимание уделяется организации самостоятельной работы студентов и контролю самостоятельной работы, как одного из основных видов обучения студентов.
Самостоятельная работа студентов и контроль ее выполнения проводится по следующим направлениям:
 составление конспекта по выполняемой лабораторной работе с использованием методических указаний по лабораторному практикуму дисциплины “Химия”;
составление конспекта по выполняемой лабораторной работе с использованием методических указаний по лабораторному практикуму дисциплины “Химия”;
 освоение теоретического материала по теме лабораторной работы по конспектам лекций и учебнику;
освоение теоретического материала по теме лабораторной работы по конспектам лекций и учебнику;
 освоение теоретического материала по темам дисциплины, вынесенным для самостоятельного изучения, с использованием учебной литературы и конспектов лекций для самостоятельной работы студентов;
освоение теоретического материала по темам дисциплины, вынесенным для самостоятельного изучения, с использованием учебной литературы и конспектов лекций для самостоятельной работы студентов;
 отчет по самостоятельной работе – сдача допуска к лабораторным работам;
отчет по самостоятельной работе – сдача допуска к лабораторным работам;
 отчет по самостоятельной работе – решение и отчет по задачам;
отчет по самостоятельной работе – решение и отчет по задачам;
 отчет по самостоятельной работе – написание контрольных работ по основным разделам курса и отчетов по лабораторным работам;
отчет по самостоятельной работе – написание контрольных работ по основным разделам курса и отчетов по лабораторным работам;  написание рефератов по отдельным темам дисциплины.
написание рефератов по отдельным темам дисциплины.
Одной из эффективных форм организации процесса обучения и контроля самостоятельной работы студентов является компьютеризация учебного процесса, которая проводится по следующим направлениям:
 для сдачи допуска к лабораторным работам и проведения расчетов по экспериментальным данным в лабораторном практикуме;
для сдачи допуска к лабораторным работам и проведения расчетов по экспериментальным данным в лабораторном практикуме;
 для сдачи отчета по лабораторным работам;
для сдачи отчета по лабораторным работам;
 для контроля освоения теоретического материала по отдельным разделам дисциплины.
для контроля освоения теоретического материала по отдельным разделам дисциплины.
Поскольку аудиторно лекции читаются не в полном объеме дисциплины, на самостоятельное изучение студентам выносятся разделы, которые приведены в таблице 7.
|
|
Таблица 7 |
|
|
|
|
|
№ |
№ раздела |
Тема самостоятельной работы |
|
|
|
|
|
1 |
Ч.1, раздел 1 |
Основные понятия и законы химии. |
|
|
|
|
|
2 |
Ч.1, раздел 2 |
Колебательные реакции. |
|
|
|
|
|
3 |
Ч.1, раздел 3 |
Периодический закон и периодическая система химических элемен- |
|
|
|
тов Д.И.Менделеева. Радиусы атомов и ионов. Энергия ионизации, |
|
|
|
энергия сродства к электрону, электроотрицательность. Поляризуе- |
|
|
|
мость ковалентной связи. Полярные и неполярные молекулы. Ди- |
|
|
|
поль. Гибридизация атомных орбиталей. |
|
|
|
|
|
4 |
Ч.1, раздел 4 |
Коллоидные растворы. |
|
|
|
Химия воды. Жесткость воды. Методы водоподготовки. |
|
|
|
|
|
5 |
Ч.1, раздел 5 |
Методы составления уравнений окислительно-восстановительных |
|
|
|
реакций. |
|
|
|
|
|
6 |
Ч.2, разделы 2-6 |
Способы получения основных классов органических соединений. |
|
|
|
|
|
7 |
Ч.2, раздел 9 |
Качественный анализ и его методы |
|
|
|
|
|
9.2 Модульно-рейтинговая система контроля знаний студентов
Модульно-рейтинговая система оценки знаний студентов по видам работ приведена в приложениях 1 и 2.
9.3Примерные темы рефератов
1.Коррозия деталей машин и механизмов. Методы защиты машин и механизмов от коррозии.
2.Нефть: ее состав, физические и химические способы переработки.
3.Различные виды автомобильных топлив. Сравнение их преимуществ и недостатков. Альтернативные виды топлива.
4.Виды автомобильных эксплуатационных материалов, их назначение.
