
950
.pdf11
3. Действия йодида калия на соли Pb2+
Йодид калия KI выделяет из раствора солей Pb2+ желтый осадок йодида свинца (II):
PbCl2 + 2KI = PbI2↓ + 2KCl
1 мл 1 мл
Йодид свинца растворяется в горячей воде, а при охлаждении раствора образует золотистые кристаллы (реакция «золотого дождя»). С избытком KI йодид свинца дает растворимое комплексное соединение тетрайодоплюмбат (II) калия:
PbI2 + 2KI = K2 [PbI4]
избыток
4. Действие раствора аммиака на соли Cu2+
Гидроксид аммония NH4OH дает с ионами Cu2+ зеленоватый осадок основной соли (CuOH)2SO4:
2CuSO4 + 2 (NH4)2 SO4 = (CuOH)2SO4↓ + (NH4)2 SO4
по каплям
В избытке водного раствора аммиака осадок растворяется с образованием тетраамино-купро(II)сульфата ярко-синего цвета:
(CuOH)2SO4 + (NH4)2 SO4 + 6(NH4)2 SO4 = 2[Cu(NH3)4] SO4 + 8H2O
избыток ярко-синий цвет
5. Действия хлорида бария BaCl2 на анионы SO42-, CO32- или PO43-
К 2…3 каплям раствора соли, содержащей соли SO42-, или CO32-, или PO43- прилейте 2…3 капли раствора BaCl2 :
а) SO42- + BaCl2 = Ba SO4↓ + 2Cl-
белый кристаллический осадок, нерастворимый в кислотах и щелочах
б) CO32- + BaCl2 = BaCO3↓ + 2Cl-
белый кристаллический осадок,
хороно растворимый в HNO3 с выделением CO2
в) 2 PO43- + 3BaCl2 = Ba(PO4)2↓ + 6Cl-
белый кристаллический осадок, плавно растворимый в HNO3
6.Действия нитрата серебра (I) AgNO3 на анионы Cl-, Br -, S2-
К2…3 каплям раствора соли, содержащей ион Cl-, Br- или S2- прибавьте 1…2 капли AgNO3 :
а) Cl- + AgNO3 = Ag Cl↓ + NO3-
белый творожистый осадок, хорошо растворимый в NH4OH
Ag Cl + 2 NH4OH = [Ag(NH3)2] Cl + 2H2O
12
б) Br - + AgNO3 = AgBr↓ + NO3-
желтый осадок, нерастворимый в HNO3 плохо растворимый в NH4OH
в) S2- + 2AgNO3 = AgS↓ + 2NO3-
черный осадок
Ответьте на следующие вопросы:
1.В чем суть качественного химического анализа?
2.С помощью каких реагентов можно обнаружить катионы Fe+3 и Fe+2?
3.С помощью какого реагента можно различить растворы солей, содержащих анионы Cl-, Br-, S2-?
Опыт 2. Определение жесткости воды титриметрическим методом
Общая жесткость воды показывает концентрацию в ней катионов двухвалентных щелочноземельных металлов, прежде всего кальция и магния. Общая жесткость складывается из временной и постоянной жесткости. Временная жесткость вызвана присутствием в воде гидрокарбонатов Ca(HCO3)2 и Mg(HCO3)2 и называется карбонатной. Удаляют временную жесткость кипячением. Гидрокарбонаты кальция и магния переходят в малорастворимые карбонаты и таким образом выводятся из воды.
Ca(HCO3)2 →CaCO3↓ + CO2↑ + H2O
Mg(HCO3)2→MgCO3↓ + CO2↑ + H2O
Постоянная жесткость сохраняется при кипячении воды. Обычно постоянную жесткость характеризуют содержанием сульфатов CaSO4 и MgSO4 и называют сульфатной.
Общую жесткость можно устранить, например, введением в воду карбоната натрия, ортофосфата натрия, тетрабората натрия, гидроксида кальция и других реагентов, способных образовывать с ионами кальция и магния малорастворимые соединения.
CaSO4 + Na2CO3 → CaCO3↓ + Na2SO4
3 CaSO4 + 2 Na3PO4 → Ca3(PO4)2↓ + 3 Na2SO4 Ca(HCO3)2 + Ca(OH)2 →CaCO3↓ + H2O.
Количественно жесткость воды характеризуют суммарным содержанием ионов Ca2+ и Mg2+, выраженным в ммоль/л.
По шкале жесткости все природные воды делятся на мягкие (общая жесткость менее 2 ммоль/л), средней жесткости (2…10 ммоль/л) и очень жесткие (более 10 ммоль/л).
Общую и временную жесткость воды можно определить титриметрическим методом. Метод основан на определении объема реагента-титранта точно известной концентрации, расходуемого на взаимодействие с определяемым веществом. Методика титрования заключается в следующем: раство-

13
ром титранта заполняют бюретку, точный объем анализируемого раствора наливают в коническую колбу. В ту же колбу добавляют индикатор. Затем к определяемому раствору в колбе приливают по каплям раствор титранта из бюретки до тех пор, пока не изменится цвет раствора в колбе. По затраченному объему титранта и его концентрации вычисляют концентрацию анализируемого вещества.
Определение временной жесткости воды
Временную жесткость воды определяют методом кислотно-основного титрования. Титрование исследуемой воды осуществляют раствором соляной кислоты известной концентрации. При этом происходят реакции:
Ca(HCO3)2 + 2HCl = CaCl2 + 2CO2 + 2H2O
Mg(HCO3)2 + 2HCl = MgCl2 + 2CO2 + 2H2O
Ход определения
Для проведения титрования заполняют бюретку раствором соляной кислоты известной концентрации. В две конические колбы с помощью мерной посуды отмеряют по 100 мл водопроводной воды, добавив в них по 2…3 капли индикатора метилового оранжевого. Одна из колб будет служить контрольной.
Затем титруют исследуемую пробу воды раствором соляной кислоты из бюретки до тех пор, пока от одной капли кислоты окраска перейдет из желтой в слабо-оранжевую. Записывают объем соляной кислоты, израсходованной на титрование. Титрование повторяют с новой порцией воды 3-4 раза до результатов, разница между которыми не превышает 0,2 мл, и определяют среднее арифметическое значение.
Величину временной жесткости воды вычисляют по формуле
Жвр = Сн(HCl) V(HCl) 1000 , VH2O
где Жвр. - временная жесткость воды, ммоль/л; Сн(HCl) - нормальная концентрация соляной кислоты, моль/л; V(HCl) - объем кислоты, израсходован-
ный на титрование, мл; VН2О - объем исследуемой пробы воды, мл.
Определение общей жесткости воды
Общую жесткость воды определяют комплексонометрическим титрованием. Метод основан на применении специального реактива - трилона Б (двузамещенная натриевая соль этилендиаминтетрауксусной кислоты):
HOOCH2С CH2COONa
\/
|
N - CH2 - CH2 - N |
2H2O |
/ |
\ |
|
NaOOCH2С CH2COOH

14
В основе метода лежит способность трилона Б образовывать прочные комплексы с катионами многих металлов, в том числе с кальцием и магнием.
Схематически данное взаимодействие может быть выражено уравнением: Ca2+ + Na2H2R = Na2(CaR) + 2H+ ,
где R - радикал этилендиаминтетрауксусной кислоты.
Течению реакций благоприятствует слабощелочная среда, которая создается прибавлением аммиачного буферного раствора. Он представляет собой смесь слабого основания NH4OH c его солью NH4Cl и обладает способностью поддерживать рН раствора практически постоянным.
Если в раствор, содержащий ионы кальция или магния, ввести индикатор, дающий цветные соединения с этими ионами, то при добавлении трилона Б к такому окрашенному раствору произойдет изменение окраски в эквивалентной точке.
В качестве индикатора применяют хромоген черный.
Ход определения
В две конические колбы с помощью мерной посуды отмеряют по 100 мл водопроводной воды. Добавляют в эти же колбы по 5 мл буферной смеси и на кончике шпателя - индикатор хромоген черный до получения винно-красной окраски. Одна из колб служит контрольной. Далее титруют пробу из бюретки раствором трилона Б до тех пор, пока от одной капли трилона Б окраска перейдет из винно-красной в синюю. Титрование повторяют с новой порцией воды и при сходных результатах между двумя значениями объема трилона Б, пошедшего на титрование (разница не более 0,2 мл), находят среднее арифметическое значение.
Расчет общей жесткости воды производят по формуле
Жобщ = Сн(тр) V(тр) 1000 ,
VH2O
где Жобщ.- общая жесткость воды, ммоль/л; С н(тр) - нормальная концентрация трилона Б, моль/л; V(тр) - объем трилона Б, израсходованный на титрование, мл; VН2О - объем исследуемой пробы воды, мл.
Постоянную (некарбонатную) жесткость воды находят по разности общей и временной (карбонатной) жесткости
Жпост.= Жобщ.- Жвр.
По полученным данным характеризуют жесткость исследуемой воды.
Ответьте на следующие вопросы:
1.Какой количественный метод химического анализа используют для определения временной жесткости воды?
2.Каким методом определяют общую жесткость воды?
3.В чем суть титриметрического метода анализа?
15
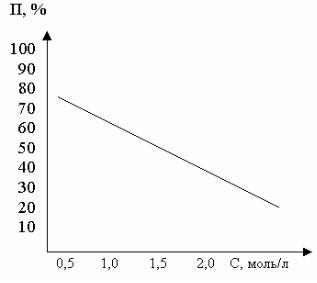
Опыт 3. Определение концентрации раствора хлорида железа (III) фотоколориметрическим методом
Определение концентрации раствора FeCl3 проводят с использованием фотоэлектроколориметра КФК-3, который предназначен для определения концентрации окрашенных растворов. При этом измеряют оптическую плотность исследуемого раствора (П, %) и по градуировочному графику находят
концентрацию данного раствора. |
|
||
|
Ход определения |
||
Строят |
градуировочный гра- |
|
|
фик. Для этого готовят серию эта- |
|
||
лонных растворов FeCl3 с известной |
|
||
концентрацией: 2М, 1,5 М, 1М, |
|
||
0,5М, 0,1М. Заполняют одну кювету |
|
||
эталонным |
раствором, вторую – |
|
|
дистиллированной водой. Устанав- |
|
||
ливают светофильтр с длиной волны |
|
||
λ = 420 нм. Измеряют оптическую |
|
||
плотность всех эталонных растворов |
|
||
и строят градуировочный график. |
|
||
Затем измеряют оптическую плот- |
|
||
ность раствора хлорида железа неиз- |
|
||
вестной концентрации и по градуи- |
Рис.1 Градуировочный график зависимости |
||
ровочному графику находят его |
оптической плотности раствора FeCl3 от его |
||
молярную концентрацию. |
|||
молярной концентрации |
|||
Ответьте на следующие вопросы:
1.Какой количественный метод химического анализа используют для определения концентрации раствора FeCl3?
2.В чем суть фотоколориметрического метода анализа?
3.Что представляет собой градуировочный график?
Учебно-исследовательская работа
Определение концентрации раствора формальдегида методом потенциометрического титрования
В нейтральной среде между формальдегидом и сульфитом натрия про-
текает реакция: |
|
Н |
Н |
|
|
H C = O + Na2SO3 |
+ H2O → H C OH + NaOH |
|
|
|
SO3Na |

16
Количество выделившегося NaOH эквивалентно количеству прореагировавшего формальдегида. Поэтому, определив концентрацию NaOH, можно рассчитать концентрацию раствора формальдегида. Для этого образовавшийся в результате реакции NaOH оттитровывают раствором соляной кислоты. За точку эквивалентности принимают рН=10,4.
Ход определения
Для проведения титрования заполняют бюретку раствором соляной кислоты известной концентрации (0,1М). В коническую колбу отмеряют 10 мл раствора формальдегида и добавляют 10 мл Na2SO3. Проводят титрование раствором HCl до рН=10,4, что контролируют с помощью рН-метра. Записывают объем соляной кислоты, израсходованной на титрование. Титрование повторяют до результатов, разница между которыми не превышает 0,2 мл, и определяют среднее арифметическое значение.
Концентрацию раствора формальдегида (в %) рассчитывают по формуле
ω = Сн(HCl) V(HCl) 3,
V
где Cн(HCl)- нормальная концентрация соляной кислоты,
V(HCl) - объем раствора соляной кислоты, израсходованный на титрование, мл; моль/л;
V - объем раствора формальдегида, мл.
Ответьте на следующие вопросы:
1.Какой количественный метод химического анализа используют для определения концентрации раствора формальдегида?
2.Какая химическая реакция лежит в основе определения формальдегида?
3.Как фиксируется точка эквивалентности в используемом методе анализа?
Библиографический список
Основная литература
1.Коровин, Н. В. Общая химия [Текст] : учебник / Н. В. Коровин. – М. : Высш.шк., 2002. – 558 с.
Дополнительная литература
1.Цитович, И. К. Курс аналитической химии [Текст] : учебник / И. К. Цитович. - М. : Высш.шк., 1994. – 495 с.
