
Водно-химический режим АЭС с реакторами ВВЭР-1000 и РБМК-1000 Рощектаев Б.М
. .pdf5.1. Сродство и селективность ионитов
Реакция ионного обмена возможна потому, что ионы в ионите, погруженном в водные растворы, находятся в диссоциированном состоянии и вступают в реакции обмена, соблюдая все законы растворов. Если ионит вводится в водный раствор электролита, не содержащий комплексообразующих веществ, между ионитом и ионами в растворе протекают обменные реакции (при условии, что смолы не идентичны ионам растворенного электролита).
Н-катионитовые фильтры в схеме обессоливания предназначены для удаления из обрабатываемой воды катионов Ca2+, Mg2+, Na+ и др. за счет обмена на катион водорода Н+, содержащийся в катионите:
2RH + Ca(HCO3)2 → R2Ca + 2H2O + 2CO2;
2RH + Mg(HCO3)2 → R2Mg + 2H2O + 2CO2;
2RH + CaSO4 → R2Ca + H2SO4;
2RH + MgSO4 → R2Mg + H2SO4;
2RH + CaCl2 → R2Ca + 2HCl;
2RH + MgCl2 → R2Mg + 2HCl;
RH + NaCl → RNa + HCl;
2RH + Na2SiO3 → R2Mg + H2SiO3;
2RH + Na2SO4 → 2RNa + H2SO4.
Поскольку в процессе Н-катионирования воды все катионы Ca2+, Mg2+, Na+ заменяются на катион водорода Н+, то содержащиеся в воде сульфаты SO42-, хлориды Cl-, нитраты NO3- переходят в соответствующие кислоты.
Анионитовые фильтры предназначены в схеме обессоливания воды для поглощения анионов кислот за счет обменного аниона OH-:
2ROH + H2SO4 → R2SO4 + 2H2O;
ROH + HCl → RCl + H2O;
ROH + HNO3 → RNO3 + H2O;
2ROH + H2CO3 → RHCO3 + H2O.
Если эти реакции выполняются в замкнутой системе, то, поскольку ионный обмен является обратимым процессом, наступает равновесие. Равновесные концентрации ионов, принимающих участие в обмене, не идентичны. Они зависят как от величины относительного сродства реагирующих ионов, так и от исходной концентрации. Экспериментально установлено, что
91
сродство (или ионообменный потенциал) различных ионов к одной и той же смоле (в разбавленных растворах < 0,1 М) увеличивается с повышением ионного заряда исследуемого иона. Поливалентные ионы образуют с ионитом более прочные связи (при одинаковых условиях), чем одновалентные ионы. Для ионов одинакового заряда сродство обратно пропорционально радиусу гидратированного иона. Однако это утверждение является только общим правилом, существуют исключения.
Более подробные сравнительные исследования показали, что сродство катионов к ряду ионитов аналогично или идентично так называемому лиотропному ряду. Для сродства анионов наблюдаются аналогичные закономерности, кроме того, оно увеличивается с повышением поляризуемости анионов.
На порядок сродства ионов в каждом ряду слабо влияют индивидуальная природа ионита и условия. Различия в сродстве между индивидуальными ионами называется селективностью. Селективность определяется типом и концентрацией реагирующих ионов, а также природой растворителя и ионита.
Селективность ионитов повышается с увеличением содержания сшивающего вещества. Катионы с меньшим эффективным радиусом гидратированного иона сорбируются предпочтительнее. Если ионогенная группа образует с реагирующим ионом ионную пару, то селективность смолы к этому типу ионов увеличивается. При образовании в растворе труднодиссоциирующих соединений в первую очередь сорбируются ионы, которые образуют соединения с большей степенью диссоциации. С повышением температуры уменьшаются ионные гидратные оболочки, что приводит к уменьшению различия в радиусах гидратированных ионов и, следовательно, к снижению селективности смолы.
С аналитической точки зрения, регулирование селективности смолы имеет важное значение. Наиболее удобным способом является введение комплексообразующих веществ в ионообменную систему (на стадии сорбции или элюирования). Поскольку ионогенные группы смол имеют различную селективность, подбором существующего агента можно легко разделить смеси (либо селективной сорбцией, либо селективным элюированием).
92
5.2. Основные критерии выбора типа смол
Для очистки вод реакторных контуров АЭС используют иониты в больших количествах. Несмотря на большой ассортимент выпускаемых смол, выбор наиболее подходящей смолы для конкретной задачи связан с определенными трудностями. При выборе типа смол руководствуются обычно тремя основными критериями:
типом ионогенных групп и их ионной формой;
видом каркаса, степенью его поперечного связывания и пористостью;
размером и однородностью зерен смолы (для негранулированных смол – формой материала).
Дополнительными критериями при выборе смолы являются монофункциональность ионита, его чистота, механическая, химическая, термическая и радиационная устойчивость, осмотическая стабильность и т.п.
Существенное влияние оказывает степень сшивания смолы на селективность и скорость установления равновесия, а также на степень набухания смолы. Низкая степень сшивания обуславливает высокую набухаемость при контакте с растворителем. Объем набухшей смолы в значительной степени изменяется с изменением свойств внешнего раствора. Это явление особенно нежелательно при работе в динамическом режиме. Низкая степень сшивания смолы способствует уменьшению различий в сродстве ионов к иониту.
В то же время высокая степень сшивания смолы способствует уменьшению набухаемости и повышению селективности. Вследствие малых изменений объема (даже при существенных изменениях свойств внешнего раствора) эти иониты имеют преимущества при работе.
К недостаткам смол с высокой степенью сшивания относят меньшие величины удельной обменной емкости и низкую скорость обмена ионов. Кроме того, высокая плотность поперечных связей в ионите ограничивает диффузию больших ионов.
На практике отдают предпочтение смолам на основе сополимера стирола с дивинилбензолом. Сильнокислотные катиониты содержат 8 % ДВБ, а сильноосновные аниониты –
93
4-6 %. Промышленностью также выпускаются смолы, содержащие
2-16 % ДВБ.
Наибольшее применение в практике находят смолы в виде зерен сферической формы. Иониты производят с различным размером зерна.
Сильнокислотные катиониты: КУ-2-8, КУ-2-8чс, Dowex-50-X8, Anberlite JRN.
Сильноосновные аниониты: АВ-17-8, АВ-17-8чс, NRW-600, Dowex-SBR-P.
Слабоосновные аниониты: АН-31, Purolite A854, Dowex-NWA-1.
5.3. Равновесие ионного обмена
Ионный обмен, протекающий в системе раствор – ионит чаще всего в эквивалентных соотношениях до достижения равновесия, является обратимым процессом и подчиняется закону действующих масс. Однако в каждом конкретном случае ввиду большого разнообразия систем и возможности протекания побочных процессов обратимость должна проверяться.
Уравнение ионного обмена между ионитом, содержащим ион А, и раствором электролита ВХ с ионом В и анионом Х может быть
записано в виде
ZBRZAAZR + (ZAZR-/ZX)BZXXZB = ZARZBBZA + (ZBZR-/ZX)AZXXZA,
или в ионной форме
ZBA-ZА + ZABZВ = ZАВ-ZВ + ZВАZА,
или
(1/ZA)A-ZA + (1/ZB)BZB = (1/ZB)B-ZB + (1/ZA)AZA.
Термодинамическую константу равновесия КВ/А найти трудно из-за отсутствия данных о коэффициентах активности ионов даже в растворах, экспериментальное же определение коэффициентов активности ионов в ионитах имеет ряд трудностей, не решенных до настоящего времени. Поэтому для описания состояния равновесия на практике используют кажущуюся константу КВ/А на равновесие, коэффициент распределения и коэффициент селективности Кизб:
Кизб = (YB/YA)(YPA/YPB).
При равных зарядах обмениваемых ионов (ZA = ZB)
КВ/А = Кизб В/А
КВ/А = YB1/ZBXA1/ZA/ YA1/ZAXB1/ZB
94
YB1/ZBYA1/ZA = КВ/А ZAXB1/ZBXA1/ZA,
где Y – концентрация вещества в твердой фазе, Х – концентрация вещества в жидкой фазе.
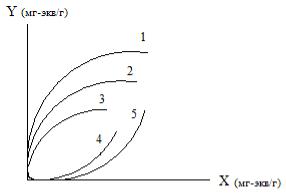
Состояние равновесия системы при t = const обычно изображается графически в виде изотерм сорбции (десорбции) (рис. 5.1).
Рис. 5.1. Изотермы:
1−3 – изотермы сорбции при различном солесодержании, КВ/А>1; 4,5
– изотермы регенерации, КВ/А<1.
Изотерма является одной из важнейших характеристик ионного обмена, так как она позволяет определить равновесную обменную емкость, среднюю движущую силу процесса массообмена, число единиц переноса и другие показатели, необходимые для определения размеров ионитовых аппаратов.
5.4.Кинетика ионного обмена
Впроцессе ионного обмена происходит изменение концентрации вещества в растворе и ионите во времени. Знание закономерностей этого процесса необходимо при рассмотрении механизма, расчете оборудования и получении информации о равновесном распределении элементов.
Ионообменный процесс складывается из трех стадий:
диффузии обменивающихся ионов от или к поверхности раздела фаз;
диффузии обменивающихся ионов внутри зерна ионита в противоположных направлениях;
95

химической реакции двойного обмена.
Причем последняя стадия характеризует химическую кинетику, а две первые имеют диффузионный характер.
Скорость многостадийного процесса определяется скоростью наиболее медленной стадии.
Большинство экспериментальных данных по ионному обмену, полученных в статических и динамических условиях, показали, что скорость процесса определяется диффузионными стадиями − внешней (1 стадия) или внутренней (2 стадия) диффузией, т.е. скорость ионного обмена существенно зависит от размера зерен катионита или анионита. Перенос вещества в случае диффузионной кинетики определяется законами Фика:
для внешней диффузии I = − DжdC/dR;
для внутренней диффузии dj/di = DсорбSd2C/dR2. Относительная роль внешней или внутренней диффузии будет
зависеть от диффузионного потока и аппаратурного оформления. Внешне-диффузионная кинетика будет проявляться в очень разбавленных растворах, на сорбентах с высокой емкостью и малым числом поперечных связей. В этом случае скорость процесса будет зависеть от гидродинамических факторов − от интенсивности перемешивания. Внутридиффузионная кинетика будет преобладать в концентрированных растворах, на сорбентах с большим числом поперечных связей. Механизм ионного обмена можно оценить различными способами по соотношениям:
YDсо рб (5 2 К А / В ) <<1 при внутренней диффузии;
хDж Rч
YDсо рб (5 2 К А / В ) >>1 при внешней диффузии;
хDж Rч
YDсо рб (5 2 К А / В ) ≈1 при смешанной диффузии.
хDж Rч
Здесь у=∑(Z1Y1), х=∑(X1Z1), − суммарные концентрации обменивающихся ионов в твердой и жидкой фазах;
КA/В = yAxB/xAyB = αA/αB − коэффициент разделения обоих сортов противоионов в равновесном состоянии: ион А первоначально находится в ионите, В − в растворе. Существует много различных критериев и способов оценки лимитирующей стадии.
96
5.5. Обменная емкость ионитов
Важной характеристикой ионитов является обменная емкость Е, выражаемая числом грамм-эквивалентов обмениваемых ионов в одном кубическом метре ионита (во влажном состоянии). Обменная емкость ионита зависит от соблюдения технологического производства ионитов (равномерность сшивки), доли дивинилбензола в готовом ионите, насыщения фиксированных ионов в исходном материале. А фактическая обменная емкость зависит от числа активных групп на поверхности зерен ионита. Поверхностью ионита является также поверхность углублений, пор, каналов. Поэтому предпочтительней иметь иониты с пористой структурой. Обменная емкость бывает:
статической (равновесной) или динамической;
полной;
«до проскока» или рабочей;
эксплуатационной.
Статическая или равновесная обменная емкость ионита (СОЕ) соответствует количеству ионов (г-экв), обмениваемых единицей объема (1 м3) регенерированного ионита при контакте его с раствором обмениваемого иона определенной концентрации в отсутствие протока жидкости (при переливании воды или без него). В этих статических условиях устанавливается определенное равновесие между концентрациями обмениваемых ионов в растворе и ионите, характеризуемое изотермой сорбции. Для практики водоподготовки СОЕ не имеет существенного значения. Динамическая емкость ионита ДОЕ определяется путем фильтрования раствора обмениваемого иона через слой ионита определенной высоты. Величина ДОЕ определяется теми же факторами, что и СОЕ, но существенное значение имеет здесь поток воды, высота слоя, скорость фильтрования воды, определяющая продолжительность контакта с ионитом, а также гидравлические условия работы слоя ионита в части равномерности фильтрования воды по всему поперечному сечению слоя ионита. Измеряется в тех же единицах, что и СОЕ.
Фильтрование воды через слой ионита может продолжаться до момента получения обмениваемого иона в фильтрате. Если фильтрование продолжается до момента полного выравнивания
97
концентраций обмениваемого иона в исходной воде и фильтрате, то при этом используется практически вся емкость обмена по данному иону. Такой режим соответствует использованию полной обменной емкости ионита ПДОЕ. Если фильтрование заканчивается при появлении проскока обмениваемого иона, т.е. его концентрация в фильтрате больше нормальной величины, то используется обменная емкость до проскока ДОЕпр. За величину проскока принимают величину 0,01÷0,05 мг-экв/м3. В ряде случаев фильтрование ведут до остаточной концентрации обмениваемого иона в фильтрате значительно большей величины проскока. Это рабочая обменная емкость, которая чаще всего равна обменной емкости до проскока ДОЕпр.
В отличие от обменной емкости ионита иногда вводят понятие обменной емкости ионитного фильтра, которая равна ОЕ, умноженной на объем ионита в фильтре.
5.6. Осмотическая стабильность
Возможное разрушение, изменение формы ионита вследствие изменения рН среды, от механических нагрузок и прочих факторов необходимо знать и учитывать не только из экономических соображений, но и с точки зрения возможного загрязнения целевого продукта вредными компонентами, получающимися при разрушении ионита. Последнее играет важную роль в атомной промышленности, многие технологические процессы которой направлены на получение особо чистых веществ.
Основными причинами разрушения чистых сорбентов является внутреннее, осмотическое давление и механическое взаимодействие сорбентов друг с другом или узлами аппаратов, причем механическое разрушение играет меньшую роль.
Наибольшее разрушение ионитов происходит при изменении характеристик среды, в которой они находятся. Поскольку все иониты представляют собой структурированные гели, их объем зависит от рН и солесодержания раствора. При изменении этих характеристик и изменяется объем зерна. Однако это происходит неравномерно, по мере выравнивания концентрации «нового» раствора по объему зерна, поэтому внешний слой сжимается или расширяется раньше, чем ядро зерна; возникают огромные
98
внутренние осмотические напряжения, происходит откалывание части зерна или раскалывание его пополам. Происходит так называемый «осмотический шок». Каждый ионит имеет возможность выдержать определенное число циклов таких изменений характеристик среды, что и называется его осмотической прочностью или стабильностью.
5.7. Размеры зерен ионита
Важной характеристикой синтетических ионообменных смол является распределение размеров их частиц. Многие годы смолы изготавливались таким образом, чтобы размеры их частиц были приспособлены к требованиям конкретного применения. Был определен «стандартный» интервал распределения диаметров гранул, равный 0,3÷1,2 мм. Такого типа смолы нашли применение во многих случаях использования ионного обмена, особенно, если они применялись на отдельно функционирующей станции или установке очистки воды.
Если аниониты и катиониты используются совместно, то в общем случае для регенерации они должны быть вновь разделены. Катиониты являются более плотными, нежели аниониты, и можно было бы ожидать, что во время промывки слоя они осядут на дно. Однако на практике смолы со стандартным диапазоном изменения размеров частиц проявляют плохую тенденцию отделения на поверхности, т.е. более мелкие катионитовые гранулы являются более плавучими, чем более крупные анионитовые гранулы, которые оседают быстрее более мелких анионитовых частиц. Поэтому смолы, предназначенные для применения в ФСД (смешанные слои), должны поставляться так, чтобы более мелкие шарики были сосредоточены в катионите, а более крупные − в анионите. Эти случаи действительны и для слоистых ионообменных слоев. Размер и сферичность частиц влияют на объем пустот и гидравлическое сопротивление, которое обратно пропорционально квадрату сечения частицы. При уменьшении объема пустот примерно на 10 % сопротивление удваивается. Следовательно, в слое с однородными сферическими частицами потери давления будут существенно меньше, поэтому можно использовать более высокую скорость потока. При повышении
99
содержания более мелких частиц может быть улучшена эффективность ионообменных реакций на стадии регенерации и во время фильтроцикла.
5.8. Фильтроцикл
Фильтроцикл − это время работы ионообменной смолы от регенерации до регенерации при ее эксплуатации в фильтре. Продолжительность фильтроцикла зависит от:
характеристик ионита (размера зерна, обменной емкости и т.д.);
условий работы смолы (повышенные температуры, радиация, водные растворы солей, продукты коррозии конструкционных материалов и др).
5.9. Перманганатная окисляемость
Перманганатная окисляемость ионообменных материалов определяет меру загрязнения смолы органическими остатками вследствие медленно идущего процесса разрушения смол под действием среды и температуры в процессе эксплуатации на АЭС.
5.10. Термическая, химическая и радиационная устойчивость ионитов
Термическая, химическая и радиационная устойчивость органических ионитов зависит от типа полимерной матрицы, степени поперечного сшивания, типа ионогенных групп и их противоионов. Помимо этих главных факторов, на устойчивость ионитов оказывают влияние чистота исходного сырья и метод синтеза.
Изменение устойчивости смолы становится особенно явным при изменении степени набухания, образовании новых групп (особенно слабокислотных) или при различной степени деструкции полимерной матрицы.
5.11. Термическая устойчивость
Сульфированные катиониты фенолформальдегидного типа в Н-форме проявляют первые признаки десульфирования при 100 ºС. Объемная емкость смол изменяется при нагревании до 70 ºС в
100
