
Билеты_буракова
.pdf2. Как подготавливают “тельца включения” к очистке? Для чего используется каждый этап?
1.Разрушают клетки ультразвуком в буфере 20 мМ р-ре Трис-HCl, рН 7.0. Этот буфер используется для перехода содержимого в экстракт.
2.К разрушенным клеткам добавляют 0.9% NaCl и тот же буфер. Буфер и раствор также необходимы для перехода в них ненужных клеточных компонентов. (промывают дважды);
3.Промывка Triton 1% X-100 – детергент используется для удаления остальных клеточных компонентов (может быть липидов);
4.Промывка буфером 20 мМ Трис-HCl pH 7.0 – для промывки телец включений от детергента;
После каждого этапа необходимо ресуспендировать образцы и после центрифугировать-осадить белок. После центрифугирование сливается супернатант.
5. К осадку добавляют мочевину, чтобы перевести тельца-включения в раствор. На этом этапе белок готов для очистки на хроматографической колонке.
Возможно может спросить что-то из этого: отмывка 0.9% раствором NaCl служит для удаления гидрофильных примесей, 0.1% раствором Тритона Х- 100 – для удаления гидрофобных компонентов (в основном, остатков клеточных мембран).
3. Рассчитайте эффективность трансформации, если для нее использовали 1 мкл ДНК с концентрацией 100 нг/мкл, 20 мкл суспензии компетентных клеток и 100 мкл среды, на чашку Петри было высеяно 100 мкл культуры, в результате чего выросло 2000 колоний бактерий.
Всего в пробирке: 20 мкл клеток+100 мкл среды + 1 мкл р-ра ДНК (конц. 100 нг/мкл или если перевести, то 0.1 мкг/мкл).
На чашку Петри выливали только 100 мкл полученного раствора. Тогда посчитаем, сколько ДНК содержится в этом объеме:
121 мкл р-ра - 0.1 мкг ДНК
100 мкл – х мкг ДНК Х- 0.082644 (̴0.08 мкг ДНК в 100 мкл).
На 1 чашку попало 0.08 мкг ДНК.
Эффективность трансформации = число колоний на чашке / на кол-во ДНК на чашку (мкг)
Эффективность трансформации = 2000/0.08= 25000=25 х 103
Билет № 7 1. В каких условиях производится культивирование
трансформированных клеток Е.coli BL21?
Клетки штамма E. coli BL21(DE3), культивировали в LB-среде, содержащей ампициллин (200 мг/мл) с постоянным перемешиванием при 37°С до плотности OD590нм = 0,8. Индукцию синтеза белка проводили добавлением в культуральную среду ИПТГ (изопропил-β-D-1-тиогалактопиранозид) в конечной концентрации 1 мМ, и культивировали еще в течение 3-х часов в тех же условиях. Клетки осаждали центрифугированием (5000g, 20 мин, 4°С).
(пусть, сука,только что то пизданет против, это взято с одной из работ Франк)
2. В какие отделы клетки и в какой форме может осуществляться экспрессия гена целевого белка? За счет чего достигается тот или иной вариант экспрессии?
Экспрессия белка – это синтез белков в клетке, под контролем определенных генов. Экспрессия белков осуществляется за счёт встраивания кодирующих их генов. Гены встраиваются в клетки(организм – хозяин). Для встраивания гена используют плазмиды(векторы). Для экспрессии белков используют экспрессирующие системы, которые включают в себя несколько плазмид и хозяйские штаммы.
В экспрессии белка участвуют: ядро, цитоплазма и рибосома.
Экспрессия белка – это длинный процесс с транскрипцией ДНК, получением РНК и преобразованием его в активный белок.
Белки, синтезируемые в клетках эукариот: вакцины, гормоны, ростовые факторы, цитокины, ферменты, рецепторные белки.
При бактериальной экспрессии белок может направляться в периплазму, культуральную среду или оставаться в цитоплазме – как в растворимой форме, так и в виде нерастворимых агрегатов – телец включения. При эукариотической экспрессии белок при наличии в его гене специфической лидерной последовательности можно накапливать в клеточных органеллах (например, в митохондриях).
3. Как приготовить 300 мл 0.9% раствор NaCl в воде из стокового 5 М раствора NaCl, если его Mw=58 г/моль?
V=m/M
m=V*M
m=5 моль*58 г/моль
290 |
1000 |
|
|
0,9 |
х |
|
|
Х=3,1 мл на 100 мл
3,1*3=9,3
Вода: 300-9,3=290,7мл
Чтобы приготовить раствор нам нужно 9,3 мл стокового раствора довести водой до объёма 300 мл, для этого нужно 290,7 мл воды.
Билет №8 1. Для чего добавляют антибиотик и арабинозу в агар для
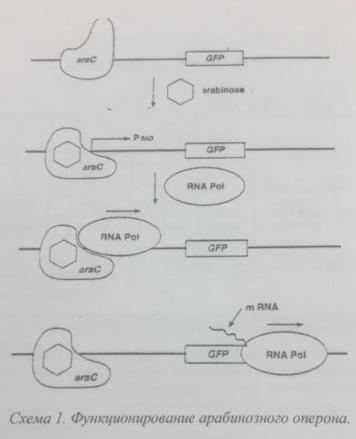
выращивания клеток, трансформированных плазмидой pGLO? Какие признаки мы можем наблюдать при таком выращивании?
Антибиотик добавляют для того, чтобы исключить рост посторонней микрофлоры (не трансформированных клеток). Трансформированные клетки имеют устойчивость к антибиотику из за гена, кодирующего В-лактамазу, которая обеспечивает устойчивость к ампициллину. Арабиноза действует как индуктор нужна для активации арабинозного оперона, который контролирует экспрессию белка в клетке. По механизму «негативной регуляции»: Белок-
репрессор соединяется с оператором и блокирует транскрипцию, так как препятствует перемещению РНК-полимеразы. Весь оперон оказывается «выключен».
При наличии в среде индуктора (арабинозы) он взаимодействует с белкомрепрессором, в результате чего репрессор не может присоединиться к оператору. Свободный оператор «открывает путь» РНК-полимеразе, и все геныоперона транскрибируются. При удалении индуктора репрессор вновь занимает место на операторе, и транскрипция прекращается.
2. Что такое “тельца включения”? Какие преимущества и недостатки они дают при выделении рекомбинантных белков?
Тельца включения — это нерастворимые белковые агрегаты, образующиеся при суперэкспрессии (чрезмерная активность гена, который производит избыточное количество белка) рекомбинантных белков у бактерий.
Под микроскопом они выглядят как большие тёмные скопления, представляют собой аморфные образования. Если синтез белка прекращается, то тельца включения постепенно исчезают и полностью свёрнутый белок появляется в цитоплазме.
При выделении рекомбинантных белков основным преимуществом телец включения является то, что они содержат относительно чистый экспрессируемый белок и сравнительно легко выделяются. Однако недостаток – это последующий рефолдинг (повторное сворачивание) белка. Поэтому существуют специальные системы экспрессии, намеренно направляющие белок в тельца включения.
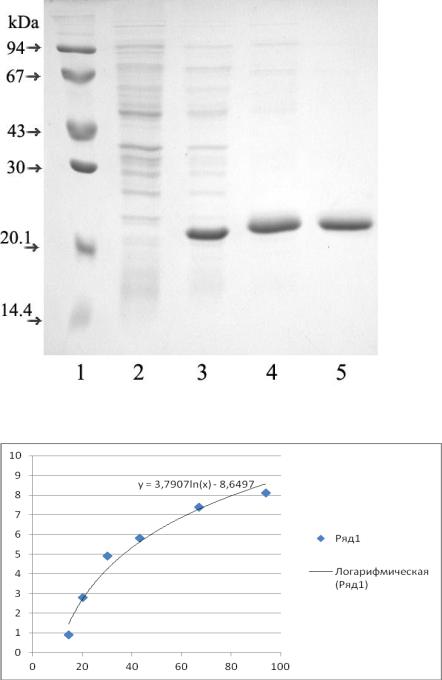
3. Определите молекулярную массу белка на треке 5 электрофореграммы с помощью калибровочного графика.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Масса, |
Расстояние, |
|
|
|
|
|
|
|
|
|
|
кDa |
см |
|
|
|
|
|
|
|
|
|
|
14,4 |
0,9 |
|
|
|
|
|
|
|
|
|
|
20,1 |
2,8 |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
30 |
4,9 |
|
|
|
|
|
|
|
|
|
|
43 |
5,8 |
|
|
|
|
|
|
|
|
|
|
67 |
7,4 |
Белок на треке 5 – 3,4 см |
94 |
8,1 |
|||||||||
|
|
||||||||||
Считаем по уравнению Х=24kDa
Билет №9 1. Что такое рекомбинантные белки и как их получают?
Рекомбинантные белки - результат новых комбинаций генов, которые формируют ДНК. Рекомбинантные белки получены на основе
клонированных последовательностей ДНК, которые обычно кодируют ферменты и белки с известными функциями.
Рекомбинантные белки - это белки, ДНК которых была создана искусственно.
Технологии рекомбинантных ДНК – это совокупность процедур, позволяющих осуществить конструирование нового генного комплекса и перенос его в организм-реципиент, где новый генетический материал начинает
работать. Не существует единого универсального набора методик, все зависит от конкретной задачи, но чаще всего эксперименты с рекомбинантной
1. Получение нужной последовательности – ДНК для клонирования
может быть получена химико-ферментативным синтезом, обратной транскрипцией мРНК и путем непосредственного расщепления геномной ДНК
нужной рестрикционной эндонуклеазой. Но самый распространенный путь
сейчас – синтез ДНК методом ПЦР
2.После обработки рестриктазами полученный ген соединяют (лигируют) с клонирующим вектором с образованием новой, рекомбинантной молекулы – конструкция «клонирующий вектор – встроенная ДНК». Вектор для клонирования – общий термин, обозначающий молекулу ДНК, способную к включению чужеродной ДНК и к автономной репликации, служит инструментом для введения генетической информации в клетку. То есть является молекулой-носителем, подобно космической ракете-носителю, для клонируемой ДНК.
3.Полученную рекомбинантную конструкцию вводят в клетку-мишень
(рецепиент), где она реплицируется и передается потомкам. Этот процесс называется трансформацией (в основном для прокариот и дрожжей) и трансфекцией (в случае эукариот). В зависимости от типа вектора и схемы эксперимента рекомбинантная ДНК может либо реплицироваться автономно, либо встроиться в хромосому клетки-хозяина.
4.Используя селективный маркер, идентифицируют и отбирают клетки, несущие рекомбинантную ДНК. (высев клеток на среду с антибиотиком)
5.Наращивание бактериальной массы
6.Индукция синтеза целевого продукта, добавляют определенное вещество которое запускает синтез нужного белка. Растут до определленой плотности
7.Этап получения телец включения, (центрифугирования биомассы и разрушение ультразвуком, очистка, растворение,
8. Рефолдинг
9. Получение высоко отчищенного препарата (обессоливание, ионообменная хроматография, гель-фильтрация)
2.Опишите принцип разделения белков с помощью аффинной хроматографии. Привидите приверы биоспецифических взаимодействий.
Аффинная хроматография — разновидность лигандной хроматографии. В основе последней лежит реакция взаимодействия разделяемых примесей с лигандом, связанным с инертным носителем. В случае аффинной хроматографии в роли примесей выступают биологически активные вещества (белки, ферменты), вступающие с лигандом (тоже, как правило, органическим) в специфическое биохимическое взаимодействие. Например: антитело-антиген, гормон-рецептор и т. д. Именно высокая специфичность подобного взаимодействия обусловливает высокую эффективность аффинной хроматографии и её широкое (по сравнению с другими видами лигандной хроматографии) распространение.
Биоспецифические взаимодействия.
Фермент-субстрат Антиген-антитело
Гуанин-Цитозин (комплементарность) Авидин-биотин
3. Рассчитайте коэффициент молярной экстинкции для белка, в
аминокислотном составе которого присутствуют 5 остатков триптофана и 11 остатков тирозина, и определите его концентрацию в растворе в г/л, если при измерении в кювете с оптическим путем 1 см оптическая плотность раствора OD280=0.65 ед, а молекулярная масса белка равна 25 кДа.
Формула для расчета коэффициента экстинкции:
=
5700 (nTrp) +1300 (nTyr)[M
−1 |
cm |
−1 |
|
|
]
= 42 800

С=А/Е/L
0.65/42 800/1= 0,000015 моль/литр концентрация раствора
Билет №10 1. Для чего нужна регуляция экспрессии белка и каким образом она
осуществляется?
Экспрессия белка – это синтез белков в клетке, под контролем определенных генов. Длинный процесс с транскрипцией ДНК, получением РНК и преобразованием его в активный белок.
В биотехнологических экспрессионных системах регуляция экспрессии нужна для оптимизации роста культуры клеток с целью получения максимального количества целевого белка. В частности, бактериальные клетки в культуре без экспрессионной нагрузки демонстрируют логарифмический характер роста. Индукцию экспрессии рекомбинантного белка начинают в средней фазе роста, когда оптическая плотность клеточной культуры достигает OD600 ~ 0.6-0.7 оптических единиц. После добавления индуктора запускается процесс синтеза целевого белка, а деление клеток при этом замедляется, постепенно выходя в стационарную фазу. Если индуктор добавлять сразу, то клеток в культуре будет мало, что снизит выход белка,
если же добавить в позднюю фазу роста, то прибольшом количестве клеток белка будет мало, так как ресурсы питательной среды уже будут истощены и их будет недостаточно для синтеза. (это ее ответ на данный вопрос)
2.Какими способами можно оценить чистоту выделенного с помощью хроматографии белка?
Электрофорез.
3.Определите молекулярную массу мажорного белка на треке 3 электрофореграммы с помощью калибровочного графика.

Билет №11 1. От чего зависит коэффициент экстинкции белка и как его рассчитать?
Коэффициент молярной экстинкции - характеристика того, насколько сильно химическое вещество поглощает свет на заданной длине волны.
Коэффициент экстинкции белка зависит от числа остатков ароматических аминокислот. При физиологических значениях рН максимумы поглощения фенилаланина — 205 и 258 нм, тирозина — 222 и 275 нм, триптофана – 220 и 280 нм. Принято считать, что общий максимум поглощения белков соответствует 280 нм.
На основе закона Бугера—Ламберта—Бера можно рассчитать коэффициент экстинкции:
A=εcl, где
•ε — коэффициент молярного поглощения данного вещества; л/(моль*см)
•с — концентрация в-ва; моль/л
•ℓ — длина пути светового пучка в растворе, см
•A – поглощение света = опт.плотность р-ра (представляет десятичный логарифм отношения интенсивности света, поданного на раствор (упавший свет), к интенсивности света, пропущенного им (пропущенный свет))
2.Какие преимущества и недостатки получения целевого белка в растворимой форме при экспрессии его гена в бактериальной культуре?
Экспрессия белков в растворимой форме дешевле, быстрее, так как нет проблем с фолдингом и с дополнительным растворением белка, как в случае с тельцами включения. Недостатки– нестабильность (доступность для протеаз), сложность очистки (так как есть риск повредить белок растворителем).
3.Рассчитайте эффективность трансформации, если для нее использовали 0.5 мкл ДНК с концентрацией 50 мкг/мл, 50 мкл суспензии компетентных клеток и 200 мкл среды, на чашку Петри было высеяно
100мкл культуры, в результате чего выросло 5000 колоний бактерий.
Всего в пробирке: 50 мкл клеток+200 мкл среды + 0,5 мкл р-ра ДНК (конц. 50 мкг/мл или если перевести, то 0.05 мкг/мкл).
На чашку Петри выливали только 100 мкл полученного раствора. Тогда посчитаем, сколько ДНК содержится в этом объеме:
250,5 мкл р-ра - 0.025 мкг ДНК
100 мкл – х мкг ДНК
Х- 0.009980 (̴0.01 мкг ДНК в 100 мкл)
На 1 чашку попало 0.01 мкг ДНК.
Эффективность трансформации = число колоний на чашке / на кол-во ДНК на чашку (мкг)
Эффективность трансформации = 5000/0.01= 5 х 105
Билет №12 Вопрос 1. Какие вещества мешают определению концентрации белка
колориметрическими методами и каким образом можно от них избавиться?
Вещества, которые мешают измерить концентрацию белка – это примесные вещества – соли и пр.
Для того, чтобы нивелировать влияние не поглощающих в диапазоне измерения примесей, используют кювету сравнения, в которой присутствует растворитель, но отсутствует белок. Если используются колориметрические
